高中化学人教版(2019)选择性必修1第二章第三节化学反应的方向
试卷更新日期:2021-08-10 类型:同步测试
一、单选题
-
1. 对于反应 ,下列说法正确是( )A、加入催化剂,改变了反应的途径,反应的△H也随之改变 B、该反应△S>0,△H<0,在任何条件下能自发进行 C、恒温恒容条件下,混合气体密度不变达到化学平衡状态 D、达到平衡状态后,若增加A的量,平衡向正反应方向移动2. 已知在100℃、 Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法不正确的是( )
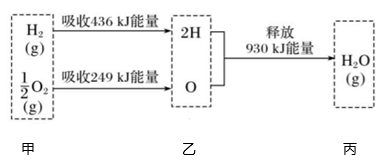 A、1mol (g)分解为2mol H与1mol O时吸收930kJ热量 B、热化学方程式为: C、甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙 D、乙→丙的过程中若生成液态水,释放的能量将小于930kJ3. 以下自发过程可用焓判据来解释的是( )A、硝酸铵固体自发地溶于水 B、2N2O5(g)=4NO2(g)+O2(g) ΔH=56.76 kJ·mol-1 C、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH=74.9 kJ·mol-1 D、2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-14. 将一定量的氨基甲酸铵置于2L恒容真空密闭容器中,在一定温度下达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。不同温度下的平衡数据如下表:
A、1mol (g)分解为2mol H与1mol O时吸收930kJ热量 B、热化学方程式为: C、甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙 D、乙→丙的过程中若生成液态水,释放的能量将小于930kJ3. 以下自发过程可用焓判据来解释的是( )A、硝酸铵固体自发地溶于水 B、2N2O5(g)=4NO2(g)+O2(g) ΔH=56.76 kJ·mol-1 C、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH=74.9 kJ·mol-1 D、2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-14. 将一定量的氨基甲酸铵置于2L恒容真空密闭容器中,在一定温度下达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。不同温度下的平衡数据如下表:温度(℃)
15
20
25
30
35
平衡时气体总浓度(×10-3mol·L-1)
2.40
3.40
4.80
6.80
9.40
下列说法正确的是( )
A、该反应在低温条件下自发 B、氨气的体积分数不变,可以判断反应达到了平衡状态 C、其他条件不变时将容器体积变为1L,NH3平衡浓度不变 D、若25℃时达到平衡所需时间为2min,则0~2min用CO2表示的平均反应速率为4×10-4mol·L-1·min-15. 下列反应均可在室温下自发进行,其中△H>0,△S>0的是( )A、(NH4)2CO3(s) =NH3(g) + NH4HCO3(s) B、Mg(s) + 2HCl(aq) = MgCl2(aq) + H2(g) C、4Fe(OH)2(s)+O2(g)+2H2O(l) = 4Fe(OH)3(s) D、Al(OH)3(s)+3HNO3(aq) =Al(NO3)3(aq)+ 3H2O(l)6. 对于化学反应能否自发进行,下列说法中错误的是( )A、若ΔH<0,ΔS>0,任何温度下都能自发进行 B、若ΔH>0,ΔS<0,任何温度下都不能自发进行 C、若ΔH>0,ΔS>0,低温时可自发进行 D、若ΔH<0,ΔS<0,低温时可自发进行7. 已知“凡气体分子总数增大的反应一定是熵增加的反应”。下列反应一定能自发进行的是( )A、2O3(g)=3O2(g) ∆H<0 B、2CO(g)=2C(s)+O2 (g) ∆H>0 C、N2(g)+3H2(g) ⇌2NH3(g) ∆H<0 D、CaCO3(s)=CaO(s)+CO2(g) ∆H>08. 在25 ℃,1.01×105Pa条件下,反应2N2O5(g)=4NO2(g)+O2(g) △H= +56.7kJ/mol能自发进行的合理解释是( )A、该反应是熵减反应 B、该反应是分解反应 C、该反应的焓变效应大于熵变效应 D、该反应的熵变效应大于焓变效应9. 下列说法正确的是( )A、NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ⋅mol−1 , 能自发进行,原因是△S>0 B、常温下,放热反应一般能自发进行,吸热反应都不能自发进行 C、焓变或熵变均可以单独作为反应自发性的判据 D、在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向10. 下列说法正确的是( )A、凡是放热反应都是自发的,因为吸热反应都是非自发的 B、自发反应的熵一定增大,非自发反应的熵一定减小 C、常温下,反应C(s)+CO2(g) 2CO(g)不能自发进行,则该反应的ΔH>0 D、反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH>011. 250℃,101 kPa时,2N2O5(g)=4NO2(g)+O2(g) △H=+56.76 kJ/mol,该反应能自发进行,其自发进行的主要原因是( )A、是吸热反应 B、是放热反应 C、是熵减反应 D、熵增效应大于能量效应12. 反应CH3OH(l)+NH3(g)=CH3NH2(g)+H2O(g)在某温度自发向右进行,若反应的|ΔH|=17 kJ·mol-1 , |ΔH-TΔS|=17 kJ·mol-1 , 则下列正确的是( )A、ΔH>0,ΔH-TΔS<0 B、ΔH<0,ΔH-TΔS>0 C、ΔH>0,ΔH-TΔS>0 D、ΔH<0,ΔH-TΔS<013. 下列反应在任何温度下均能自发进行的是( )A、2N2(g)+O2(g)=2N2O(g)△H>0 B、3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)△H<0 C、COCl2(g) CO(g)+Cl2(g)△H>0 D、2H2O2(l)=2H2O(l)+O2(g)△H<014. 下列有关说法正确的是 ( )A、化学平衡发生移动,平衡常数必发生变化 B、加入反应物,单位体积内活化分子百分数增大,化学反应速率增大 C、铁片与稀盐酸制取氢气时,加入 NaNO3 固体或 Na2SO4 固体都不影响生成氢气的速率 D、过程的自发性只能用于判断过程的方向性,不能确定过程是否一定会发生和过程发生的速率15. 下列说法中,正确的是( )A、固体溶解是一个熵减小的过程 B、能够自发进行的反应一定是放热反应 C、能够自发进行的反应一定是熵增加的过程 D、同一物质气态时的熵值最大,液态时的次之,固态时的最小16. 在体积均为1.0L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入 和 ,在不同温度下反应 达到平衡,平衡时 随温度的变化如图所示(图中I、Ⅱ、Ⅲ点均处于曲线上).
下列说法正确的是( )
A、该反应的 、 B、体系的总压强 C、平衡常数: D、 时,Ⅳ点所处的状态中 (正) (逆)二、填空题
-
17. 已知2CO(g) CO2(g)+C(s),T=980k时,△H-TΔS=O。当体系温度低于980k时.估计△H-T△S的正负符号为 , 所以正反应进行(填“自发”或“非自发”);当体系温度高于980k时.△H-T△S的正负符号为。 在冶金工业中,以C作为还原剂温度高于980k时的氧化物是以为主,低于980k时以为主。
三、实验探究题
-
18. 汽车尾气是城市主要空气污染物,汽车内燃机工作时发生反应:N2(g) + O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。(1)、已知H2或CO可以催化还原NO以达到消除污染的目的。N2(g) + O2(g) = 2NO(g) △H= +180.5 kJ·mol-1 , 2H2(g) + O2(g) = 2H2O(l) △H=-571.6 kJ·mol-1 , 则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是 , 判断该反应自发进行的条件:(填“高温自发”或“低温自发”)。(2)、当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g) 2CO2(g) + N2(g)中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。

①则该反应的△H0(填“>”或“<”)。
②若催化剂的表面积S1>S2 ,在该图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线。
(3)、某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.
①能判断N2(g)+3H2(g)⇌2NH3(g)达到平衡的是(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②此时N2的平衡分压为MPa.(分压=总压×物质的量分数)。计算出此时的平衡常数Kp=(用平衡分压代替平衡浓度计算,结果保留2位有效数字)。
19.(1)、Ⅰ、反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
该反应是反应(填“吸热”、“放热”)。
(2)、当反应达到平衡时,升高温度,A的转化率(填“增大”、“减小”、“不变”)。(3)、反应体系中加入催化剂对反应热是否有影响?(填“有”、“无”),原因是。(4)、在反应体系中加入催化剂,反应速率增大,E1的变化是:E1(填“增大”、“减小”、“不变”)。(5)、Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2 , 一段时间后反应达平衡状态,实验数据如下表所示:t/s
0
50
150
250
350
n(PCl5)/mol
0
0.24
0.36
0.40
0.40
50~150s内的平均反应速率v(PCl3)=。
(6)、该温度下,此反应的化学平衡常数的数值为。(7)、反应至250s时,该反应放出的热量为kJ。(8)、下列关于上述反应的说法中,正确的是(填字母序号)。a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.2molPCl3、0.5molCl2 和0.15mol PCl5 , 则反应向正反应方向进行
四、综合题
-
20. 氢元素单质及其化合物是人类赖以生活的重要能源。回答下列问题(1)、H-H、O=O、H-O的键能分别为436 kJ·mol-1、496 kJ·mol-1、463 kJ·mol-1。
①热化学方程式2H2(g)+O2(g)=2H2O(g) ∆H,∆H为kJ·mol-1。
②氢气的燃烧热∆H=-285.8 kJ·mol-1 , 表示氢气燃烧热的热化学方程式为。
③1 mol水蒸气液化放热kJ。
(2)、肼(N2H4)是一种液态火箭推进剂。N2H4分解的能量变化如图所示:
①正反应的活化能为kJ·mol-1 , 气态肼分解的热化学方程式为。
②该反应的∆S(填“>”“<”或“=”)0,该反应自发进行的条件为(填“高温”“低温”或“任意温度”)。
21. 下列有关说法正确的是( )A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 B、已知C(石墨,s)=C(金刚石,s) ΔH>0,故金刚石比石墨稳定 C、放热且熵增加的反应不一定能正向自发进行 D、升高温度能增大单位体积内的活化分子数,加快反应速率22. CO、CH4 和 N2H4都可以作为燃料。回答下列问题:(1)、工业制氢气原理如下:CH4(g)+H2O(g)⇌CO(g)+3H2(g) △H= +206.4 kJ·mol-1。该反应能自发进行的条件为:。(选填“任何条件”、“低温”、“高温”、“任何条件均不能自发”)(2)、对于上述反应一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是。a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
(3)、恒温恒容条件下,以下能说明该反应达到平衡状态的是。a.v消耗(CO)=v生成(H2O) b.c(H2O)=c(CO)
c.混合气体的总物质的量不再改变 d.混合气体的密度不再改变
e.混合气体平均相对分子质量不再改变 f.氢气的质量分数不再改变
(4)、肼(N2H4)和NO2是一种双组分火箭推进剂。两种物质混合发生反应生成N2和H2O(g),已知8 g气体肼在上述反应中放出142 kJ热量,其热化学方程式为。(5)、草酸与KMnO4在酸性条件下能够发生如下反应:MnO +H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。用4 mL0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:组别
10%硫酸体积/mL
温度/℃
其他物质
Ⅰ
2
20
/
Ⅱ
2
20
10滴饱和MnSO4溶液
Ⅲ
2
30
/
Ⅳ
1
20
1 mL蒸馏水
如果研究催化剂对化学反应速率的影响,应选用实验和(用Ⅰ~Ⅳ表示)。
23.(1)、已知下列热化学方程式:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1=+260kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
请写出用CH4与O2反应生成CO和H2的的热化学方程式。
(2)、在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题:t/K
298
398
498
K/(mol/L)-2
4.1×106
K1
K2
①比较K1、K2的大小,K1K2(填写“>”“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据的是(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.3v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比1:3:2通入N2、H2、NH3 , 与原平衡相比,N2的物质的量浓度(填“增大”或“减小”或“不变”,下同),NH3的体积分数。
(3)、高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g) △H>0。①其平衡常数可表示为。
②已知1100℃时K=0.263,1100℃时测得高炉中c(CO2)=0.025 mol/L,c(CO)=0.1mol/L,此时CO气体的转化率为(用百分数表示),该反应是否处于化学平衡状态(选填“是”或“否”),此时,化学反应速率是υ正υ逆(选填“大于”、“小于”或“等于”)。
-