高中化学人教版(2019)选择性必修1第二章第二节化学平衡
试卷更新日期:2021-08-10 类型:同步测试
一、单选题
-
1. 在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)
 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( ) 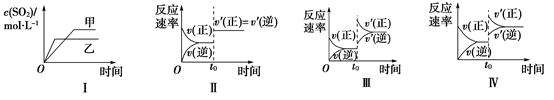 A、图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 B、图Ⅱ表示t0时刻使用催化剂对反应速率的影响 C、图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 D、图Ⅳ表示t0时升温对反应速率的影响2. 已知反应CO(g)+H2O(g) CO2 (g)+H2 (g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )A、升高温度,K增大 B、减小压强,n(CO2)增加 C、更换高效催化剂, CO转化率增大 D、充入一定量的氮气,n(H2)不变3. 一定温度的恒容密闭容器中进行如下可逆反应A(s)+2B(g)
A、图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 B、图Ⅱ表示t0时刻使用催化剂对反应速率的影响 C、图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 D、图Ⅳ表示t0时升温对反应速率的影响2. 已知反应CO(g)+H2O(g) CO2 (g)+H2 (g) ΔH<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )A、升高温度,K增大 B、减小压强,n(CO2)增加 C、更换高效催化剂, CO转化率增大 D、充入一定量的氮气,n(H2)不变3. 一定温度的恒容密闭容器中进行如下可逆反应A(s)+2B(g) 2C(g),下列叙述中,能说明反应已达到化学平衡状态的是( ) A、A,B,C的分子数之比为1:2:2 B、混合气体的密度不再变化 C、容器内的压强不再变化 D、单位时间内生成amolA,同时消耗2amolC4. 5mL 0.1mol/L的KI溶液与1mL 0.1mol/L的FeCl3溶液发生反应:
2C(g),下列叙述中,能说明反应已达到化学平衡状态的是( ) A、A,B,C的分子数之比为1:2:2 B、混合气体的密度不再变化 C、容器内的压强不再变化 D、单位时间内生成amolA,同时消耗2amolC4. 5mL 0.1mol/L的KI溶液与1mL 0.1mol/L的FeCl3溶液发生反应:2Fe3+(aq)+2I-(aq)
 2Fe2+(aq)+I2(aq),达到平衡,下列说法中不正确的是( )A、该反应的平衡常数K=c2(Fe2+)/c(Fe3+)•c(I2) B、经CCl4多次萃取后,向水溶液中滴入KSCN溶液,呈血红色,说明该反应存在限度 C、加入碘化钾固体,平衡正向移动 D、当溶液的颜色不再发生变化时,可以判断该反应已经达到平衡状态5. 研究反应 的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( )
2Fe2+(aq)+I2(aq),达到平衡,下列说法中不正确的是( )A、该反应的平衡常数K=c2(Fe2+)/c(Fe3+)•c(I2) B、经CCl4多次萃取后,向水溶液中滴入KSCN溶液,呈血红色,说明该反应存在限度 C、加入碘化钾固体,平衡正向移动 D、当溶液的颜色不再发生变化时,可以判断该反应已经达到平衡状态5. 研究反应 的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( ) A、比较实验①④不能得出:升高温度,化学反应速率加快 B、比较实验①②得出:増大反应物浓度,化学反应速率加快 C、若实验②③只有一个条件不同,则实验③使用了催化剂 D、在0~10 min之向,实验②的平均速率v(Y)=0.01mol/(L·min)6. 一定温度下,在体积为2L的恒容密闭容器中发生反应:
A、比较实验①④不能得出:升高温度,化学反应速率加快 B、比较实验①②得出:増大反应物浓度,化学反应速率加快 C、若实验②③只有一个条件不同,则实验③使用了催化剂 D、在0~10 min之向,实验②的平均速率v(Y)=0.01mol/(L·min)6. 一定温度下,在体积为2L的恒容密闭容器中发生反应:反应过程中的部分数据如下表所示:
n/mol
t/min
n(A)
n(B)
n(C)
0
4.0
1.0
0
2
0.6
0.2
4
0.4
6
2.8
0.3
下列说法正确的是( )
A、 min时,该反应可能已达到平衡 B、反应开始后,不管t取何值,A与B的转化率均不可能相等 C、反应达到平衡状态时,用B表示的平均反应速率为0.05 D、 min时,反应放出的热量为0.6Q kJ7. 在 时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下表,下列说法错误的是( )物质
X
Y
Z
起始浓度/( )
0.1
0.2
0
平衡浓度/( )
0.05
0.1
0.1
A、反应达到平衡时,Y的转化率为50% B、反应可表示为 ,平衡常数为200 C、其他条件不变时,增大压强可使平衡向右移动 D、若升温后Z的平衡浓度减小,则该反应为放热反应8. 在密闭容器中充入一定量的NO2 , 发生反应2NO2(g) N2O4(g)ΔH=﹣57 kJ•mol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
N2O4(g)ΔH=﹣57 kJ•mol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )  A、a、c两点的反应速率:a>c B、a、b两点的转化率:a<b C、a、c两点气体的颜色:a深,c浅 D、由a点到b点,可以用加热的方法9. 工业上制备纯硅的热化学方程式如下:SiCl4(g)+2H2(g)
A、a、c两点的反应速率:a>c B、a、b两点的转化率:a<b C、a、c两点气体的颜色:a深,c浅 D、由a点到b点,可以用加热的方法9. 工业上制备纯硅的热化学方程式如下:SiCl4(g)+2H2(g) Si(s)+4HCl(g) ΔH=+QkJ·mol-1(Q>0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( ) A、反应过程中,若增大压强能提高SiCl4的转化率 B、若反应开始时SiCl4为1mol,则在平衡时,吸收热量为QkJ C、将反应的温度由T1升高至T2 , 则对应温度下的平衡常数K1>K2 D、当反应吸收热量为0.25QkJ时,生成的HCl恰好与1 mol NaOH反应10. 化学反应Ⅰ、Ⅱ、Ⅲ在不同温度时达到平衡,其平衡常数如下表:
Si(s)+4HCl(g) ΔH=+QkJ·mol-1(Q>0);某温度、压强下,将一定量反应物通入密闭容器进行反应,下列叙述正确的是 ( ) A、反应过程中,若增大压强能提高SiCl4的转化率 B、若反应开始时SiCl4为1mol,则在平衡时,吸收热量为QkJ C、将反应的温度由T1升高至T2 , 则对应温度下的平衡常数K1>K2 D、当反应吸收热量为0.25QkJ时,生成的HCl恰好与1 mol NaOH反应10. 化学反应Ⅰ、Ⅱ、Ⅲ在不同温度时达到平衡,其平衡常数如下表:编号
化学方程式
温度
Ⅰ
1.47
2.15
Ⅱ
1.62
b
Ⅲ
a
1.68
根据以上信息判断,下列结论正确的是( )
A、将铁粉磨细可以使平衡Ⅰ向右移动 B、反应Ⅱ、Ⅲ均为放热反应 C、升高温度,反应Ⅲ平衡向正反应方向移动 D、11. 一定条件下,在体积不变的绝热密闭容器中,发生反应 。能表示该反应一定达到化学平衡状态的是( )A、单位时间内消耗 ,同时生成 B、混合气体总物质的量不再发生变化 C、Y和Z的物质的量浓度相等 D、容器中的压强不再发生变化12. 在某一密闭容器中,若反应 达到平衡后,保持其温度不变,将该密闭容器的体积增加一倍,当达到新的平衡时,则下列说法正确的是( )A、容器内气体密度减小 B、平衡向正反应方向移动 C、二氧化氮的转化率增大 D、四氧化二氮的体积分数增大13. 乙烯的产量是衡量一个国家石油化工发展水平的重要标志。一定条件下CO2和H2合成乙烯的反应为2CO2(g) + 6H2(g)= 4H2O(g) + CH2=CH2(g) ΔH= a kJ∙mol-1。向恒容密闭容器中充入体积比为1:3的CO2和H2 , 测得不同温度下CO2的平衡转化率及催化剂的催化效率如图所示。下列有关说法正确的是( )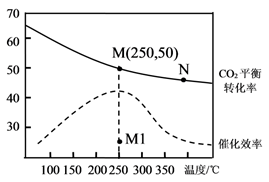 A、M点的平衡常数比N点的小 B、温度低于250℃时,乙烯的产率随温度升高而增大 C、保持N点温度不变,向容器中再充入一定量的H2 , CO2的转化率可能会增大到50% D、其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1点14. 在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列各项能作为判断该反应达到化学平衡状态的依据的是( )A、容器内的压强保持不变 B、容器内混合气体的密度保持不变 C、混合气体中 和 的物质的量浓度之比为1∶3 D、单位时间内每断裂3molH—H键,同时形成6molN—H键15. 反应N2(g)+3H2(g) 2NH3(g)ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是:( )A、容器内的温度不再变化 B、相同时间内断开H-H键数目和生成N-H键数目相等 C、容器内的压强不再变化 D、容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶216. 一定压强下,向10 L密闭容器中充入1molS2Cl2(g)和1 molCl2 , 发生反应:S2Cl2(g)+Cl2(g)⇌2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中错误的是( )
A、M点的平衡常数比N点的小 B、温度低于250℃时,乙烯的产率随温度升高而增大 C、保持N点温度不变,向容器中再充入一定量的H2 , CO2的转化率可能会增大到50% D、其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1点14. 在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列各项能作为判断该反应达到化学平衡状态的依据的是( )A、容器内的压强保持不变 B、容器内混合气体的密度保持不变 C、混合气体中 和 的物质的量浓度之比为1∶3 D、单位时间内每断裂3molH—H键,同时形成6molN—H键15. 反应N2(g)+3H2(g) 2NH3(g)ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是:( )A、容器内的温度不再变化 B、相同时间内断开H-H键数目和生成N-H键数目相等 C、容器内的压强不再变化 D、容器内气体的浓度c(N2)∶c(H2)∶c(NH3)=1∶3∶216. 一定压强下,向10 L密闭容器中充入1molS2Cl2(g)和1 molCl2 , 发生反应:S2Cl2(g)+Cl2(g)⇌2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中错误的是( ) A、A,B,C,D四点对应状态下,达到平衡状态的是B,D B、正反应的活化能大于逆反应的活化能 C、达到平衡后再加热,平衡向逆反应方向移动 D、在300℃下,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率不变17. 在某2L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)⇌3Z(g) ∆H , 反应过程中持续升高温度,相同时间内测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
A、A,B,C,D四点对应状态下,达到平衡状态的是B,D B、正反应的活化能大于逆反应的活化能 C、达到平衡后再加热,平衡向逆反应方向移动 D、在300℃下,达到平衡后缩小容器容积,重新达到平衡后,Cl2的平衡转化率不变17. 在某2L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)⇌3Z(g) ∆H , 反应过程中持续升高温度,相同时间内测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( ) A、升高温度,平衡常数增大 B、M点时,Y的转化率最大 C、平衡后充入Z,正反应速率减小 D、W,M两点Y的正反应速率不同18. 生命过程与化学平衡移动密切相关。血红蛋白(Hb)与O2结合成氧合血红蛋白(Hb(O2))的过程可表示为:Hb+O2(g) Hb(O2)。下列说法正确的是( )A、体温升高,O2与Hb结合更快,反应的平衡常数不变 B、吸入新鲜空气,平衡逆向移动 C、CO达到一定浓度易使人中毒,是因为结合Hb使Hb(O2)分解速率增大 D、高压氧舱治疗CO中毒的原理是使平衡Hb(CO)+O2(g) Hb(O2)+CO(g)右移
A、升高温度,平衡常数增大 B、M点时,Y的转化率最大 C、平衡后充入Z,正反应速率减小 D、W,M两点Y的正反应速率不同18. 生命过程与化学平衡移动密切相关。血红蛋白(Hb)与O2结合成氧合血红蛋白(Hb(O2))的过程可表示为:Hb+O2(g) Hb(O2)。下列说法正确的是( )A、体温升高,O2与Hb结合更快,反应的平衡常数不变 B、吸入新鲜空气,平衡逆向移动 C、CO达到一定浓度易使人中毒,是因为结合Hb使Hb(O2)分解速率增大 D、高压氧舱治疗CO中毒的原理是使平衡Hb(CO)+O2(g) Hb(O2)+CO(g)右移二、多选题
-
19. 一定温度下,在体积为 VL 的密闭容器中加入 1molX 和 1molY 进行如下反应: X(g)+ Y(g ) 2Z(g )+ W(s);ΔH >0 达到平衡,下列判断正确的是( )A、平衡后加入 X,开始时,正、逆反应速率均增大 B、恒温恒压向平衡混合物中加入少量氦气,上述反应不发生移动 C、温度不变,将容器的体积变为 2VL,Z 的平衡浓度变为原来的 1/2 D、温度和容器体积不变时,向平衡混合物中加入 1molX 和 1molY,重新达到平衡状态时,Z 的质量分数增大20. SO3通常通过SO2的氧化反应制得。某实验探究小组在实验室中模拟在不同条件下制备SO3的反应,在3个初始温度均为T℃的密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,实验数据如下。下列说法正确的是( )
容器编号
容器类型
初始体积
起始物质的量/mol
平衡时SO3物质的量/mol
SO2
O2
SO3
Ⅰ
恒温恒容
1.0L
2
1
0
1.6
Ⅱ
绝热恒容
1.0L
2
1
0
a
Ⅲ
恒温恒压,
0.5L
0
0
1
b
A、a<1.6 B、b>0.8 C、平衡时v正(SO2)的大小关系:v(I)<v(II) D、若起始时向容器I中充入1.0 mol SO2(g)、0.20 mol O2(g)和4.0 mol SO3(g),则反应将向正反应方向进行21. 初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生如下反应:4HCl(g)+O2(g) 2Cl2(g)+2H2O(g) ΔH=-116kJ·mol-1 , 测得反应的相关数据如下:容器
容器类型
初始体积
初始压强/Pa
反应物投入量/mol
平衡时Cl2的物质的量/mol
HCl
O2
Cl2
H2O
I
恒温恒容
1L
4
1
0
0
1
II
绝热恒容
1L
p2
0
0
2
2
a
III
恒温恒压
2L
p3
8
2
0
0
b
下列说法正确的是( )
A、反应4HCl(g)+O2(g) 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1 B、a>1, b>2 C、p2=1.6×105Pa,p3=4×105Pa D、若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行22. 在三个容积相同的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下发生反应CH4(g)+ H2O(g) CO(g) + 3H2(g)(不发生其他反应),CH4的平衡转化率与温度、压强的关系如图所示。容器
起始物质的量/mol
CH4的平衡
转化率
CH4
H2O
CO
H2
Ⅰ
0.1
0.1
0
0
50%
Ⅱ
0.1
0.1
0.1
0.3
/
Ⅲ
0
0.1
0.2
0.6
/

下列说法错误的是( )
A、该反应的 H>0,图中压强p1>P2 B、起始时,容器Ⅱ中v(CH4)正<v(CH4)逆 C、达到平衡时,容器Ⅰ、Ⅱ中CO的物质的量满足:n(CO)Ⅱ< 2n(CO)Ⅰ D、达到平衡时,容器Ⅱ、Ⅲ中气体的总压强之比PⅡ∶PⅢ = 4∶5三、填空题
-
23. H2O由液态变为气态的过程可以用下式来表示:H2O(l) H2O(g)。我们也可以用平衡移动原理来解释这一变化中的一些问题,如:H2O的汽化是吸热过程,所以温度升高,平衡向生成更多的H2O(g)的方向移动。若减小压强,平衡向移动。所以高山上由于空气稀薄,水的沸点比平地上(填高或低),高压锅中水的沸点比普通锅中水的沸点(填高或低)。24. 稀氨水中存在下述电离平衡:NH3+H2O NH3·H2O NH +OH-。试分析向溶液中分别加入下列物质时,平衡如何移动:
加入的物质
氯化铵
氨气
氢氧化钠
平衡移动方向
25. 在2SO2+O2 2SO3的平衡体系中,加入18O构成的氧气,当平衡发生移动后,SO2中18O的含量(增加、减少、或不变)
2SO3的平衡体系中,加入18O构成的氧气,当平衡发生移动后,SO2中18O的含量(增加、减少、或不变) 四、实验探究题
-
26. 某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:

根据上述数据,完成下列填空:
(1)、在实验1,反应在10至20分钟时间内平均速率为mol/(L·min)。(2)、在实验2,A的初始浓度c2=mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是。(3)、设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3v1(填>、=、<),且c31.0 mol/L(填>、=、<)。(4)、比较实验4和实验1,可推测该反应是反应(选填吸热、放热)。理由是27. 甲醇(CH3OH)是一种重要的化工原料,可由H2与CO或CO2反应制备,主要用于制备羧基甲酯等。(1)、水杨酸甲酯是无色透明油状液体,密度为1.54g·cm-3 , 常作为医药制剂的赋香剂。制备及提纯水杨酸甲酯的实验步骤如下:步骤1.在三口烧瓶中加入3.5g(0.025mol)水杨酸
 、15mL(0.375mol)甲醇、1mL浓硫酸,几粒沸石,在85~95℃加热回流1.5h(装置如图所示)。
、15mL(0.375mol)甲醇、1mL浓硫酸,几粒沸石,在85~95℃加热回流1.5h(装置如图所示)。
步骤2.向回收甲醇后剩余液中加入10mL水,振荡、静置,分液出有机相。
步骤3.有机相依次用水、10%Na2CO3溶液、水洗涤。
步骤4.干燥,蒸馏并收集221~224℃馏分。
①图中仪器W的名称是。
②步骤3,第一次水洗的主要目的是;第二次水洗的目的是。
③合成水杨酸甲酯的化学方程式为;实验中加入过量甲醇的目的是。
(2)、工业上制备甲醇的主要反应有:(Ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 平衡常数K1
(Ⅱ)CO(g)+2H2(g) CH3OH(g) ΔH2 平衡常数K2
(Ⅲ)CO2(g)+H2(g) CO(g)+H2O(g) ΔH3 平衡常数K3
维持 =75:25,CO、CO2以及n(CO2):n(CO)=1:2,用不同催化剂时甲醇的产率随温度的变化如图所示:

①平衡常数K3=(用K1、K2表示);△H10(填“>"或“<”)。
②下列叙述正确的是 (填标号)。
A.催化剂Cu/ZnO不能催化反应(I)
B.催化剂Cu/ZnO在温度低于480K时活性很低
C.图中a点所示条件下,延长反应时间能提高甲醇的产率
D.图中b点所示条件下,若增加H2的浓度不能提高甲醇的产率
③400K时向某恒容密闭容器中充入CO和H2 , 使c(CO)=0.10mol·L-1 , c(H2)=0.20mol·L-1 , 且只发生反应(II);平衡时c(CH3OH)=0.08mol·L-1。该温度下反应(II)的平衡常数为。
28. 乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)25℃时,K=2.95×1011①
2CO(g)+4H2(g) CH3CH2OH(g)+H2O2(g)25℃时,K=1.71×1022②
(1)、写出反应①的平衡常数表达式K= 。(2)、条件相同时,反应①与反应②相比,转化程度更大的是。(3)、在一定压强下,测得反应①的实验数据如下表。根据表中数据分析:
温度(K)CO2/转化率(%)n(H2)/n(CO2)
500
600
700
800
1.5
45
33
20
12
2
60
43
28
15
3
83
62
37
22
①温度升高,K值(填“增大”、“减小”或“不变”)。
②提高氢碳比[n(H2)/n(CO2)],K值填“增大”、“减小”或“不变”),对生成乙醇(填“有利”或“不利”)
五、综合题
-
29. 二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:(1)、利用水煤气合成二甲醚的总反应为:
3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH= - 246.4kJ·mol-1
它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g),ΔH1= - 205.1kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g);ΔH2 = 。
(2)、在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的是 (填字母代号)。A、降低温度 B、加入催化剂 C、缩小容器体积 D、增加H2的浓度 E、增加CO的浓度(3)、在一体积可变的密闭容器中充入3molH2、3molCO、1molCH3OCH3、1molCO2 , 在一定温度和压强下发生反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。问:①该反应的平衡常数表达式为:
②反应开始时正、逆反应速率的大小:v(正)v(逆)。(填“>”、“<”或“=”)
③平衡时CO的转化率=。
30. 2020年9月22日,中国国家主席习近平在第七十五届联合国大会上庄严宣布,中国将力争2030年前实现碳达峰、2060年前实现碳中和。研究CO2的转化及高值化利用具有重要意义。(1)、I.已知CO2溶于水 过程及其平衡常数可表示为:
过程及其平衡常数可表示为: , 表示CO2的平衡压强, , ,
天然雨水的pH<7,用电离方程式解释其原因。
(2)、将CO2通入NaClO水溶液中,发生的主要反应为 。写出该反应的平衡常数表达式:K=[用 、 和 的式子表示](3)、根据平衡常数计算说明CO2通入NaClO水溶液中,主要反应并非::。
(4)、II.在双功能催化剂作用下。由CO2加氢可以合成二甲醚。涉及以下主要反应。反应1(甲醇合成):
反应2(甲醇脱水):
反应3(逆水汽变换):
相关物质变化的焓变示意图如下:

双功能催化剂通常由甲醇合成活性中心和甲醇脱水活性中心组成。在一定条件下,将CO2与H2以1:3体积比通过双功能催化剂,测定含碳产物的物质的量分数随时间变化如图1所示。

写出反应3的热化学方程式。
(5)、在图2中画出采用双功能催化剂由CO2加氢合成二甲醚的能量变化图。(6)、下列说法正确的是___________。A、为提高工业生产效率,合成二甲醚的适宜条件是高温高压 B、可通过监测反应体系中CH3OCH3和H2O浓度比判断 否达到平衡
C、反应达平衡时,若缩小容器体积,反应3平衡不发生移动
D、一定温度、压强下,寻找活性更高的催化剂,是提高CO2平衡转化率的研究方向
31. 含碳物质的转化,有利于“减碳”和可持续性发展,有重要的研究价值。(1)、以 和 为原料合成尿素是利用 的成功范例。在尿素合成塔中的主要反应:
否达到平衡
C、反应达平衡时,若缩小容器体积,反应3平衡不发生移动
D、一定温度、压强下,寻找活性更高的催化剂,是提高CO2平衡转化率的研究方向
31. 含碳物质的转化,有利于“减碳”和可持续性发展,有重要的研究价值。(1)、以 和 为原料合成尿素是利用 的成功范例。在尿素合成塔中的主要反应:反应Ⅰ:
反应Ⅱ:
总反应Ⅲ:
①反应Ⅰ的 kJ/mol。
②一定温度下,恒容的密闭容器中按化学计量数比投料进行反应Ⅲ,下列能说明反应Ⅲ达到化学平
衡状态的是。
A.容器内气体总压强不再变化 B. 与 的浓度相等
C. D. 保持不变
(2)、利用工业废气中的 可以制取甲醇, ,一定条件下往1L的密闭容器中充入 和 ,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内 的转化率随温度变化如(图一)所示:
①b点v(正)v(逆)(填“>”、“<”、“=”)
②温度为 时,该反应的平衡常数K=。
③若某温度下反应已达平衡,下列措施中有利于提高 平衡转化率的是。
A.使用高效催化剂 B.不断分离出产物
C.提高原料气中 的比例 D.升温
(3)、电解法转化 可实现 资源化利用,电解 制CH4的原理如(图二)所示。铜电极上发生的电极反应式是。32. CO2的回收与利用是科学家研究的热点课题。(1)、由CO2转化为羧酸是CO2资源化利用的重要方法。在催化作用下CO2和CH4合成CH3COOH的化学方程式为在合成CH3 COOH的反应中,下列有关说法正确的是。 (填字母)A.利用催化剂可以使反应的平衡常数增大
B.CH4→CH3COOH过程中,有C-H键发生断裂
C.有22. 4LCH4参与反应时转移4mol电子
D.该反应为放热反应
(2)、CO2和H2合成甲醇也是CO2资源化利用的重要方法。测得平衡时甲醇产率与反应温度、压强的关系如图所示。
①若H2(g)和CH3OH(l)的燃烧热分别为285.8kJ●mol-1和726.5kJ●mol-1 , 则由CO2和H2生成液态甲醇和液态水的热化学方程式为。此反应的活化能Ea(正)Ea(逆)(填“>”或“<”),该反应应选择高效催化剂(填“高温”或“低温”)。
②下列措施能使CO2的平衡转化率提高的是(填序号)。
A.增大压强 B.升高温度 C.增大H2与CO2的投料比 D.改用更高效的催化剂
③200℃时,将0.100molCO2和0.200molH2充入1L密闭容器中,在催化剂作用下反应达到平衡。若平衡时CO2的转化率为50%,则此温度下该反应的平衡常数K=(已知CH3OH的沸点为64.7℃)。
(3)、可利用电解的方法将CO2转化为CH3OH,请写出在酸性条件下的阴极反应式。