上海市普陀区2021年中考化学模拟试卷
试卷更新日期:2021-08-10 类型:中考模拟
一、单选题
-
1. 属于化学变化的是( )A、干冰气化 B、熟石灰中和土壤酸性 C、浓盐酸挥发 D、分离液态空气得到氧气2. 下列属于溶液的是( )A、自来水 B、冰水 C、豆浆 D、牛奶3. 灼烧下列物质,火焰呈黄色的是( )A、KCl B、CuCl2 C、NaCl D、CaCl24. 三氧化硫(SO3)中硫元素的化合价为( )A、-2 B、+2 C、+4 D、+65. 属于同素异形体的是( )A、水和双氧水 B、氧气和液氧 C、金刚石和石墨 D、一氧化碳和二氧化碳6. 有关尿素 说法正确的是( )A、是氧化物 B、可以用做氮肥 C、摩尔质量是60 D、元素质量分数最高的是氧元素7. 水电解的化学方程式正确的是( )A、 B、 C、 D、8. 煤在燃烧前通常磨成粉状的目的是( )A、减少二氧化碳的排放 B、减少二氧化硫的排放 C、减少氧气的消耗 D、增加与空气的接触面积9. 铁与稀盐酸反应的现象是( )A、有气泡生成 B、生成蓝色溶液 C、生成氯化亚铁 D、生成白色沉淀10. 一定能将不饱和溶液变为饱和溶液的方法是( )A、升温 B、降温 C、加溶剂 D、加溶质11. 某反应的微观示意图如图,其中方框中物质的微粒示意图是( )
 A、
A、 B、
B、
 C、
C、
 D、
D、


 12. 符合启普发生器工作原理的装置是( )A、
12. 符合启普发生器工作原理的装置是( )A、 B、
B、 C、
C、 D、
D、 13. 有关物质的量说法正确的是( )A、符号是mol B、等质量的氧气和臭氧物质的量比是1:1 C、是描述微粒集合体的物理量 D、是物质的质量14. 盐的组成中一定含有()A、非金属元素 B、金属元素 C、氧元素 D、氢元素15. 用一定量AgNO3溶液进行了如图实验,下列说法正确的是( )
13. 有关物质的量说法正确的是( )A、符号是mol B、等质量的氧气和臭氧物质的量比是1:1 C、是描述微粒集合体的物理量 D、是物质的质量14. 盐的组成中一定含有()A、非金属元素 B、金属元素 C、氧元素 D、氢元素15. 用一定量AgNO3溶液进行了如图实验,下列说法正确的是( ) A、若溶液甲呈蓝色,则向溶液加入稀盐酸可能有白色沉淀产生 B、若溶液甲呈蓝色,滤渣中一定有Ag,一定无Cu C、若固体乙中加入稀盐酸,无气泡生成,则溶液甲一定呈无色 D、若固体乙中加入稀盐酸,有气泡生成,则溶液甲可能呈蓝色
A、若溶液甲呈蓝色,则向溶液加入稀盐酸可能有白色沉淀产生 B、若溶液甲呈蓝色,滤渣中一定有Ag,一定无Cu C、若固体乙中加入稀盐酸,无气泡生成,则溶液甲一定呈无色 D、若固体乙中加入稀盐酸,有气泡生成,则溶液甲可能呈蓝色二、多选题
-
16. 能用于鉴别氢氧化钠溶液和稀盐酸的是( )A、酚酞 B、Na2SO4 C、 D、17. 关于置换反应的说法正确的是( )A、置换反应一定在溶液中进行 B、有金属单质参加的反应一定是置换反应 C、置换反应一定有单质生成 D、置换反应一定有元素存在状态的变化
三、填空题
-
18. 2021年3月,我国把“碳达峰、碳中和”纳入生态文明建设整体布局,深入树立“绿水青山就是金山银山”的理念。
①空气常新。空气是一种(选填“混合物”或“纯净物”),其中体积分数为21%的气体是(填写气体的化学式),该气体的用途是。(写一点即可)
②绿水长流。天然水中含有许多杂质,模拟自来水厂净水过程:其中吸附用到的物质是 , 除去异味、色素或有毒气体等:加氯的作用是。
③能源转型。天然气作为最具潜力的清洁能源,其主要成分是甲烷(CH4),属于(选填“有机”或“无机”)物,0.2mol甲烷分子中约含个碳原子。
19. 硝酸钾和氯化钠的部分溶解度数据见下表。温度(℃)
10
20
30
40
60
80
100
溶解度(g/100g水)
硝酸钾
20.9
31.6
45.8
64
110
169
246
氯化钠
35.8
36
36.3
36.4
37
38.4
39.8
①从含有80g硝酸钾和9g氯化钠的混合物中提纯硝酸钾,进行如下实验(实验中不考虑各种损耗)
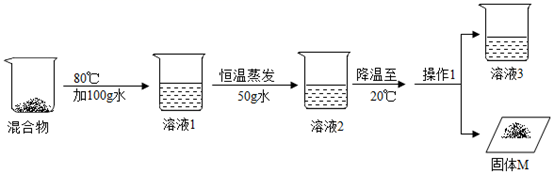
Ⅰ80℃时,硝酸钾的溶解度是。
Ⅱ80℃时,“溶液1”是(选填“饱和”或“不饱和”)溶液。将此溶液恒温蒸发50g水,降温至20℃,所得“溶液3”中硝酸钾的溶质质量分数是。
Ⅲ“溶液2”中硝酸钾质量(选填“<”“>”或“=”)“溶液3”中硝酸钾质量。
Ⅳ若固体M是纯净物,为得到更多固体M,“溶液3”最多还可以恒温蒸发g水。
②20℃时,在100克水中分别放入等质量的硝酸钾和氯化钠,都形成了饱和溶液,如右图所示。

请用两种不同的方法鉴别A和B烧杯中的物质,写出方法、现象与结论。
方法一。
方法二。
四、综合题
-
20. 粗盐中常含有MgCl2、Na2SO4等杂质,现将这份粗盐样品采用两种不同方法进行NaCl的提纯,流程如图:
①方法一

Ⅰ每步所加试剂均过量的原因是。
Ⅱ写出加入过量NaOH溶液反应的化学方程式。
Ⅲ写出加入过量BaCl2溶液反应的化学方程式。
Ⅳ通过规范的实验操作,甲同学所得的NaCl固体比粗盐样品中的NaCl的质量大,流程中增加NaCl质量的反应有个。
②方法二

Ⅰ提出该方法的同学认为:可用一种试剂X取代方法一中过量NaOH溶液和过量BaCl2溶液,达到提纯NaCl的目的,写出X的化学式。
Ⅱ请依次判断两种方法中所得沉淀的质量关系。
沉淀
选填“相等”“不相等”或“无法判断”
BaSO4
BaCO3
21. 某兴趣小组同学取10g氧化铜和炭粉,通过下列实验对其中炭粉含量进行测定。实验前进行知识准备: (1)、①关闭弹簧夹,打开分液漏斗活塞。写出A中化学反应方程式;点燃酒精灯,将尖嘴管对着火焰,以提高温度。
(1)、①关闭弹簧夹,打开分液漏斗活塞。写出A中化学反应方程式;点燃酒精灯,将尖嘴管对着火焰,以提高温度。②装置B玻璃管中发生的反应为 ,体现出碳的性。
③测定炭粉含量可通过以下两种方法:
(2)、Ⅰ方法一:弹簧夹保持关闭状态,反应一段时间直至固体颜色不再变化后停止加热,装置D中澄清石灰水不变浑浊的原因是。若CO2已被装置C完全吸收,写出反应的化学方程式 , 称量装置C,质量比反应前增重2.2g,计算参加反应的氢氧化钠的物质的量为mol。请判定该方法能否测定混合物中炭粉含量,并阐述你的理由。(3)、Ⅱ方法二:打开弹簧夹,加热装置B直至固体颜色不再变化后停止加热,继续通O2至装置冷却,目的是能将残留在装置中的剩余气体全部赶入装置C,还可以。通过称量装置(选填“A”“B”或“C”)反应前后的总质量计算出原混合物中炭粉含量。