高中化学人教版(2019)选择性必修1第一章第一节反应热
试卷更新日期:2021-08-06 类型:同步测试
一、单选题
-
1. 下列反应属于吸热反应的是 ( )A、酸碱中和反应 B、葡萄糖在人体内氧化分解 C、Ba(OH)2·8H2O与NH4Cl反应 D、锌粒与稀H2SO4反应制取H22. 下列说法中正确的是( △H的绝对值均正确)( )A、热值指在一定条件下单位质量的物质完全燃烧所放出的热量,则CO热值为10.1kJ/g B、已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,则稀醋酸与稀氢氧化钠溶液反应生成1mol水的中和热为-57.3kJ/mol C、C2H5OH的燃烧热C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1367.0kJ/mol D、N2+2O2=2NO2 △H=67.8kJ/mol3. 根据下列信息判断氢气燃烧生成水时的热量变化,其中不正确的是( )
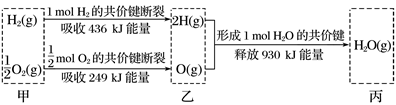 A、H2O(g)分解为H2(g)与O2(g)时吸收热量 B、甲、乙、丙中物质所具有的总能量乙最高 C、1 mol H2(g)与0.5 mol O2(g)反应生成1 mol H2O(l)释放能量为245 kJ D、2 mol H2O(g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低4. 下列说法不正确的是( )A、化学反应必然伴随发生能量变化 B、能量变化必然伴随发生化学反应 C、化学反应中的能量变化主要是由化学键变化引起的 D、化学反应中能量变化的大小与反应物的质量多少有关5. 一种钌(Ru)基配合物光敏染料敏化太阳能电池,其工作原理如图所示。下列说法错误的是( )
A、H2O(g)分解为H2(g)与O2(g)时吸收热量 B、甲、乙、丙中物质所具有的总能量乙最高 C、1 mol H2(g)与0.5 mol O2(g)反应生成1 mol H2O(l)释放能量为245 kJ D、2 mol H2O(g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低4. 下列说法不正确的是( )A、化学反应必然伴随发生能量变化 B、能量变化必然伴随发生化学反应 C、化学反应中的能量变化主要是由化学键变化引起的 D、化学反应中能量变化的大小与反应物的质量多少有关5. 一种钌(Ru)基配合物光敏染料敏化太阳能电池,其工作原理如图所示。下列说法错误的是( ) A、电池工作时,将太阳能转化为电能 B、X电极为电池的负极 C、Y电极发生的电极反应为 +2e-=3I- D、当电池工作从开始到结束时,电解质溶液中I-和 的浓度分别会发生很大变化6. 某种含二价铜微粒[CuII(OH)(NH3)]+的催化剂可用于汽车尾气脱硝,催化机理如图1,反应过程中不同态物质体系所含的能量如图2.下列说法错误的是( )
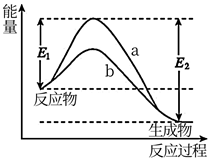
A、电池工作时,将太阳能转化为电能 B、X电极为电池的负极 C、Y电极发生的电极反应为 +2e-=3I- D、当电池工作从开始到结束时,电解质溶液中I-和 的浓度分别会发生很大变化6. 某种含二价铜微粒[CuII(OH)(NH3)]+的催化剂可用于汽车尾气脱硝,催化机理如图1,反应过程中不同态物质体系所含的能量如图2.下列说法错误的是( ) A、总反应焓变∆H<0 B、状态③到状态④的变化过程中有O-H键的形成 C、反应过程中只发生了两次氧化还原反应 D、该脱硝过程的总反应方程式为4NH3+4NO+O2=6H2O+4N27. 叔丁基溴在稀的碱性水溶液中水解生成叔丁醇的反应分三步进行,反应中每一步的能量变化曲线如图所示,下列有关说法错误的是( )
A、总反应焓变∆H<0 B、状态③到状态④的变化过程中有O-H键的形成 C、反应过程中只发生了两次氧化还原反应 D、该脱硝过程的总反应方程式为4NH3+4NO+O2=6H2O+4N27. 叔丁基溴在稀的碱性水溶液中水解生成叔丁醇的反应分三步进行,反应中每一步的能量变化曲线如图所示,下列有关说法错误的是( ) A、叔丁基溴在稀的碱性水溶液中生成叔丁醇的反应是放热反应 B、 和 为反应活性中间体 C、决定叔丁基溴水解生成叔丁醇反应的速率的是第二步反应 D、第三步反应为8. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应: ,在低温下获得高转化率与高反应速率。反应过程示意图如下:
A、叔丁基溴在稀的碱性水溶液中生成叔丁醇的反应是放热反应 B、 和 为反应活性中间体 C、决定叔丁基溴水解生成叔丁醇反应的速率的是第二步反应 D、第三步反应为8. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应: ,在低温下获得高转化率与高反应速率。反应过程示意图如下: 下列说法错误的是( )A、使用催化剂不能降低水煤气变换反应的 B、过程Ⅰ、过程Ⅱ均为吸热过程 C、该催化过程中:有极性键的断裂,极性键和非极性键的形成 D、图示显示:起始时的2个 在反应过程中并未都参与了反应9. 我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示.下列说法错误的是( )
下列说法错误的是( )A、使用催化剂不能降低水煤气变换反应的 B、过程Ⅰ、过程Ⅱ均为吸热过程 C、该催化过程中:有极性键的断裂,极性键和非极性键的形成 D、图示显示:起始时的2个 在反应过程中并未都参与了反应9. 我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示.下列说法错误的是( ) A、a极区 和 的浓度会影响 分解效率 B、能量转化方式主要为“光能→化学能→电能” C、该装置的总反应为 D、为使电池持续放电,应选用质子交换膜10. CrOx催化丙烷脱氢的反应路径如图所示,图中括号内的数值表示相对能量、箭头上的数值表示能垒,单位为eV。下列相关说法错误的是( )
A、a极区 和 的浓度会影响 分解效率 B、能量转化方式主要为“光能→化学能→电能” C、该装置的总反应为 D、为使电池持续放电,应选用质子交换膜10. CrOx催化丙烷脱氢的反应路径如图所示,图中括号内的数值表示相对能量、箭头上的数值表示能垒,单位为eV。下列相关说法错误的是( ) A、催化剂活化丙烷分子中甲基上的C-H键 B、“M2→M3”过程仅形成极性共价键 C、该催化循环中Cr的成键数目发生变化 D、该催化循环中丙烷上氢原子转移是决速步11. 将28g铁粉和16g硫粉混合堆放在石棉网上,用烧红的玻璃棒的一端接触混合物引发反应Fe(s)+S(s) FeS(s),移开玻璃棒后,反应保持红热状态剧烈进行至反应物完全反应。下列说法错误的是( )A、该反应是放热反应 B、若完成该反应需要1min,则该反应用S表示的反应速率v(S)=0.5mol⋅L﹣1⋅min﹣1 C、该反应在理论上可以设计成原电池反应 D、增加Fe的量,不能显著增大该反应的速率12. 下列说法正确的是( )A、放热反应中反应物的总能量小于生成物的总能量 B、将Mg、Al片用导线连接后放入氢氧化钠溶液中组成原电池,Al为负极,Mg为正极 C、由甲烷、空气和稀硫酸构成的燃料电池的正极反应是O2+4e﹣+2H2O═4OH﹣ D、充电电池可以无限制地反复放电、充电13. 氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3)。已知部分化学键的键能和化学反应的能量变化如表和图所示。下列说法中正确的是( )
A、催化剂活化丙烷分子中甲基上的C-H键 B、“M2→M3”过程仅形成极性共价键 C、该催化循环中Cr的成键数目发生变化 D、该催化循环中丙烷上氢原子转移是决速步11. 将28g铁粉和16g硫粉混合堆放在石棉网上,用烧红的玻璃棒的一端接触混合物引发反应Fe(s)+S(s) FeS(s),移开玻璃棒后,反应保持红热状态剧烈进行至反应物完全反应。下列说法错误的是( )A、该反应是放热反应 B、若完成该反应需要1min,则该反应用S表示的反应速率v(S)=0.5mol⋅L﹣1⋅min﹣1 C、该反应在理论上可以设计成原电池反应 D、增加Fe的量,不能显著增大该反应的速率12. 下列说法正确的是( )A、放热反应中反应物的总能量小于生成物的总能量 B、将Mg、Al片用导线连接后放入氢氧化钠溶液中组成原电池,Al为负极,Mg为正极 C、由甲烷、空气和稀硫酸构成的燃料电池的正极反应是O2+4e﹣+2H2O═4OH﹣ D、充电电池可以无限制地反复放电、充电13. 氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3)。已知部分化学键的键能和化学反应的能量变化如表和图所示。下列说法中正确的是( )化学键
N—H
N—Cl
H—Cl
键能(kJ/mol)
391.3
x
431.8
 A、表中的x=191.2 B、反应过程中的△H2=1405.6kJ·mol-1 C、选用合适的催化剂,可降低反应过程中的H值 D、NH3(g)+2Cl2(g)=NHCl2(g)+2HCl(g)△H= -22.6kJ·mol-114. 分子中只存在S-F键。已知:1moLS(s)转化为气态硫原子吸收能量280kJ,断裂1moLS-F键需吸收330kJ能量。 ,则断裂1moLF-F键需要的能量为( )A、 B、 C、 D、15. 如图为某反应分别在有和没有催化剂条件下的能量变化示意图,下列说法错误的是( )
A、表中的x=191.2 B、反应过程中的△H2=1405.6kJ·mol-1 C、选用合适的催化剂,可降低反应过程中的H值 D、NH3(g)+2Cl2(g)=NHCl2(g)+2HCl(g)△H= -22.6kJ·mol-114. 分子中只存在S-F键。已知:1moLS(s)转化为气态硫原子吸收能量280kJ,断裂1moLS-F键需吸收330kJ能量。 ,则断裂1moLF-F键需要的能量为( )A、 B、 C、 D、15. 如图为某反应分别在有和没有催化剂条件下的能量变化示意图,下列说法错误的是( ) A、反应过程 b 有催化剂参与 B、该反应为放热反应,热效应等于 ΔH C、有催化剂条件下,反应的活化能等于 E1+E2 D、反应过程 a 需要外界供给能量才能持续进行16. 中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]能利用太阳光实现高效分解水,其原理如图所示。下列叙述错误的是( )
A、反应过程 b 有催化剂参与 B、该反应为放热反应,热效应等于 ΔH C、有催化剂条件下,反应的活化能等于 E1+E2 D、反应过程 a 需要外界供给能量才能持续进行16. 中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]能利用太阳光实现高效分解水,其原理如图所示。下列叙述错误的是( ) A、该催化反应实现了太阳能向化学能的转化 B、该催化剂降低了过程Ⅰ和过程Ⅱ反应的△H C、过程I中H2O既是氧化剂又是还原剂,过程Ⅱ中H2O是还原产物 D、过程I中生成物H2O2与H2的物质的量之比为1:117. HNO2与羟基自由基(·OH)的气相氧化反应与酸雨、光化学烟雾等重大环境问题密切相关。水分子可作为该气相氧化反应的催化剂,图中表示水分子催化的一种机理:下列叙述错误的是( )
A、该催化反应实现了太阳能向化学能的转化 B、该催化剂降低了过程Ⅰ和过程Ⅱ反应的△H C、过程I中H2O既是氧化剂又是还原剂,过程Ⅱ中H2O是还原产物 D、过程I中生成物H2O2与H2的物质的量之比为1:117. HNO2与羟基自由基(·OH)的气相氧化反应与酸雨、光化学烟雾等重大环境问题密切相关。水分子可作为该气相氧化反应的催化剂,图中表示水分子催化的一种机理:下列叙述错误的是( ) A、该气相氧化反应的化学方程式为HNO2+·OH NO2+H2O B、反应历程中还可能形成HONO···H2O C、该反应历程中最大能垒(活化能)为201.1kJ·mol-1 D、
A、该气相氧化反应的化学方程式为HNO2+·OH NO2+H2O B、反应历程中还可能形成HONO···H2O C、该反应历程中最大能垒(活化能)为201.1kJ·mol-1 D、 是反应过渡态
18. 某温度下,在容积为2 L的密闭容器中进行如下反应:N2(g)+3H2(g) 2NH3(g) △H=-92.60 kJ/mol。图1表示N2的物质的量随时间的变化曲线,图2表示其他条件不变的情况下,改变起始物H2的物质的量对反应平衡的影响.下列说法正确的是( )
是反应过渡态
18. 某温度下,在容积为2 L的密闭容器中进行如下反应:N2(g)+3H2(g) 2NH3(g) △H=-92.60 kJ/mol。图1表示N2的物质的量随时间的变化曲线,图2表示其他条件不变的情况下,改变起始物H2的物质的量对反应平衡的影响.下列说法正确的是( )
 A、加入适当催化剂后,该反应的△H<-92.60 kJ/mol B、11 min时其他条件不变压缩容器体积,N2物质的量变化曲线为c C、 内,该反应的平均反应速率v(H2)=0.045 mol/(L·min) D、在A,B,C三点所表示的平衡中,B点表示的N2的转化率最高19. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
A、加入适当催化剂后,该反应的△H<-92.60 kJ/mol B、11 min时其他条件不变压缩容器体积,N2物质的量变化曲线为c C、 内,该反应的平均反应速率v(H2)=0.045 mol/(L·min) D、在A,B,C三点所表示的平衡中,B点表示的N2的转化率最高19. 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法正确的是( )
A、过程Ⅰ、过程Ⅱ均为放热过程 B、使用催化剂降低了水煤气变换反应的ΔH C、该催化过程中:有极性键的断裂,极性键和非极性键的形成 D、图示显示:起始时的2个H2O在反应过程中并未都参与了反应20. 丙烷的一溴代反应产物有两种: 和 ,部分反应过程的能量变化如图所示( 表示活化能)。下列叙述错误的是( ) A、 丙烷中有 共价键 B、 与 的反应涉及极性键和非极性键的断裂 C、 D、比较 和 推测生成速率:
A、 丙烷中有 共价键 B、 与 的反应涉及极性键和非极性键的断裂 C、 D、比较 和 推测生成速率:二、多选题
-
21. 如图是 1mol CO(g)和 2mol H2(g)发生反应 CO(g)+2H2(g)→CH3OH(g)过程中的能量变化曲线。曲线 a 表示不使用催化剂时反应的能量变化,曲线 b 表示使用催化剂时反应的能量变化。下列相关说法正确的是( )
 A、使用催化剂后该反应从放热反应变成了吸热反应 B、使用和不使用催化剂相比反应的能量变化相同 C、1mol CO(g)和2mol H2(g)中的化学键完全被破坏需要释放 419kJ能量 D、1mol CO(g)和2mol H2(g)完全反应生成1mol CH3OH(g)会释放出91kJ能量22. N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用
A、使用催化剂后该反应从放热反应变成了吸热反应 B、使用和不使用催化剂相比反应的能量变化相同 C、1mol CO(g)和2mol H2(g)中的化学键完全被破坏需要释放 419kJ能量 D、1mol CO(g)和2mol H2(g)完全反应生成1mol CH3OH(g)会释放出91kJ能量22. N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用 、
、  、
、  分别表示N2、H2、NH3 , 其中a、b分别代表该反应无催化剂和有催化剂的能量变化示意图,下列说法正确的是( )
分别表示N2、H2、NH3 , 其中a、b分别代表该反应无催化剂和有催化剂的能量变化示意图,下列说法正确的是( ) 
 A、使用催化剂时,合成氨的反应放出的热量不变 B、在该过程中,b线代表有催化剂时的反应历程 C、在该过程中,N原子和H原子形成了含有非极性键的NH3 D、合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量23. 下列依据热化学方程式得出的结论正确的是( )A、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 , 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 B、已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 , 则氢气的摩尔燃烧焓为241.8 kJ·mol-1 C、已知①2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1 , ②2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1 则a>b D、已知P(白磷,s)=P(红磷,s) ΔH<0,则红磷比白磷稳定24. 在一定温度下,H2(g)+I2(g) 2HI(g)反应达到了化学平衡,其反应过程对应的能量变化如图所示。下列说法正确的是( )
A、使用催化剂时,合成氨的反应放出的热量不变 B、在该过程中,b线代表有催化剂时的反应历程 C、在该过程中,N原子和H原子形成了含有非极性键的NH3 D、合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量23. 下列依据热化学方程式得出的结论正确的是( )A、已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 , 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 B、已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1 , 则氢气的摩尔燃烧焓为241.8 kJ·mol-1 C、已知①2C(s)+2O2(g)=2CO2(g) ΔH=a kJ·mol-1 , ②2C(s)+O2(g)=2CO(g) ΔH=b kJ·mol-1 则a>b D、已知P(白磷,s)=P(红磷,s) ΔH<0,则红磷比白磷稳定24. 在一定温度下,H2(g)+I2(g) 2HI(g)反应达到了化学平衡,其反应过程对应的能量变化如图所示。下列说法正确的是( ) A、该反应为放热反应 B、该反应的△H=Ea'-Ea C、该反应中加入催化剂,可增大反应速率,同时改变焓变 D、温度升高,单位体积的活化分子百分数增加,反应速率加快,且平衡逆向移动25. 下列关于热化学反应的描述中正确的是( )A、HCl和NaOH反应的中和热△H=-57.3 kJ/mol B、甲烷的标准燃烧热△H=- 890.3 kJ/mol,则CH4(g) +2O2(g) =CO2(g)+2H2O(g) △H<-890.3 kJ/mol C、500℃、30 MPa下,N2(g)+3H2(g) 2NH3(g) △H = -92.4kJ/mo1, 将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ D、CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+566.0 kJ/mol26. 俗语说“雷雨发庄稼”与N2和O2反应生成NO有关。反应过程中不使用催化剂(曲线I)和使用催化剂(曲线II)的能量变化如图所示(图中E1表示破坏旧化学键吸收的能量,E2表示形成新化学键释放的能量)。下列叙述错误的是( )
A、该反应为放热反应 B、该反应的△H=Ea'-Ea C、该反应中加入催化剂,可增大反应速率,同时改变焓变 D、温度升高,单位体积的活化分子百分数增加,反应速率加快,且平衡逆向移动25. 下列关于热化学反应的描述中正确的是( )A、HCl和NaOH反应的中和热△H=-57.3 kJ/mol B、甲烷的标准燃烧热△H=- 890.3 kJ/mol,则CH4(g) +2O2(g) =CO2(g)+2H2O(g) △H<-890.3 kJ/mol C、500℃、30 MPa下,N2(g)+3H2(g) 2NH3(g) △H = -92.4kJ/mo1, 将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ D、CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)的△H=+566.0 kJ/mol26. 俗语说“雷雨发庄稼”与N2和O2反应生成NO有关。反应过程中不使用催化剂(曲线I)和使用催化剂(曲线II)的能量变化如图所示(图中E1表示破坏旧化学键吸收的能量,E2表示形成新化学键释放的能量)。下列叙述错误的是( ) A、上述反应属于吸热反应 B、途径I的反应焓变比途径II大 C、过程I的反应速率比过程II慢 D、N2与O2反应的热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=(E1-E2)kJ•mol‑1
A、上述反应属于吸热反应 B、途径I的反应焓变比途径II大 C、过程I的反应速率比过程II慢 D、N2与O2反应的热化学方程式为:N2(g)+O2(g)=2NO(g) ΔH=(E1-E2)kJ•mol‑1三、填空题
-
27. 从能量的角度看,断开化学键要 , 形成化学键要。28. 化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。 下列△H 表示物质燃烧热的是(填字母编号)。
A. 2H2(g)+O2(g)═2H2O(l)△H1
B. C(s)+ O2(g)═CO(g)△H2
C. 2H2(g)+O2(g)═2H2O(l)△H1
D. C(s)+ O2(g)═CO(g)△H2
E. C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H5
F. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H6
G. CH3COO(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H729. 中学化学实验中的中和热的测定所需的玻璃仪器除了大、小烧杯外还有。在大、小烧杯间填满碎泡沫(或纸条)的作用是。结合日常生活实际,该实验改在中进行效果会更好。30. 化合物AX3和单质X2在一定条件下反应可生成化合物AX5。已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5 , 放出热量123.8 kJ。该反应的热化学方程式为。四、实验探究题
-
31. 某实验小组用 溶液和 硫酸进行中和反应反应热的测定。(1)、配制 溶液
①若实验中大约要使用 溶液,至少需要称量 固体g。
②从下表中选择,称量 固体所需要的仪器是(填字母) 。
名称
托盘天平(带砝码)
小烧杯
坩埚钳
玻璃棒
药匙
量筒
仪器






序号
a
b
c
d
e
f
(2)、取 溶液和 硫酸进行实验,实验数据如下表。测定稀硫酸和稀氢氧化钠溶液中和反应反应热的实验装置如图所示:
①仪器A的名称为;实验中还需要用到的玻璃仪器是。
假设稀硫酸和稀氢氧化钠溶液的密度都是 ,又知中和反应后生成溶液的比热容 。为了计算中和热(稀溶液中,酸和碱发生中和反应生成 液态水放出的热量),某学生实验记录数据如下:
②请填写下表中的空白:
温度实验次数
起始温度t1/℃
终止温度t2/℃
温度差平均值
(t2-t1)/℃
平均值
1
26.2
26.0
26.1
30.1
2
27.0
27.4
27.2
33.3
3
25.9
25.9
25.9
29.8
4
26.4
26.2
26.3
30.4
③依据该学生的实验数据计算,该实验测得的中和热 (结果保留一位小数)。
已知强酸强碱的稀溶液反应生成 液态 时反应放出的热量为 ,上述实验产生偏差的原因可能是(填字母)。
A.实验装置保温、隔热效果差
B.量取 溶液的体积时仰视读数
C.分多次把 溶液倒入盛有硫酸的小烧杯中
D.用温度计测定 溶液起始温度后直接测定 溶液的温度
32. 中和热的测定实验中取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题: (1)、从实验装置看,其中尚缺少的一种玻璃用品是 , 除此之外,装置中的一个明显不正确是 , 烧杯间填满碎纸条的作用是。(2)、若改用60mL0.25mol·L--1H2SO4和50mL0.55mol·L--1NaOH溶液进行反应与上述实验相比,所放出的热量__(填“相等”或“不相等”)
(1)、从实验装置看,其中尚缺少的一种玻璃用品是 , 除此之外,装置中的一个明显不正确是 , 烧杯间填满碎纸条的作用是。(2)、若改用60mL0.25mol·L--1H2SO4和50mL0.55mol·L--1NaOH溶液进行反应与上述实验相比,所放出的热量__(填“相等”或“不相等”)温度
实验次数
起始温度t1℃
终止温度t2/℃
H2SO4
NaOH
平均值
1
26.2
26.0
26.1
29.5
2
27.0
27.4
27.2
32.3
3
25.9
25.9
25.9
29.2
4
26.4
26.2
26.3
29.8
(3)、近似认为0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g·℃),通过以上数据计算中和热ΔH=(结果保留小数点后一位)。(4)、上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)。a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
33. 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: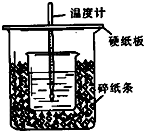 (1)、从实验装置上看,图中尚缺少的一种玻璃用品是;由图可知该装置有不妥之处,应如何改正?;(2)、烧杯间填满碎塑料泡沫的作用是;(3)、如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求得的中和热数值(填“相等、不相等”);(4)、用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”、“无影响”)。
(1)、从实验装置上看,图中尚缺少的一种玻璃用品是;由图可知该装置有不妥之处,应如何改正?;(2)、烧杯间填满碎塑料泡沫的作用是;(3)、如果用60mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液进行反应,与上述实验相比,所求得的中和热数值(填“相等、不相等”);(4)、用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会(填“偏大”、“偏小”、“无影响”)。五、综合题
-
34.(1)、Ⅰ.如图是化学反应中物质变化和能量变化的示意图。
在锌与稀盐酸的反应中, (填“>”或“<”或“=”)
(2)、工业上利用 和 比在催化剂作用下合成甲醇: ,已知反应中有关物质的化学键键能数据如下表所示:化学键
436
343
1076
465
413
则 生成 放出 热量。
(3)、化学兴趣小组进行测定中和热的实验,装置如图,步骤如下。
a.用量筒量取 盐酸倒入如图装置的小烧杯中,测出盐酸温度。
b.用另一量筒量取 溶液,并用另一温度计测出其温度。
c.将 溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
①实验中,倒入 溶液的正确操作是。
A.一次性快速倒入 B.分3次倒入 C.边搅拌边慢慢倒入
②若将各含 溶质的 稀溶液、 稀溶液、稀氨水,分别与足量的稀盐酸反应,放出的热量分别为 、 、 ,则 、 、 的关系为。
(4)、Ⅱ.甲烷燃料电池。已知电池的总反应为 ,①负极的电极反应式为。
②当消耗甲烷11.2L(标准状况下时),则导线中转移的电子的物质的量为 。
35. 碘及碘的化合物在人类活动中占有重要的地位。已知反应H2(g)+I2(g) 2HI(g)ΔH=-14.9kJ·mol-1。(1)、根据下图判断1molH2(g)分子中化学键断裂时需要吸收的能量为kJ。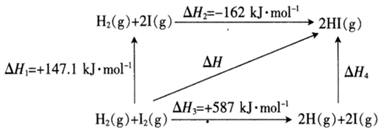 (2)、氢气和碘蒸气能直接反应生成碘化氢,T℃时,向1L的恒容密闭容器中充入0.2mol H2(g)和0.2mol I2(g),5min时反应达到平衡,H2(g)、I2(g)和HI(g)的物质的量浓度(c)随时间(t)变化的曲线如图所示:
(2)、氢气和碘蒸气能直接反应生成碘化氢,T℃时,向1L的恒容密闭容器中充入0.2mol H2(g)和0.2mol I2(g),5min时反应达到平衡,H2(g)、I2(g)和HI(g)的物质的量浓度(c)随时间(t)变化的曲线如图所示: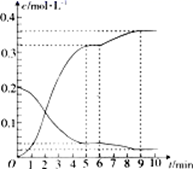
0~5min内,用H2(g)表示的该反应速率v(H2)=。6min时,改变的外界条件为。
(3)、反应H2(g)+I2(g) 2HI(g)的反应机理如下:第一步:I2 2I(快速平衡);
第二步:I+H2 H2I(快速平衡);
第三步:H2I+I→2HI(慢反应)。
则该反应的反应速率由步决定。
(4)、将等物质的量的I2和H2置于预先抽真空的特制1L恒容密闭容器中,加热到1500K,起始总压强为416kPa;体系达到平衡时,总压强为456kPa。若体系中只考虑如下反应关系:①I2(g) 2I(g)Kpl=200ΔH1
②I2(g)+H2(g) 2HI(g)Kp2ΔH2
KP为以分压表示的平衡常数。1500K时,平衡体系中I(g)的分压为kPa,Kp2=(写表达式)。
(5)、某实验兴趣小组将氧化还原反应2Cu2++5I- 2CuI↓++ 设计成如图所示的原电池装置: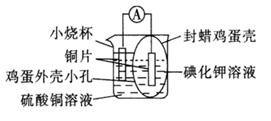
带孔的封蜡鸡蛋壳为半透膜,鸡蛋壳内的电极为(填“正极”或“负极”);该电极反应式为。