山西省临汾市2020-2021学年高一下学期化学期末考试试卷
试卷更新日期:2021-08-04 类型:期末考试
一、单选题
-
1. 疫情期间,聚丙烯口罩、聚碳酸酯护目镜、丁腈橡胶手套、“84”消毒液是常用的防疫物资,其中主要成分属于无机物的是( )A、聚丙烯口罩 B、聚碳酸酯护目镜 C、丁腈橡胶手套 D、“84”消毒液2. 关于化学与生活、化学与生产,下列说法正确的是( )A、将煤气化和液化,可得到清洁的燃料和化工原料,上述两个变化均为物理变化 B、袁隆平院士研制种植的海水稻的大米中含有淀粉、蛋白质、脂肪等,上述物质都是高分子化合物 C、“祝融号”火星车成功在火星表面着陆,其太阳能电池的材料是二氧化硅 D、用浸泡过高锰酸钾溶液的硅藻土吸收水果中的乙烯,可实现水果保鲜3. 下列有关金属的工业制法中错误的是( )A、工业上常采用电解熔融 制取金属镁 B、工业上常用CO在高温条件下还原 制取Fe C、金属活动性介于Al、Cu之间的金属,常采用电解法制取 D、湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应4. 下列化学反应的离子方程式正确的是( )A、将过量 气体通入NaClO溶液中: B、向酸性碘化钾溶液中滴加适量双氧水: C、过量铁粉与稀硝酸反应: D、用氯化铁溶液腐蚀铜板:5. 合理、高效地开发、利用金属矿物,将其中的金属从其化合物中还原出来,用于生成各种金属材料,这一过程在工业上称为金属的冶炼。下列有关金属的冶炼的说法错误的是( )A、电解熔融NaCl制取金属钠的反应中,钠元素被还原,氯元素被氧化 B、古法炼铜“曾青得铁则化为铜”的反应中,利用的是置换反应的原理 C、用铝热法原理炼铁的反应中,1mol 被Al还原成Fe,转移9mol D、对于一些不活泼的金属,可以用直接加热分解其化合物的方法将其还原出来6. 除去下列物质中含有的少量杂质(括号内为杂质),所用方法错误的是( )
选项
气体(杂质)
方法
A
通过饱和的 溶液
B
通过酸性高锰酸钾溶液
C
CuO(C)
在空气中灼烧
D
依次通过水、浓硫酸
A、A B、B C、C D、D7. 汽车尾气中含有NO、CO等多种污染物,已成为城市空气的主要污染源。一定条件下,在密闭容器中发生反应2NO+2CO N2+2CO2。为了加快反应速率,下列措施不合理的是( )A、使用高效催化剂 B、升高温度 C、保持容积不变,再通入一定量的CO D、将容器的容积扩大到原来的2倍8. 已知: ,现将3molX与3molY混合于5L的恒容密闭容器中,10s后,测得X的转化率为50%,测得 ,下列推断正确的是( )A、 B、n=1 C、Y的转化率为75% D、平衡时X的浓度为9. 用下列装置进行实验,不能达到相应实验目的的是( ) A、按图甲检查装置的气密性 B、实验室利用图乙所示装置制取 C、实验室可利用图丙所示装置制取 D、可利用图丁所示装置收集10. 科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的历程(如图所示)。下列说法错误的是( )
A、按图甲检查装置的气密性 B、实验室利用图乙所示装置制取 C、实验室可利用图丙所示装置制取 D、可利用图丁所示装置收集10. 科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的历程(如图所示)。下列说法错误的是( )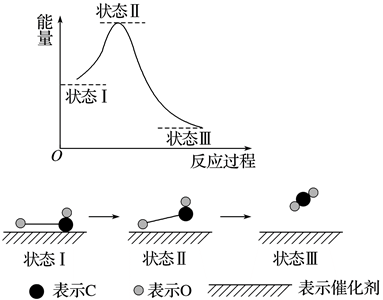 A、CO和O生成CO2的反应是放热过程 B、在该过程中,没有断裂非极性共价键 C、CO2中每个原子的最外层均达到了8电子稳定结构 D、状态Ⅰ→状态Ⅲ表示CO与O2反应的历程11. 已知维生素C的结构简式如图,下列有关维生素C的说法错误的是( )
A、CO和O生成CO2的反应是放热过程 B、在该过程中,没有断裂非极性共价键 C、CO2中每个原子的最外层均达到了8电子稳定结构 D、状态Ⅰ→状态Ⅲ表示CO与O2反应的历程11. 已知维生素C的结构简式如图,下列有关维生素C的说法错误的是( ) A、和乙醇互为同系物 B、含有两种含氧官能团 C、分子式为 D、既能与金属钠反应又能与溴水反应12. 下列实验操作、实验现象及结论均正确的是( )
A、和乙醇互为同系物 B、含有两种含氧官能团 C、分子式为 D、既能与金属钠反应又能与溴水反应12. 下列实验操作、实验现象及结论均正确的是( )选项
实验操作
实验现象
结论
A
先向某溶液中加入 溶液,再加足量盐酸
开始时产生白色沉淀,后沉淀不溶解
原溶液中含有
B
向淀粉溶液中加适量20% 溶液,加热,冷却后加NaOH溶液至溶液呈中性,再滴加少量碘水
溶液变蓝
淀粉未水解
C
将铁片插入稀硫酸中,一段时间后再往溶液中滴加少量 溶液
开始时有少量气泡产生,加入 溶液后,有大量气泡产生
形成Fe-Cu原电池,加快反应速率
D
将铜粉加入 溶液中
溶液逐渐变蓝
还原性:Cu>Fe
A、A B、B C、C D、D13. 一种以氨气的催化氧化反应为原理设计的原电池装置,其工作原理如图。下列说法错误的是( ) A、Pt(Ⅱ)电极为正极 B、理论上消耗的NH3与O2的物质的量之比为4∶3 C、原电池工作时,电子由Pt(Ⅰ)电极经外电路流向Pt(Ⅱ)电极 D、Pt(Ⅰ)电极的电极反应式为2NH3+6e-+6OH-=N2+6H2O14. 常温常压下,等物质的量的某有机物分别与足量的Na和 溶液反应,得到的气体的体积相等,则该有机物可能是( )A、HOOC—COOH B、 C、 D、15. 某无色混合气体中可能含有 、 、 、NO、 中的两种或多种气体。现将此混合气体通过澄清石灰水,石灰水变浑浊,再将剩余气体通入装有空气的集气瓶中,集气瓶中气体很快变为红棕色。下列对于原混合气体成分的判断中正确的是( )A、肯定有 、 和NO B、肯定没有 、 和 C、可能有 和 D、肯定有NO,可能有16. 工业上冶炼金属镁的方法有两种:电解法和皮江法。皮江法是硅在高温下还原氧化镁。皮江法冶炼金属镁的工艺流程如图所示,下列说法中错误的是( )
A、Pt(Ⅱ)电极为正极 B、理论上消耗的NH3与O2的物质的量之比为4∶3 C、原电池工作时,电子由Pt(Ⅰ)电极经外电路流向Pt(Ⅱ)电极 D、Pt(Ⅰ)电极的电极反应式为2NH3+6e-+6OH-=N2+6H2O14. 常温常压下,等物质的量的某有机物分别与足量的Na和 溶液反应,得到的气体的体积相等,则该有机物可能是( )A、HOOC—COOH B、 C、 D、15. 某无色混合气体中可能含有 、 、 、NO、 中的两种或多种气体。现将此混合气体通过澄清石灰水,石灰水变浑浊,再将剩余气体通入装有空气的集气瓶中,集气瓶中气体很快变为红棕色。下列对于原混合气体成分的判断中正确的是( )A、肯定有 、 和NO B、肯定没有 、 和 C、可能有 和 D、肯定有NO,可能有16. 工业上冶炼金属镁的方法有两种:电解法和皮江法。皮江法是硅在高温下还原氧化镁。皮江法冶炼金属镁的工艺流程如图所示,下列说法中错误的是( ) A、气体a是CO2 B、“还原炉”中发生的主要反应有2MgO+Si 2Mg↑+SiO2和SiO2+CaO CaSiO3 C、“还原炉”中抽空气到接近真空的原因是防止还原得到的Mg在高温条件下再次被氧化 D、“回转炉煅烧”的产物为CaO和MgO,其中电解法就是电解熔融的氧化镁来制备金属镁
A、气体a是CO2 B、“还原炉”中发生的主要反应有2MgO+Si 2Mg↑+SiO2和SiO2+CaO CaSiO3 C、“还原炉”中抽空气到接近真空的原因是防止还原得到的Mg在高温条件下再次被氧化 D、“回转炉煅烧”的产物为CaO和MgO,其中电解法就是电解熔融的氧化镁来制备金属镁二、综合题
-
17. A、B、C、D、E均为短周期主族元素,且原子序数依次增大,A原子的电子层数等于其核外电子数,B与C可形成离子化合物CB2 , D原子的M层电子数是K层电子数的3倍。(1)、A的元素符号是。(2)、B的氢化物与E的氢化物相比,较稳定的是(填化学式)。(3)、B、C组成的化合物的电子式是。(4)、B、D、E的原子半径由大到小的顺序为(用元素符号回答)。(5)、C的最高价氧化物对应的水化物是(填化学式),它与D的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式是。18. 甲、乙、丙、丁均为中学常见的纯净物,其中甲、乙、丙均含同一种元素,它们之间存在转化关系: (其他产物及反应条件已略去)。回答下列问题:(1)、若甲为具有臭鸡蛋气味的有毒气体,乙为淡黄色固体单质;甲和丙反应可生成乙和另一种无色无味的液体,则甲的化学式为 , 写出甲和丙反应的化学方程式:。(2)、若甲、乙、丙均为化合物,其中甲为有刺激性气味的气体,水溶液呈碱性;丙为红棕色气体。
①实验室检验气体甲的方法为(简述操作、现象及结论)。
②在催化剂的作用下,气体甲可还原乙和丙生成两种无污染的物质。同温、同压下将体积分别为 、 、 的甲、乙、丙三种气体混合,在催化剂的作用下充分反应恰好生成两种无污染的物质,则 、 、 应满足的关系是(用 、 、 表示)。
(3)、若甲为短周期元素组成的一元强碱,丁为无色无味的气体。①某实验小组设计用澄清石灰水来鉴别乙和丙,该实验(填“能”或“不能”)成功,其原因为。
②写出甲和丙反应的离子方程式:。
19. 在一定温度下,向5L恒容密闭容器中通入N2、H2、NH3 , 上述三种物质的物质的量随时间的变化关系曲线如图所示。 (1)、反应开始至2min时,H2的平均反应速率为mol·L-1·min-1。(2)、5min时反应达到平衡,则N2的转化率是。(3)、在不改变外界条件的情况下,5min时NH3的生成速率与6min时NH3的生成速率相比较,前者(填“大于”“小于”或“等于”)后者。(4)、该反应在三种不同情况下的反应速率如下:
(1)、反应开始至2min时,H2的平均反应速率为mol·L-1·min-1。(2)、5min时反应达到平衡,则N2的转化率是。(3)、在不改变外界条件的情况下,5min时NH3的生成速率与6min时NH3的生成速率相比较,前者(填“大于”“小于”或“等于”)后者。(4)、该反应在三种不同情况下的反应速率如下:①v(N2)=3mol·L-1·min-1
②v(H2)=6mol·L-1·min-1
③v(NH3)=4.5mol·L-1·min-1
其中表示该反应的反应速率最快的是(填标号)。
(5)、用NH3和O2组合形成的碱性燃料电池的结构如图所示。
①电极A是(填“正极”或“负极”),电极B的电极反应式为。
②若外电路中转移2mol电子,则该燃料电池理论上消耗的O2的体积(在标准状况下)为L。
20. 硫铁矿的主要成分为 ,工业上常用硫铁矿在空气中煅烧产气来制备硫酸,该过程中的烧渣可用于制备铁红、绿矾等。现以硫铁矿烧渣(主要成分为 、FeO,还含有少量的 、 杂质)为原料、氨水为沉淀剂制备铁红颜料的流程如图所示: 根据所学知识,回答下列问题:(1)、写出 高温煅烧生成 的化学方程式: , 其中氧化产物为(填化学式)。(2)、“浸取液Ⅰ”中加入 的目的是 , 发生反应的离子方程式为。(3)、“操作Ⅰ”的名称为。(4)、在加入氨水沉淀时,调节pH可使得 沉淀而 不沉淀。“滤液Ⅱ”中溶质的主要成分为(填化学式)。写出获得“滤渣Ⅱ”的离子方程式:。21. 气态烃A的相对分子质量为42,B为高分子化合物,C分子中只含有一个甲基。有关物质的转化关系如图:
根据所学知识,回答下列问题:(1)、写出 高温煅烧生成 的化学方程式: , 其中氧化产物为(填化学式)。(2)、“浸取液Ⅰ”中加入 的目的是 , 发生反应的离子方程式为。(3)、“操作Ⅰ”的名称为。(4)、在加入氨水沉淀时,调节pH可使得 沉淀而 不沉淀。“滤液Ⅱ”中溶质的主要成分为(填化学式)。写出获得“滤渣Ⅱ”的离子方程式:。21. 气态烃A的相对分子质量为42,B为高分子化合物,C分子中只含有一个甲基。有关物质的转化关系如图: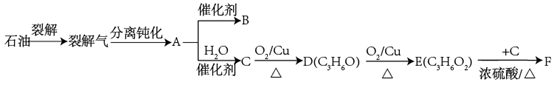
请回答下列问题:
(1)、A的结构简式为。(2)、D、E中的官能团的名称分别为、。(3)、写出A→B反应的化学方程式: , 反应类型是。(4)、A在催化剂的作用下与水生成C的反应常有副产物生成,写出此种副产物的结构简式:。(5)、写出反应E+C→F的化学方程式:。生成的有机物F的同分异构体有多种,其中能与碳酸氢钠反应生成 的同分异构体有种。