黑龙江省牡丹江市三校联谊2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-08-04 类型:期中考试
一、单选题
-
1. 下列说法错误的是( )A、硫是一种淡黄色的易溶于CS2的固体 B、硫在自然界中既有游离态又有化合态 C、化石燃料直接燃烧会产生对大气有严重污染的SO2气体 D、S与Fe反应生成FeS,与Cu反应生成CuS2. 下列叙述中正确的是( )
①氨水和液氨不同,氨水是由多种粒子组成的,液氨的组成中只有氨分子
②水泥、玻璃、水晶饰物都是硅酸盐制品
③向铜与浓硫酸反应后的溶液中加水稀释,溶液变蓝,则证明产物有Cu2+生成
④SiO2是酸性氧化物,它不能与任何酸发生反应
⑤铵盐受热分解一定都会产生氨气
⑥可用湿润的淀粉-KI试纸鉴别红棕色的Br2蒸气和NO2气体
A、1个 B、2个 C、3个 D、4个3. 向 溶液中通入 气体,溶液仍然澄清;若将 溶液分别盛在甲乙两支试管中,甲试管加氯水,乙试管加氨水,然后再分别通入 气体,结果两支试管都有白色沉淀产生。下列由此得出的结论中正确的是( )A、两支试管中的白色沉淀均为 B、甲实验体现了 酸性氧化物的性质 C、乙实验体现了 的还原性 D、若将 换成 只有乙中有沉淀4. 如图是利用氯化氢和氢气生产高纯硅的工艺流程。容器 中发生的反应为 ,容器 中发生的反应为 ,已知 常温下为液态。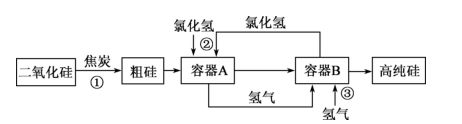
下列说法错误的是( )
A、反应①为 B、从容器B中获得高纯硅的操作为过滤 C、反应②和③中 均作氧化剂 D、该工艺中 和 可循环使用5. 铜与足量浓硝酸反应,得到硝酸铜溶液和由NO2、N2O4、NO组成的混合气体,这些气体与896mL(标准状况)O2混合后通入水中,恰好完全被水吸收生成硝酸。则生成硝酸铜的物质的量为( )A、0.16mol B、0.12mol C、0.08mol D、0.04mol6. 一氧化氮是一种大气污染物,是吸烟、汽车尾气及垃圾燃烧等释放出的有害气体,但是这种最常见、最简单的气体小分子在生物体内却是一种重要的信使分子,具有保护心血管,降低血压等作用。下列关于NO的说法中错误的是( )A、NO是无色气体 B、NO是汽车尾气的有害成分之一 C、可以用向上排空气法收集NO D、NO在一定条件下也可作氧化剂7. 下列反应中,生成物总能量高于反应物总能量的是( )A、Ba(OH)2·8H2O与NH4Cl反应 B、镁与盐酸反应 C、NaOH溶液与稀盐酸的反应 D、钠与水反应8. 金刚石与石墨是碳元素的两种结构不同的单质,彼此互称同素异形体。在100 kPa时,1 mol石墨转化为金刚石要吸收1.895 kJ的热能。据此判断在100 kPa压强下,下列说法正确的是( )A、金刚石比石墨更稳定 B、石墨比金刚石更稳定 C、1 mol金刚石比1 mol石墨的总能量低 D、1 mol金刚石转变为石墨需要吸收1.895 kJ能量9. 反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。
已知:断开1molN2(g)中化学键需吸收946kJ能量,断开1molO2(g)中化学键需吸收498kJ能量。下列说法正确的是( )
A、N2和O2的总能量一定高于NO的总能量 B、2NO(g)=N2(g)+O2(g),该反应为吸热反应 C、断开1molNO(g)中化学键需吸收90kJ能量 D、形成1molNO(g)中化学键可释放632kJ能量10. 有A、B、C、D四种金属。将A与B用导线连接起来,浸入稀硫酸中,B为正极。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活泼性由强到弱的顺序是( )A、D>A>B>C B、B>A>D>C C、D>B>A>C D、D>A>C>B11. 普通水泥在固化过程中其自由水分子减少并形成碱性溶液.根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间.此法的原理如图所示,反应的总方程式为2Cu+Ag2O═Cu2O+2Ag,下列有关说法正确的是( ) A、2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量 B、负极的电极反应式为2Cu+2OH--2e-═Cu2O+H2O C、测量原理示意图中,电流方向从Cu→Ag2O D、电池工作时,OH-向正极移动12. 在 反应中,表示该反应速率最快的是( )A、 B、 C、 D、13. 下列有关化学反应速率和限度的说法中,错误的是( )A、“新冠疫苗”一般应冷藏存放,可降低蛋白质变性的反应速率 B、2SO2+O2 2SO3反应中加入18O2 , 达到平衡后SO2中不可能有18O C、实验室用H2O2分解制O2 , 加入MnO2作催化剂后,反应速率明显加快 D、化学反应的限度决定了反应物在该条件下的最大转化率14. 反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A、2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量 B、负极的电极反应式为2Cu+2OH--2e-═Cu2O+H2O C、测量原理示意图中,电流方向从Cu→Ag2O D、电池工作时,OH-向正极移动12. 在 反应中,表示该反应速率最快的是( )A、 B、 C、 D、13. 下列有关化学反应速率和限度的说法中,错误的是( )A、“新冠疫苗”一般应冷藏存放,可降低蛋白质变性的反应速率 B、2SO2+O2 2SO3反应中加入18O2 , 达到平衡后SO2中不可能有18O C、实验室用H2O2分解制O2 , 加入MnO2作催化剂后,反应速率明显加快 D、化学反应的限度决定了反应物在该条件下的最大转化率14. 反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2 使体系压强增大
④保持压强不变,充入N2使容器体积变大
A、①④ B、②③ C、①③ D、②④15. 将等物质的量的 、 混合于 的密闭容器中,发生下列反应: ,经 后测得 的浓度为 , ,以C表示的平均速率 ,下列说法错误的是( )A、反应速率 B、该反应方程式中, C、 时, 的转化率为50% D、 时, 的物质的量为16. 一定条件下,将 气体和 固体混合于固定容积为 的密闭容器中,发生反应: 。 末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( ) A、当混合气体的密度不再改变时,该反应不一定达到平衡状态 B、 后,加压会使正反应速率加快,逆反应速率变慢。 C、从 开始, D、反应过程中A和B的转化率之比为1∶117. 一定温度、体积的密闭容器中,可逆反应A(s)+3B(g) 2C(g)达到平衡时,下列说法能判断该反应达到平衡的是( )
A、当混合气体的密度不再改变时,该反应不一定达到平衡状态 B、 后,加压会使正反应速率加快,逆反应速率变慢。 C、从 开始, D、反应过程中A和B的转化率之比为1∶117. 一定温度、体积的密闭容器中,可逆反应A(s)+3B(g) 2C(g)达到平衡时,下列说法能判断该反应达到平衡的是( )①C的生成速率和C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③混合气体的密度不再变化
④混合气体的总压强不再变化
⑤A、B、C物质的量之比为1∶3∶2
⑥混合气体的平均相对分子质量不变
⑦容器中C的体积分数不变
A、②④⑤⑦ B、①③④⑥⑦ C、①④⑥⑦ D、①③④⑤18. 下列关于甲烷的说法正确的是( )A、甲烷能使酸性KMnO4溶液褪色 B、甲烷和氯水在光照条件下发生取代反应 C、甲烷能够燃烧,在一定条件下会发生爆炸,因此是矿井的安全威胁之一 D、将甲烷和氯气按体积比1:1混合,光照条件下可以得到纯净的CH3Cl19. 下列物质的沸点由高到低排列的顺序是( )①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH④(CH3)2CHCH2CH3
A、②④①③ B、④②①③ C、④②③① D、②④③①20. 下列关于烷烃的叙述中,错误的是( )A、甲烷是最简单的烷烃,是沼气、天然气的主要成分 B、在烷烃分子中,所有的化学键都是单键 C、分子通式为 的烃不一定是烷烃 D、丙烷分子中碳原子不在一条直线上21. 1 mol某烷烃在氧气中充分燃烧,需要消耗氧气246.4 L(标准状况),它在光照的条件下与氯气反应,生成4种不同的一氯取代物。该烷烃的结构简式是( )A、 B、CH3CH2CH2CH2CH3
C、
B、CH3CH2CH2CH2CH3
C、 D、
D、 22. 下列关于乙烯的描述错误的是( )A、所有原子都在同一直线上 B、乙烯能使溴水褪色 C、乙烯可作为制备乙醇的原料 D、乙烯属于不饱和烃23. 下列叙述错误的是( )A、1 mol乙烯先与HCl发生加成反应,再与Cl2发生取代反应,最多消耗Cl2 2.5 mol B、乙烯可以催熟植物的果实 C、丙烯与溴加成反应的产物为BrCH2CHBrCH3 D、工业上可利用乙烯与HCl的加成反应制得较纯净的CH3CH2Cl24. 下列对烃的分类错误的是( )A、CH3CH3、CH4、C18H38均属于饱和烃 B、CH3CH2CH3、CH3CH=CH2、CH3CH=CHCH2CH=CH2均属于链状烃 C、
22. 下列关于乙烯的描述错误的是( )A、所有原子都在同一直线上 B、乙烯能使溴水褪色 C、乙烯可作为制备乙醇的原料 D、乙烯属于不饱和烃23. 下列叙述错误的是( )A、1 mol乙烯先与HCl发生加成反应,再与Cl2发生取代反应,最多消耗Cl2 2.5 mol B、乙烯可以催熟植物的果实 C、丙烯与溴加成反应的产物为BrCH2CHBrCH3 D、工业上可利用乙烯与HCl的加成反应制得较纯净的CH3CH2Cl24. 下列对烃的分类错误的是( )A、CH3CH3、CH4、C18H38均属于饱和烃 B、CH3CH2CH3、CH3CH=CH2、CH3CH=CHCH2CH=CH2均属于链状烃 C、 、CH2=CH2、CH2=CHCH=CH2均属于不饱和烃
D、
、CH2=CH2、CH2=CHCH=CH2均属于不饱和烃
D、 、
、  、
、  均属于芳香烃
25. 某混合气体由两种气态烃组成。 该混合气体完全燃烧后,得到 二氧化碳(气体体积均已换算成标准状况下的体积)和 水。则这两种气体可能是( )A、 和 B、 和 C、 和 D、 和
均属于芳香烃
25. 某混合气体由两种气态烃组成。 该混合气体完全燃烧后,得到 二氧化碳(气体体积均已换算成标准状况下的体积)和 水。则这两种气体可能是( )A、 和 B、 和 C、 和 D、 和二、综合题
-
26. 下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
 (1)、A物质的化学式为 , A与足量NaOH溶液加热条件下反应的离子方程式为。(2)、当X为强碱时,写出过量B与Cl2反应的化学方程式 , 该反应中氧化产物与还原产物的物质的量之比为。(3)、当X为强碱时,写出铜与F的稀溶液反应的离子方程式。(4)、当X为强酸时,B与D发生反应的化学方程式为。27. 化学反应速率和限度与生产、生活密切相关。(1)、用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)、A物质的化学式为 , A与足量NaOH溶液加热条件下反应的离子方程式为。(2)、当X为强碱时,写出过量B与Cl2反应的化学方程式 , 该反应中氧化产物与还原产物的物质的量之比为。(3)、当X为强碱时,写出铜与F的稀溶液反应的离子方程式。(4)、当X为强酸时,B与D发生反应的化学方程式为。27. 化学反应速率和限度与生产、生活密切相关。(1)、用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:①实验过程如图所示,分析判断段化学反应速率最快。

②将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其原因是。
(2)、某温度时,在2L恒容容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
①由图中的数据分析,该反应的化学方程式为:。
②反应开始至2min时,Z的平均反应速率为。
③5min后Z的生成速率(填“大于”“小于”或“等于”)10min后Z的生成速率。
④5min时X的转化率为。
⑤5min时容器内的压强与反应前容器内的压强之比是。
28. 已知:2H2+O2 2H2O。(1)、I.该反应1 g氢气完全燃烧生成液态水放出热量121.6 kJ,则2 mol氢气完全燃烧生成液态水放出的热量为kJ。(2)、II.原电池是直接把化学能转化为电能的装置。航天技术上使用的氢-氧燃料电池具有高能、轻便和不污染环境等优点。下图是氢-氧燃料电池的装置图。则:
溶液中OH-移向电极(填“a”或“b”)。
(3)、b电极附近pH (填“增大”“减小”或“不变”)。(4)、该原电池的b极发生 (填“氧化”或“还原”)反应,该电极的反应式为。(5)、若把上述电解质溶液改为稀硫酸溶液,则正极的电极反应式为。(6)、将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:产生氢气的体积L(标准状况)。29. 如图表示页岩气中某些烃类的结构模型: (1)、有机物甲的名称为 , 与有机物乙的关系为。(2)、有机物乙的一氯代物有种,请你根据甲烷分子的结构推测,有机物乙分子中最多有个C原子在同一平面内。(3)、写出有机物乙在光照下与氯气反应,甲基上的一个H原子被取代的反应方程式:。(4)、若有机物甲中的氢原子全部被氯原子取代,则1mol甲消耗molCl2。(5)、等质量的有机物甲和有机物乙完全燃烧,消耗O2的质量比为。30. 利用甲烷与氯气发生取代反应的副产品制取盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
(1)、有机物甲的名称为 , 与有机物乙的关系为。(2)、有机物乙的一氯代物有种,请你根据甲烷分子的结构推测,有机物乙分子中最多有个C原子在同一平面内。(3)、写出有机物乙在光照下与氯气反应,甲基上的一个H原子被取代的反应方程式:。(4)、若有机物甲中的氢原子全部被氯原子取代,则1mol甲消耗molCl2。(5)、等质量的有机物甲和有机物乙完全燃烧,消耗O2的质量比为。30. 利用甲烷与氯气发生取代反应的副产品制取盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
完成下列填空:
(1)、A中反应的离子方程式是;有人认为E中有氯化氢产生,不能证明甲烷与氯气发生了取代反应,你认为他的看法(填“正确”或“不正确”),理由是。(2)、B有三种功能:①控制气流速度;②混匀混合气体;③。(3)、设 =x,若想理论上获得最多的氯化氢,则x≥。(4)、一段时间后发现D中的石棉由白色变为蓝色,则棉花上可能预先滴有溶液。(5)、E中除盐酸外,还可能含有机物,从E中分离出盐酸的最佳方法为(选填编号)。a.水洗分液法b.蒸馏法c.萃取分液法d.结晶法
(6)、该装置的缺陷是,有些尾气没能处理掉,该尾气的主要成分为(选填编号)。a.CH4b.CH3Clc.CH2Cl2d.CHCl3