河南省许昌市2020-2021学年高二下学期化学期末考试试卷
试卷更新日期:2021-08-04 类型:期末考试
一、单选题
-
1. 下列合成纤维中吸湿性较好的是( )




A.涤纶
B.氯纶
C.丙纶
D.维纶
A、A B、B C、C D、D2. 下列物质中,含有共价键的离子晶体是( )A、 B、НСl C、NaBr D、KOH3. 氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时所克服粒子间作用力与氮化硼熔化时克服粒子间作用力的类型都相同的是( )A、硝酸钠和金刚石 B、晶体硅和水晶 C、冰和干冰 D、苯和萘4. X,Y,Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4 , 由这三种元素组成的化合物的化学式可能是( )A、XYZ2 B、X2YZ3 C、X2YZ2 D、XYZ35. 化学反应A+B C(放出能量)分两步进行:①A+B X(吸收能量),②X C(放出能量)。下列示意图中表示总反应过程中能量变化的是( )A、 B、
B、 C、
C、 D、
D、 6. 用下列实验装置进行的实验,不能达到相应实验目的的是( )
6. 用下列实验装置进行的实验,不能达到相应实验目的的是( ) A、装置甲铜的精炼 B、装置乙检验乙烷中混有乙烯 C、装置丙验证HCl气体在水中的溶解性 D、装置丁实验室制取并收集乙酸乙酯7. 分子式为C9H12的所有带苯环结构的异构体中,在催化剂条件下与液溴发生取代反应,其一溴代物为三种的结构有( )A、1种 B、2种 C、3种 D、4种8. 对于可逆反应M + N Q 达到平衡时,下列说法正确的是( )A、M、N、Q 三种物质的量浓度一定相等 B、M、N 全部变成了 Q C、反应混合物各成分的百分含量不再变化 D、反应已经停止9. 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,其分子结构如图所示,已知断裂1mol N—N吸收167kJ热量,生成1molN≡N放出942kJ热量,则下列说法正确的是( )
A、装置甲铜的精炼 B、装置乙检验乙烷中混有乙烯 C、装置丙验证HCl气体在水中的溶解性 D、装置丁实验室制取并收集乙酸乙酯7. 分子式为C9H12的所有带苯环结构的异构体中,在催化剂条件下与液溴发生取代反应,其一溴代物为三种的结构有( )A、1种 B、2种 C、3种 D、4种8. 对于可逆反应M + N Q 达到平衡时,下列说法正确的是( )A、M、N、Q 三种物质的量浓度一定相等 B、M、N 全部变成了 Q C、反应混合物各成分的百分含量不再变化 D、反应已经停止9. 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子,其分子结构如图所示,已知断裂1mol N—N吸收167kJ热量,生成1molN≡N放出942kJ热量,则下列说法正确的是( ) A、N4属于一种新型化合物 B、N4与N2互为同位素 C、N4沸点比P4(白磷)高 D、1mol N4气体转变为N2将放出882kJ热量10. 下图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂。下列有关说法中正确的是( )
A、N4属于一种新型化合物 B、N4与N2互为同位素 C、N4沸点比P4(白磷)高 D、1mol N4气体转变为N2将放出882kJ热量10. 下图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂。下列有关说法中正确的是( ) A、金刚烷的分子中有18个碳原子 B、1-溴金刚烷的结构有两种 C、金刚烷属于烷烃的同系物 D、金刚烷应该具有和芳香烃相似的化学性质11. 下列性质中,能充分说明某晶体是离子晶体的是( )A、具有较高的熔点 B、固态不导电,水溶液能导电 C、可溶于水 D、固态不导电,熔融状态能导电12. 药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得,下列有关叙述正确的是( )
A、金刚烷的分子中有18个碳原子 B、1-溴金刚烷的结构有两种 C、金刚烷属于烷烃的同系物 D、金刚烷应该具有和芳香烃相似的化学性质11. 下列性质中,能充分说明某晶体是离子晶体的是( )A、具有较高的熔点 B、固态不导电,水溶液能导电 C、可溶于水 D、固态不导电,熔融状态能导电12. 药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得,下列有关叙述正确的是( ) (乙酰水杨酸)+
(乙酰水杨酸)+  (对乙酰氨基酚)→
(对乙酰氨基酚)→  (贝诺酯)+H2OA、贝诺酯分子中有三种含氧官能团 B、乙酰水杨酸和对乙酰氨基酚均能与 溶液反应 C、可用浓溴水区别乙酰水杨酸和对乙酰氨基酚 D、贝诺酯与足量NaOH溶液共热,最终可生成乙酰水杨酸钠13. 某烷烃相对分子质量为86,如果分子中含有3个 、2个 和1个
(贝诺酯)+H2OA、贝诺酯分子中有三种含氧官能团 B、乙酰水杨酸和对乙酰氨基酚均能与 溶液反应 C、可用浓溴水区别乙酰水杨酸和对乙酰氨基酚 D、贝诺酯与足量NaOH溶液共热,最终可生成乙酰水杨酸钠13. 某烷烃相对分子质量为86,如果分子中含有3个 、2个 和1个 ,符合条件的烃的结构式有(不考虑立体异构)( ) A、1种 B、2种 C、3种 D、4种14. A、B、C、D均属于短周期元素。A是元素周期表所有元素中原子半径最小的;B和C都只有两个电子层,B中一层电子数是另一层的两倍;C中两层电子数之和是两层电子数之差的两倍;D中一层电子数是另两层电子数之和。下列说法中正确的是( )A、C的简单离子的还原性大于D B、D元素只能以化合态存在于自然界中 C、A元素所形成离子的半径有可能大于He原子的半径 D、B、D的原子不能相互结合形成化合物15. 反应 在温度一定时,平衡体系中NO2的体积分数 随压强的变化情况如图所示。下列说法正确的是( )
,符合条件的烃的结构式有(不考虑立体异构)( ) A、1种 B、2种 C、3种 D、4种14. A、B、C、D均属于短周期元素。A是元素周期表所有元素中原子半径最小的;B和C都只有两个电子层,B中一层电子数是另一层的两倍;C中两层电子数之和是两层电子数之差的两倍;D中一层电子数是另两层电子数之和。下列说法中正确的是( )A、C的简单离子的还原性大于D B、D元素只能以化合态存在于自然界中 C、A元素所形成离子的半径有可能大于He原子的半径 D、B、D的原子不能相互结合形成化合物15. 反应 在温度一定时,平衡体系中NO2的体积分数 随压强的变化情况如图所示。下列说法正确的是( ) A、A,C两点的正反应速率的关系A>C B、A,B,C,D,E各状态,v(正)<v(逆)的是状态E C、E→A所需时间为x,D→C所需时间为y,则x<y D、根据C点对应的坐标值可以计算出该反应的平衡常数
A、A,C两点的正反应速率的关系A>C B、A,B,C,D,E各状态,v(正)<v(逆)的是状态E C、E→A所需时间为x,D→C所需时间为y,则x<y D、根据C点对应的坐标值可以计算出该反应的平衡常数二、综合题
-
16. 聚丙烯是制备医用N95口罩的材料之一,可由石油裂解气中的两烯为原料合成得到。回答下列问题。(1)、聚丙烯的结构简式为。(2)、下图是以丙烯为原料合成乙二酸二乙酯的合成路线。

①A的结构简式为;反应①的反应类型为。欲检验B中的羟基,可选择的试剂是(填标号)
a.金属钠 b.酸性高锰酸钾溶液 c.溴的 溶液 d.NaOH溶液
②C中含氧官能团名称为;反应④的化学方程式为。
17. 东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:(1)、镍元素基态原子的电子排布式为 , 3d能级上的未成对电子数为。(2)、硫酸镍溶于氨水形成 蓝色溶液。① 中 的空间立体构型是。
②在 中 与 之间形成的化学键称为。
③氨的沸点(填“高于”或“低于”)膦( ),原因是。氨分子中,中心原子的轨道杂化类型为。
18. 25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定。滴定过程中pH随滴加溶液的体积变化关系如图所示。回答下列问题: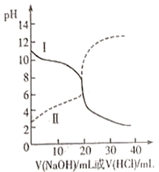 (1)、表示氨水滴定过程中pH变化情况的是曲线(填“Ⅰ”或“Ⅱ”)。由图中信息可知,25℃时0.1mol/L醋酸溶液的电离程度(填“大于”“小于”或“等于”,下同)10%。当横坐标为20mL时,曲线Ⅰ对应的纵坐标应7。(2)、滴加溶液到10mL时,曲线Ⅱ所表示的溶液中c(H+)-c(OH-)(结果中不能包含阳离子浓度)。19.(1)、Ⅰ.实验室用0.100mol/LNaOH标准溶液滴定未知浓度的盐酸。
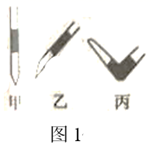
(1)、表示氨水滴定过程中pH变化情况的是曲线(填“Ⅰ”或“Ⅱ”)。由图中信息可知,25℃时0.1mol/L醋酸溶液的电离程度(填“大于”“小于”或“等于”,下同)10%。当横坐标为20mL时,曲线Ⅰ对应的纵坐标应7。(2)、滴加溶液到10mL时,曲线Ⅱ所表示的溶液中c(H+)-c(OH-)(结果中不能包含阳离子浓度)。19.(1)、Ⅰ.实验室用0.100mol/LNaOH标准溶液滴定未知浓度的盐酸。盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图1中的操作(填“甲”、“乙”、“丙”)。选择酚酞作为指示剂,滴定终点的现象为。
 (2)、下列操作会导致实验结果偏低的是___________(填标号)。A、碱式滴定管未用标准NaOH溶液润洗 B、盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 C、滴定终点读数时,仰视滴定管的刻度 D、滴定过程中振荡锥形瓶,液体不慎溅出(3)、某学生进行3次实验得到相关数据如表所示。
(2)、下列操作会导致实验结果偏低的是___________(填标号)。A、碱式滴定管未用标准NaOH溶液润洗 B、盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 C、滴定终点读数时,仰视滴定管的刻度 D、滴定过程中振荡锥形瓶,液体不慎溅出(3)、某学生进行3次实验得到相关数据如表所示。滴定次数
待测盐酸的体积/mL
消耗0.100mol/LNaOH溶液的体积/mL
滴定前读数
滴定后读数
第一次
25.00
0.00
26.11
第二次
25.00
1.56
30.30
第三次
25.00
0.22
26.31
则盐酸的物质的量浓度为mol/L。(保留三位小数)
(4)、Ⅱ.一定浓度的 溶液中含硫元素所有微粒的物质的量分数随pH的变化如图2所示。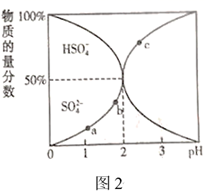
图中a、b、c三点,水电离的 由大到小的顺序分为(用a、b、c表示),pH=3时, 。
20. 硝基苯是一种重要的化工原料,实验室在55℃~60℃的条件下将20mL的苯(密度为0.88g/cm3)与22mL浓硫酸和20mL浓硝酸的混合液共热来制备硝基苯(难溶于水的油状液体),制备原理和装置示意图(加热和夹持装置省略)如下: +HNO3
+HNO3  +H2O
+H2O
查阅资料可知反应机理如下:
①
②
 + →
+ → 
③?。
回答下列问题:
(1)、中间产物 的分子构型是(2)、中间体正离子( )中与硝基相连的碳原子的杂化方式是。上述第③步反应的方程式为。 (3)、为了很好的控制该实验反应温度,可采用加热的方法。仪器a的名称是。恒压滴液漏斗与普通滴液漏斗相比,优点是。混合浓硫酸和浓硝酸的操作是往装有浓硝酸的烧杯中加入浓硫酸并不断搅拌。不断搅拌的目的是。(4)、反应结束后,冷却反应混合物,分离出有机层,所得物质中除硝基苯外还含有硝酸、硫酸、苯等。依次用蒸馏水、5%的NaOH溶液和蒸馏水洗涤,再用无水 干燥后得到粗硝基苯。有机层选用5%的NaOH溶液洗涤是因为。第一次用蒸馏水洗涤的主要目的是。(5)、实验所用苯的质量为。若该实验制备得到纯硝基苯18g,则该实验依据苯的用量,计算的硝基苯产率是(保留小数点后两位)21. 目前,消除二氧化硫( )和氮氧化物( )对大气污染有多种方法。(1)、处理 的一种方法是利用氨气还原法将 还原为 和 。已知还原1molNO约放出451.7kJ的热量,则该反应的热化学方程式为。(2)、全钒氧化还原液流电池,是优秀绿色环保储能电池。其电池总反应为: 。放电过程中, 向迁移(填“正极区”或“负极区”),其正极反应式为。充电时阴极反应式为。(3)、降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应: 。
)中与硝基相连的碳原子的杂化方式是。上述第③步反应的方程式为。 (3)、为了很好的控制该实验反应温度,可采用加热的方法。仪器a的名称是。恒压滴液漏斗与普通滴液漏斗相比,优点是。混合浓硫酸和浓硝酸的操作是往装有浓硝酸的烧杯中加入浓硫酸并不断搅拌。不断搅拌的目的是。(4)、反应结束后,冷却反应混合物,分离出有机层,所得物质中除硝基苯外还含有硝酸、硫酸、苯等。依次用蒸馏水、5%的NaOH溶液和蒸馏水洗涤,再用无水 干燥后得到粗硝基苯。有机层选用5%的NaOH溶液洗涤是因为。第一次用蒸馏水洗涤的主要目的是。(5)、实验所用苯的质量为。若该实验制备得到纯硝基苯18g,则该实验依据苯的用量,计算的硝基苯产率是(保留小数点后两位)21. 目前,消除二氧化硫( )和氮氧化物( )对大气污染有多种方法。(1)、处理 的一种方法是利用氨气还原法将 还原为 和 。已知还原1molNO约放出451.7kJ的热量,则该反应的热化学方程式为。(2)、全钒氧化还原液流电池,是优秀绿色环保储能电池。其电池总反应为: 。放电过程中, 向迁移(填“正极区”或“负极区”),其正极反应式为。充电时阴极反应式为。(3)、降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应: 。①该反应的化学平衡常数表达式为K=。
②若在一定温度下,将2molNO,1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示。则前20min内用CO2的浓度变化表示的反应平均速率为。
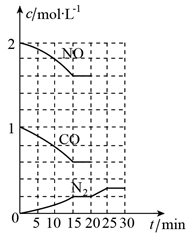
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是(填序号)。
A.加入催化剂 B.降低温度 C.缩小容器体积 D.增加 的量
(4)、利用 、 的催化作用,常温下将 转化 而实现 的处理(总反应为 )。已知,含 的废气通入含 、 的溶液时,其中一个反应的离子方程式为 ,则另一反应的离子方程式为。