广东省茂名市2020-2021学年高二下学期化学期末考试试卷
试卷更新日期:2021-08-04 类型:期末考试
一、单选题
-
1. 《本草纲目》对轻粉( )的制法载有:“用水银一两,白矾(明矾)二两,食盐一两,……以小乌盆覆之,封固盆口。以炭打二炷香取开,则粉升于盆上矣”。下列与文中描述相关的说法正确的是( )A、水银属于合金 B、白矾可用于饮用水杀菌消毒 C、文中涉及蒸馏操作 D、上述过程涉及氧化还原反应2. 实验室检验氨气的原理之一为 。下列说法正确的是( )A、HCl的电子式为
 B、 的比例模型为
B、 的比例模型为  C、 晶体中存在离子键和共价键
D、非金属性:O>N,所以沸点:
3. 实验室中下列做法错误的是( )A、贮存液溴时加水液封 B、用无水氯化钙干燥氨气 C、用坩埚灼烧固体 D、用二硫化碳洗涤内壁附有单质硫的试管4. 下列说法中正确的是( )A、可用灼烧的方法鉴别蚕丝和人造丝 B、蔗糖属于单糖,不能发生水解反应 C、植物油属于油脂,不能使酸性重铬酸钾溶液变色 D、石油的主要成分是烯烃,石油的分馏属于物理变化5. 下列仪器可用水浴加热的是( )
C、 晶体中存在离子键和共价键
D、非金属性:O>N,所以沸点:
3. 实验室中下列做法错误的是( )A、贮存液溴时加水液封 B、用无水氯化钙干燥氨气 C、用坩埚灼烧固体 D、用二硫化碳洗涤内壁附有单质硫的试管4. 下列说法中正确的是( )A、可用灼烧的方法鉴别蚕丝和人造丝 B、蔗糖属于单糖,不能发生水解反应 C、植物油属于油脂,不能使酸性重铬酸钾溶液变色 D、石油的主要成分是烯烃,石油的分馏属于物理变化5. 下列仪器可用水浴加热的是( )选项
A
B
C
D
仪器




仪器名称
小试管
量筒
容量瓶
滴定管
A、A B、B C、C D、D6. 设 为阿伏加德罗常数的值。下列说法错误的是( )A、46.0g乙醇和二甲醚( )的混合物中含有的碳原子数为2 B、 溶液中所含 的数目小于0.1 C、6.0g金刚石中含有质子的数目为3 D、 与 反应时生成0.1mol ,转移的电子数为0.27. 下列关于离子共存或离子反应的说法正确的是( )A、常温下,pH=7的溶液中, 、 、 、 可以大量共存 B、常温下, 的溶液中, 、 、 、 可以大量共存 C、泡沫灭火器中发生反应的离子方程式为 D、 通入 溶液中,发生反应的离子方程式为8. 正丁醚(相对水的密度为0.77)是一种常见有机溶剂,也可用作化工原料。实验室中以正丁醇为原料制取正丁醚的流程如图所示。下列说法错误的是( ) A、正丁醇与浓硫酸共热时需要加入沸石以防止暴沸 B、正丁醇可溶解于50%硫酸,正丁醚难溶于50%硫酸 C、水洗分液时应从分液漏斗下端分离出有机相 D、无水 的作用是除去有机相中残存的水9. 已知:25℃时, , 下列说法正确的是( )A、25℃时, 的水解常数 B、25℃时,反应 的平衡常数 C、同浓度的 溶液和NaCN溶液中, 溶液的离子总浓度较小 D、若加水稀释醋酸溶液,溶液中所有离子浓度均减小10. W、X、Y、Z为原子序数依次增大的短周期主族元素。W的单质是空气的主要成分之一;W原子的质子数与X原子的最外层电子数相等;X与Z同主族;Y的单质既能与盐酸反应产生 ,又能与氢氧化钠溶液反应产生 。下列说法正确的是( )A、简单离子半径:Z>W>X>Y B、简单氢化物的沸点:Z>W C、最高化合价:Z=X>W>Y D、工业上冶炼Y的单质:电解熔融Y与Z形成的化合物11. 乙酰胆碱(结构简式如图所示)是一种神经递质,主流研究认为人体内该物质含量增多与阿尔兹海默病的症状改善显著相关。下列关于乙酰胆碱的说法错误的是( )
A、正丁醇与浓硫酸共热时需要加入沸石以防止暴沸 B、正丁醇可溶解于50%硫酸,正丁醚难溶于50%硫酸 C、水洗分液时应从分液漏斗下端分离出有机相 D、无水 的作用是除去有机相中残存的水9. 已知:25℃时, , 下列说法正确的是( )A、25℃时, 的水解常数 B、25℃时,反应 的平衡常数 C、同浓度的 溶液和NaCN溶液中, 溶液的离子总浓度较小 D、若加水稀释醋酸溶液,溶液中所有离子浓度均减小10. W、X、Y、Z为原子序数依次增大的短周期主族元素。W的单质是空气的主要成分之一;W原子的质子数与X原子的最外层电子数相等;X与Z同主族;Y的单质既能与盐酸反应产生 ,又能与氢氧化钠溶液反应产生 。下列说法正确的是( )A、简单离子半径:Z>W>X>Y B、简单氢化物的沸点:Z>W C、最高化合价:Z=X>W>Y D、工业上冶炼Y的单质:电解熔融Y与Z形成的化合物11. 乙酰胆碱(结构简式如图所示)是一种神经递质,主流研究认为人体内该物质含量增多与阿尔兹海默病的症状改善显著相关。下列关于乙酰胆碱的说法错误的是( ) A、化学式为 B、能水解生成乙酸 C、能与 发生加成反应 D、存在四种不同化学环境的氢原子12. 某些过氧自由基可以将NO氧化为 ,反应为自由基型链反应,反应机理如图所示,已知: 标注的为自由基。下列说法错误的是( )
A、化学式为 B、能水解生成乙酸 C、能与 发生加成反应 D、存在四种不同化学环境的氢原子12. 某些过氧自由基可以将NO氧化为 ,反应为自由基型链反应,反应机理如图所示,已知: 标注的为自由基。下列说法错误的是( ) A、1个 中含有25个电子 B、该历程中能体现 的氧化性 C、X的分子式为 D、 可由 电离产生13. 常温常压下,一氧化二氯( )为棕黄色气体,沸点为3.8℃,42℃以上分解生成 和 , 易溶于水并与水反应生成HClO。利用如图所示装置(部分夹持装置略去)将 与空气(不参与反应)按体积比1∶3混合通入含水8%的 溶液中制备 ,并用水吸收 制备HClO溶液。下列说法错误的是( )
A、1个 中含有25个电子 B、该历程中能体现 的氧化性 C、X的分子式为 D、 可由 电离产生13. 常温常压下,一氧化二氯( )为棕黄色气体,沸点为3.8℃,42℃以上分解生成 和 , 易溶于水并与水反应生成HClO。利用如图所示装置(部分夹持装置略去)将 与空气(不参与反应)按体积比1∶3混合通入含水8%的 溶液中制备 ,并用水吸收 制备HClO溶液。下列说法错误的是( ) A、装置合理的连接顺序为Ⅰ→Ⅳ→Ⅱ→Ⅲ→Ⅴ B、装置Ⅱ、Ⅴ中多孔球泡的作用均为防止倒吸 C、装置Ⅲ的作用是除去 中的 D、制得的HClO溶液应保存在棕色试剂瓶中14. 电渗析法是海水淡化的方法之一,具有选择性离子交换膜交错排列构成的多层式电渗析槽,其工作原理如图所示(a、b为不同离子交换膜)。下列有关说法错误的是( )
A、装置合理的连接顺序为Ⅰ→Ⅳ→Ⅱ→Ⅲ→Ⅴ B、装置Ⅱ、Ⅴ中多孔球泡的作用均为防止倒吸 C、装置Ⅲ的作用是除去 中的 D、制得的HClO溶液应保存在棕色试剂瓶中14. 电渗析法是海水淡化的方法之一,具有选择性离子交换膜交错排列构成的多层式电渗析槽,其工作原理如图所示(a、b为不同离子交换膜)。下列有关说法错误的是( )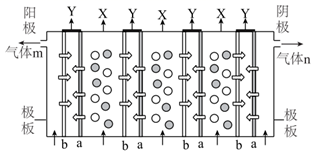 A、a为阳离子交换膜,b为阴离子交换膜 B、阴极区电极反应式为 C、X为淡盐水,Y为浓盐水 D、该方法可得到副产品NaOH15. 可用酚酞和甲基橙双指示剂法测定部分变质的烧碱中 的含量。先将部分变质的烧碱配制成一定浓度溶液并加入一种指示剂,用一定浓度的HCl溶液滴定至变色后,再加入另一种指示剂,继续用该HCl溶液滴定至变色,分别记录两个变色点加入HCl溶液体积进行计算。滴定过程中溶液pH的变化如图所示。下列说法错误的是( )
A、a为阳离子交换膜,b为阴离子交换膜 B、阴极区电极反应式为 C、X为淡盐水,Y为浓盐水 D、该方法可得到副产品NaOH15. 可用酚酞和甲基橙双指示剂法测定部分变质的烧碱中 的含量。先将部分变质的烧碱配制成一定浓度溶液并加入一种指示剂,用一定浓度的HCl溶液滴定至变色后,再加入另一种指示剂,继续用该HCl溶液滴定至变色,分别记录两个变色点加入HCl溶液体积进行计算。滴定过程中溶液pH的变化如图所示。下列说法错误的是( ) A、指示剂的添加顺序为先加酚酞,后加甲基橙 B、b点时溶液中的溶质主要为NaCl和 C、若 ,则a点溶液中存在 D、原固体混合物中碳酸钠的质量分数表示为16. 一定温度下,在甲、乙、丙三个体积均为10L的恒容密闭容器中分别发生反应 ,实验过程中测得的相关数据如下表所示。下列说法错误的是( )
A、指示剂的添加顺序为先加酚酞,后加甲基橙 B、b点时溶液中的溶质主要为NaCl和 C、若 ,则a点溶液中存在 D、原固体混合物中碳酸钠的质量分数表示为16. 一定温度下,在甲、乙、丙三个体积均为10L的恒容密闭容器中分别发生反应 ,实验过程中测得的相关数据如下表所示。下列说法错误的是( )容器
温度/℃
物质的起始加入量
平衡时Z的物质的量
甲
1000
1molX、1molY、0molZ
0.6mol
乙
1000
2molX、2molY、0molZ
丙
1200
0molX、0molY、1molZ
0.5mol
A、该反应的正反应放热 B、平衡时逆反应速率:v(丙)>v(甲) C、平衡时Z的物质的量:n(乙)>2n(甲) D、1200℃时,该反应的平衡常数二、综合题
-
17. 氨基甲酸铵( )是一种重要的工业原料,用途很广。氨基甲酸铵为可溶于乙醇、具有吸湿性的白色晶体,59℃时分解为氨和二氧化碳。使纯化、干燥后的 和 以2∶1的速率通过,充分混合制取氨基甲酸铵,反应装置如图所示(部分夹持装置略去)。

回答下列问题:
(1)、装置A用于制取的气体是(填化学式),装置B、C中盛放的试剂分别为、(填名称)。(2)、装置F中发生反应的化学方程式为。(3)、三颈烧瓶中加入适量的 ,除了充当介质之外,另一作用为 , 上口插入一个电动搅拌器,并采用玻璃套管、乳胶管使之密封,两个侧口分别通入 和 ,在不断搅拌下生成氨基甲酸铵,化学方程式为 , 生成物白色固体悬浮于介质中,经操作后,在40℃的恒温箱中干燥后密封保存。(4)、氨基甲酸铵存在分解成氨气和二氧化碳气体的平衡,用压强表示的平衡常数 及反应热 之间存在关系式: (已知:R、C为常数,T为开氏温度),有关数据如图所示。
经计算,氨基甲酸铵分解反应的反应热 (保留四位有效数字)。
(5)、实验装置末端的a导管应插入盛放浓硫酸的烧杯中,该浓硫酸的作用为。18. 在炼钢残渣中, 和FeO结合成 。经如图所示工艺流程可提取出工业级 ,继而可以制取钒单质及其化合物。
回答下列问题:
(1)、钒是第四周期第ⅤB族元素,原子的最外层电子数是2,则钒的原子结构示意图为。(2)、“氧化焙烧”过程中,钒元素转化为 ,涉及到的主要反应有三个,分别为 、 和。(3)、废渣X的主要成分的用途是(任写一点)。溶液Y中的主要溶质是(填化学式)。(4)、以工业级 为原料,可用铝热法冶炼钒单质,反应的化学方程式为。(5)、全钒液流电池的工作原理如图所示。电解槽中使用的离子交换膜仅允许 通过。已知:充电时,右侧区域 转化为 。
①充电时,b为电源的(填“正极”或“负极”)。
②放电时,正极的电极反应式为。
19. 硫化氢( )是一种剧毒、恶臭的酸性气体,危害人体健康,易造成环境污染。因此 气体的无害化处理技术已经成为人们关注的热点。回答下列问题:
(1)、已知:反应Ⅰ: ;反应Ⅱ: 。
则 。
(2)、 与 和硫黄的转换平衡一直是国内外科研工作者关注的研究领域,反应原理为 。在体积为5.0L的恒容密闭容器中充入0.1mol 和0.1mol 蒸汽,测得10min时不同温度下 的转化率与温度的关系曲线如图所示:
①a点时,前10min内,用 的浓度变化表示的平均反应速率 ;该反应的 0(填“>”或“<”)。
②下列事实能说明b点反应达到平衡状态的是(填选项字母)。
A.每分解1mol ,同时产生1mol
B.容器内气体的平均相对分子质量不再变化
C.容器内气体的密度不再变化
D.容器内 与 蒸汽的物质的量之比不再发生变化
③a、b、c三点的逆反应速率由大到小的顺序为(填字母)。
④图中 的转化率先升高后降低的原因为。
⑤1011℃下,该反应的化学平衡常数K= (保留三位有效数字)。
20. 钡的化合物在生产、生活中有重要的应用。回答下列问题:
(1)、钡元素是第六周期的碱土金属元素,其基态原子的最外层电子轨道表示式为。(2)、钡元素在自然界中主要以重晶石形式存在,其成分为 ,其中所含三种元素的电负性从大到小的顺序为(用元素符号表示); 的空间构型为 , 其中S原子的杂化方式为。(3)、BaO与MgO相比,熔点较高的为(填“BaO”或“MgO”),原因为。(4)、氯化钡的玻恩哈伯循环如图所示:
①由图可知,Cl-Cl键的键能为。
②由图可知,Ba的第一电离能 ,第二电离能 ,从微观结构角度解释 的原因:。
③元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能( ),则Cl的第一电子亲和能 。
(5)、氟化钡的晶胞结构如图所示。其中 的配位数为;若相邻两个 的核间距离为apm, 表示阿伏加德罗常数的值,则氟化钡的密度 (用含a、 的代数式表示,列出计算式即可)。 21. 有机物J为合成四环素的一个中间体,由乙烯和间甲基苯酚为原料合成J的流程如图所示:
21. 有机物J为合成四环素的一个中间体,由乙烯和间甲基苯酚为原料合成J的流程如图所示:
回答下列问题:
(1)、A的化学名称为;D中所含官能团的名称为。(2)、B→C的反应类型为。(3)、写出C+E→F的化学反应方程式:;F+G→H是G中的碳碳双键发生的加成反应,写出G的结构简式:。(4)、K与E互为同分异构体,符合下列条件的K的结构有种(不考虑立体异构);写出其中一种结构简式:。①能与 溶液发生显色反应。
②能发生银镜反应和水解反应。
③核磁共振氢谱有四组峰,且峰面积之比为6∶2∶1∶1。