天津市北辰区2021年高考化学一模试卷
试卷更新日期:2021-08-04 类型:高考模拟
一、单选题
-
1. 下列贡献与中国科学家有关的是( )A、提出元素周期律 B、发明合成氨技术 C、提出电子云模型 D、发现青蒿素2. 下列说法错误的是( )A、利用油脂在碱性条件下水解,可以制甘油和肥皂 B、聚乙烯、光导纤维都是有机高分子材料 C、向淀粉的水解液中加入碘水,溶液变蓝,不能说明淀粉未水解 D、疫苗一般应冷藏存放,以避免蛋白质变性3. 下列性质的比较,不能用元素周期律解释的是( )A、酸性:H3BO3<H2CO3 B、还原性:S2->O2- C、沸点:H2S<H2O D、原子半径:Si>S4. 若NA为阿伏加德罗常数的值,下列说法正确的是( )A、1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA B、1.0mol/L的Na2CO3水溶液中c(Na+) :c( )>2:1 C、常温下56g铁片投入足量浓硫酸中生成NA个SO2分子 D、1mol羟基与1mol氢氧根离子所含电子数均为9NA5. 下列离子方程式正确的是( )A、用SO2溶液吸收溴蒸汽:SO2+Br2+2H2O= +2Br-+4H+ B、FeO溶于足量稀硝酸:FeO+2H+=Fe2++H2O C、用醋酸溶解水垢中的碳酸钙:CaCO3+2H+=Ca2++CO2↑+H2O D、腐蚀印刷线路板的反应:Fe3++Cu=Fe2++Cu2+6. 下列说法错误的是( )A、李比希元素定量分析可以确定有机物分子组成及其结构式 B、胶体和溶液的本质区别是粒子直径大小 C、X-射线衍射图谱可以区分晶体和非晶体 D、氧化还原反应的本质是电子的转移7. 绿原酸(结构如下图)是金银花的主要抗菌、抗病毒有效药理成分之一,有关该化合物,下列叙述正确的是( )
 A、分子式为:C16H20O9 B、该有机物中所有碳原子可能共平面 C、能够发生消去反应生成碳碳双键 D、1mol该化合物最多可消耗5molNaOH8. X、Y、Z、W、R属于周期表中前20号主族元素,且原子序数依次增大。X的简单氢化物水溶液显碱性,Z是元素周期表中电负性最大的元素,Z和W同主族,R的基态原子只有一个未成对电子。下列说法正确的是( )A、简单离子半径:r(R)>r(W)>r(Z) B、第一电离能:I1(X)>I1(Y)>I1(Z) C、Z的最高价氧化物的水化物是强酸 D、X的简单氢化物分子属于极性分子9. 如图是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图(Ea表示活化能),下列说法错误的是( )
A、分子式为:C16H20O9 B、该有机物中所有碳原子可能共平面 C、能够发生消去反应生成碳碳双键 D、1mol该化合物最多可消耗5molNaOH8. X、Y、Z、W、R属于周期表中前20号主族元素,且原子序数依次增大。X的简单氢化物水溶液显碱性,Z是元素周期表中电负性最大的元素,Z和W同主族,R的基态原子只有一个未成对电子。下列说法正确的是( )A、简单离子半径:r(R)>r(W)>r(Z) B、第一电离能:I1(X)>I1(Y)>I1(Z) C、Z的最高价氧化物的水化物是强酸 D、X的简单氢化物分子属于极性分子9. 如图是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图(Ea表示活化能),下列说法错误的是( ) A、增大Cl2的浓度,可提高反应速率,但不影响ΔH的大小 B、第一步反应的速率小于第二步反应 C、总反应为放热反应 D、升高温度,Ea1、Ea2均增大,反应速率加快10. K2Cr2O7溶液中存在平衡: 。用K2Cr2O7溶液进行下列实验。下列说法错误的是( )
A、增大Cl2的浓度,可提高反应速率,但不影响ΔH的大小 B、第一步反应的速率小于第二步反应 C、总反应为放热反应 D、升高温度,Ea1、Ea2均增大,反应速率加快10. K2Cr2O7溶液中存在平衡: 。用K2Cr2O7溶液进行下列实验。下列说法错误的是( ) A、①中 和 浓度相等说明反应达平衡 B、①中溶液橙色加深,③中溶液变黄 C、②中 被C2H5OH还原为Cr3+ D、若向④中加入70%H2SO4溶液至过量,溶液变为绿色11. 锌电池具有价格便宜、比能量大、可充电等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是( )
A、①中 和 浓度相等说明反应达平衡 B、①中溶液橙色加深,③中溶液变黄 C、②中 被C2H5OH还原为Cr3+ D、若向④中加入70%H2SO4溶液至过量,溶液变为绿色11. 锌电池具有价格便宜、比能量大、可充电等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是( ) A、放电过程中, 向a极迁移 B、充电过程中,b电极反应为:Zn2++2e-=Zn C、充电时,a电极与电源正极相连 D、放电过程中,转移0.4mole-时,a电极消耗0.4molH+12. 室温下,向10mL0.1000molNa2CO3溶液中逐滴滴加0.1000mol/LHCl溶液,整个反应过程中无气体逸出(溶解的CO2均表示为H2CO3)。测得混合溶液的pH随加入HCl溶液体积的变化如下图。下列说法正确的是( )
A、放电过程中, 向a极迁移 B、充电过程中,b电极反应为:Zn2++2e-=Zn C、充电时,a电极与电源正极相连 D、放电过程中,转移0.4mole-时,a电极消耗0.4molH+12. 室温下,向10mL0.1000molNa2CO3溶液中逐滴滴加0.1000mol/LHCl溶液,整个反应过程中无气体逸出(溶解的CO2均表示为H2CO3)。测得混合溶液的pH随加入HCl溶液体积的变化如下图。下列说法正确的是( ) A、a点溶液的溶质主要为NaCl、NaHCO3 B、b点溶液中c(Na+)+c(H+)>c(OH-)+c( )+2c( ) C、c点时,溶液中发生的离子反应是3 +4H+=2 +H2CO3 D、取d点溶液加热至沸腾,然后冷却至室温,溶液的pH不变
A、a点溶液的溶质主要为NaCl、NaHCO3 B、b点溶液中c(Na+)+c(H+)>c(OH-)+c( )+2c( ) C、c点时,溶液中发生的离子反应是3 +4H+=2 +H2CO3 D、取d点溶液加热至沸腾,然后冷却至室温,溶液的pH不变二、综合题
-
13. 2019年诺贝尔化学奖授予约翰·B·古迪纳夫、M·斯坦利·威廷汉、吉野彰等三位科学家,以表彰他们在锂电池研究作出的卓越贡献。常用的锂电池用镍钴锰酸锂Li(NiCoMn)O2或磷酸铁锂(LiFePO4)等为正极材料。请回答下列问题:(1)、基态Ni原子的价电子排布图为。(2)、 的空间构型为 , 其中心原子的杂化类型是。(3)、|Co(NH3)4Cl2|Cl是一种钴常见的配合物,其中Co的配位数是 , 1mol该配合物含σ键数目为 , 若1mol该配合物与足量AgNO3溶液反应,生成沉淀的质量为g。(4)、Fe、Co、Ni三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为。(5)、硫化锂Li2S的纳米晶体是开发先进锂电池的关键材料,Li2S晶体为反萤石(萤石CaF2)结构,其晶胞结构如图。

S2-的配位数是 , 设NA为阿伏加德罗常数的值,若Li2S晶体的密度为ρg·cm-3 , 则晶胞边长是nm(用含ρ、NA的计算式表示)。
14. 烃A是基本有机化工原料,其分子式为C3H6 , 由A制备聚合物C和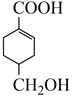 合成路线如图所示(部分条件略去)
合成路线如图所示(部分条件略去)  已知:
已知: 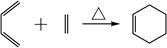 ,R-C≡N RCOOH(1)、B中含氧官能团名称为。(2)、C的结构简式为。(3)、A→D的反应类型为。(4)、用星号(*)标出该化合物
,R-C≡N RCOOH(1)、B中含氧官能团名称为。(2)、C的结构简式为。(3)、A→D的反应类型为。(4)、用星号(*)标出该化合物 中所含的手性碳原子 , 下列物质不能与
中所含的手性碳原子 , 下列物质不能与  发生反应的是(填序号)。
发生反应的是(填序号)。 a.NaOH溶液 b.溴水 c.FeCl3溶液 d.金属Na
(5)、写出E→F的化学方程式为。(6)、满足以下条件,化合物B的同分异构体有种,①与B具有相同官能团
②能发生银镜反应:
写出其中核磁共振氢谱有3组峰,且峰面积之比为6:1:1的结构简式。
(7)、根据题中信息,写出以甲苯和乙醇为有机原料制备苯乙酸乙酯的合成路线(无机试剂任选)。15. 《中国锰业》一文提出用废铁屑还原软锰矿,制取高纯硫酸锰的工艺流程如下图所示。某公司提供的软锰矿,其主要成分是二氧化锰,其中还含有少量Fe、CaO、MgO、SiO2及重金属等。 (1)、I中加铁屑而不加铁块的原因是。(2)、写出I中铁屑与软锰矿发生的主要反应的离子方程式。(3)、加CaCO3之前需要加双氧水的作用 , 结合下表说明,加CaCO3控制溶液pH的范围是。
(1)、I中加铁屑而不加铁块的原因是。(2)、写出I中铁屑与软锰矿发生的主要反应的离子方程式。(3)、加CaCO3之前需要加双氧水的作用 , 结合下表说明,加CaCO3控制溶液pH的范围是。可能用到的数据如下:不同金属离子沉淀的pH
氢氧化物
Fe(OH)3
Fe(OH)2
Mn(OH)2
开始沉淀pH
1.5
6.5
7.7
沉淀完全pH
3.7
9.7
9.8
(4)、深度除杂中加入MnF2的作用。(5)、从滤液中获取MnSO4晶体的方法是、趁热过滤。硫酸锰在不同温度下的溶解度表
温度/℃
50
80
90
100
溶解度1(g/100g水)
58
48
42
34
(6)、为探究稀硫酸介质中湿法还原软锰矿制备硫酸锰的最佳工艺条件,研究了n(Fe)/n(MnO2)对锰浸出率η的影响。如图实验条件为n(H2SO4):n(MnO2)=2.1:1,反应温度为50℃,反应时间为80min。请结合图像分析n(Fe)/n(MnO2)约为最合适,并说出理由。 16. 国务院总理李克强在2021年国务院政府工作报告中指出,扎实做好碳达峰、碳中和各项工作,优化产业结构和能源结构,努力争取2060年前实现碳中和。碳的化合物在工业上应用广泛,下面有几种碳的化合物的具体应用:(1)、已知下列热化学方程式:
16. 国务院总理李克强在2021年国务院政府工作报告中指出,扎实做好碳达峰、碳中和各项工作,优化产业结构和能源结构,努力争取2060年前实现碳中和。碳的化合物在工业上应用广泛,下面有几种碳的化合物的具体应用:(1)、已知下列热化学方程式:i.CH2=CHCH3(g)+Cl2(g)→CH2ClCHClCH3(g) ΔH=-133kJ·mol-1
ii.CH2=CHCH3(g)+Cl2(g)→CH2=CHCH2Cl(g)+HCl(g) ΔH=-100kJ·mol-1
①写出相同条件下CH2=CHCH2Cl和HCl合成CH2ClCHClCH3的热化学方程式。
②已知①中的正反应的活化能E正为132kJ·mol-1 , 请在下图中标出①中逆反应的活化能E逆及数值。
 (2)、温度为T℃时向容积为2L的密闭容器中投入3molH2和1molCO2发生反应CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1 , 反应达到平衡时,测得放出热量19.76kJ,求平衡时:
(2)、温度为T℃时向容积为2L的密闭容器中投入3molH2和1molCO2发生反应CO2(g)+3H2(g)⇌ CH3OH(g)+H2O(g) ΔH1=-49.4kJ·mol-1 , 反应达到平衡时,测得放出热量19.76kJ,求平衡时:①H2的转化率为
②T℃时该反应的平衡常数K=(列计算式表示)。
(3)、目前有Ni-CeO2催化CO2加H2形成CH4的反应,历程如图所示,吸附在催化剂表面的物种用*标注。
①写出上述转换中存在的主要反应的化学方程式。
②有人提出中间产物CO的处理,用反应2CO(g)=2C(s)+O2(g) ΔH>0来消除CO的污染,请用文字说明是否可行。
(4)、T℃,HCOOH与CH3COONa溶液反应:HCOOH+CH3COO-⇌HCOO-+CH3COOH,该反应的K=12.5,则该温度下醋酸的电离常数Ka(CH3COOH)=(T℃时Ka(HCOOH)=2×10-4)。