安徽省2021年高考化学5月模拟试卷
试卷更新日期:2021-08-04 类型:高考模拟
一、单选题
-
1. 生活中处处是化学,下列说法正确的是( )A、大米、小麦中的营养成分只有淀粉 B、生理盐水是含9%的NaCl无菌水溶液 C、农村推广风力发电、光伏发电有利于“碳达峰、碳中和” D、家用消毒剂都是利用消毒剂的强氧化性2. 糠醇可用于有机合成树脂、涂料等,四氢糠醇可做印染工业的润湿剂和分散剂,它们的转化关系如图,下列说法正确的是( )
 A、该反应类型为加成反应 B、糠醇分子中所有原子可能共平面 C、四氢糠醇可以发生取代、还原、消去、水解等反应 D、糠醇可以使酸性高锰酸钾溶液褪色,而四氢糠醇不可以3. W、X、Y、Z是原子序数依次增大的前20号元素,W的某一种核素只由两种微粒构成,X的一种氧化物与其氢化物在水溶液中反应产生沉淀,Y-和Z+的电子层结构相同。下列叙述错误的是( )A、气态氢化物稳定性:Y>X B、简单离子半径:X>Y>Z>W C、W与Z能形成具有强还原性的化合物 D、Y的含氧酸的酸性比X的含氧酸的酸性强4. 我国稀土资源丰富,稀土铈(Ce)元素主要存在于独居石中。Ce常见化合价为+3、+4。近年来发现用铈(Ce)的氧化物可以高效制备H2 , 制备原理如图所示,下列说法正确的是( )
A、该反应类型为加成反应 B、糠醇分子中所有原子可能共平面 C、四氢糠醇可以发生取代、还原、消去、水解等反应 D、糠醇可以使酸性高锰酸钾溶液褪色,而四氢糠醇不可以3. W、X、Y、Z是原子序数依次增大的前20号元素,W的某一种核素只由两种微粒构成,X的一种氧化物与其氢化物在水溶液中反应产生沉淀,Y-和Z+的电子层结构相同。下列叙述错误的是( )A、气态氢化物稳定性:Y>X B、简单离子半径:X>Y>Z>W C、W与Z能形成具有强还原性的化合物 D、Y的含氧酸的酸性比X的含氧酸的酸性强4. 我国稀土资源丰富,稀土铈(Ce)元素主要存在于独居石中。Ce常见化合价为+3、+4。近年来发现用铈(Ce)的氧化物可以高效制备H2 , 制备原理如图所示,下列说法正确的是( ) A、CeO2-δ不能作为水分解的催化剂 B、温度高于1050℃时,CeO2比CeO2-δ更稳定 C、若δ=0.2,则CeO2-δ中Ce3+:Ce4+=2:3 D、通过CeO2和CeO2-δ相互转化,降低了反应的焓变,加快了反应速率5. 下列由实验操作和现象推出的结论正确的是( )
A、CeO2-δ不能作为水分解的催化剂 B、温度高于1050℃时,CeO2比CeO2-δ更稳定 C、若δ=0.2,则CeO2-δ中Ce3+:Ce4+=2:3 D、通过CeO2和CeO2-δ相互转化,降低了反应的焓变,加快了反应速率5. 下列由实验操作和现象推出的结论正确的是( )选项
实验操作和现象
结论
A
某SO2气体中可能存在CO2 , 将气体依次通过NaHCO3溶液、品红溶液、澄清石灰水,品红溶液不褪色,澄清石灰水变浑浊
该气体中存在CO2
B
去家用食盐少量,溶于水,加少量淀粉固体,充分搅拌,无明显变化
这是一种没有添加碘的食盐
C
取细铁丝在酒精灯上灼烧至红热,再伸入充满氯气的瓶中,剧烈反应,产生大量红褐色的烟,结束后,加水振荡,使固体充分溶解,再滴加2滴KSCN溶液,溶液未变色
Fe再Cl2中燃烧生成FeCl2
D
将钠块融化后,上面倒扣一个充满CO2的集气瓶,剧烈燃烧,产生大量白烟,瓶壁有黑色固体
钠置换产生了碳单质
A、A B、B C、C D、D6. 某科研小组设计了一种新型双微生物燃料电池装置,如图所示。在a极将生活污水中的有机物(以C6H12O6为例)转化为CO2 , b极将酸性工业废水中的硝酸盐转化为N2。下列说法错误的是( ) A、a电极反应式为:C6H12O6-24e-+6H2O=6CO2↑+24H+ B、若b极产生了4.48 L(已换算为标准状况)的气体,则穿过质子交换膜进入左室的H+数目为2NA C、电池工作时,电流由b极经负载流向a极,再经两电解质溶液回到b极 D、若用该电池对铅蓄电池进行充电,b极接PbO2极7. 常温下,将HCl气体通入0.1 mol/L氨水中,混合溶液中pH与微粒浓度的对数值(lgc)和反应物物质的量之比X[X= ]的关系如图所示(忽略溶液体积的变化),下列说法正确的是( )
A、a电极反应式为:C6H12O6-24e-+6H2O=6CO2↑+24H+ B、若b极产生了4.48 L(已换算为标准状况)的气体,则穿过质子交换膜进入左室的H+数目为2NA C、电池工作时,电流由b极经负载流向a极,再经两电解质溶液回到b极 D、若用该电池对铅蓄电池进行充电,b极接PbO2极7. 常温下,将HCl气体通入0.1 mol/L氨水中,混合溶液中pH与微粒浓度的对数值(lgc)和反应物物质的量之比X[X= ]的关系如图所示(忽略溶液体积的变化),下列说法正确的是( ) A、NH3·H2O的电离平衡常数为10-9.25 B、P2点由水电离出的c(H+)=1.0×10-7 mol/L C、P3为恰好完全反应点,c(Cl-)+c(NH )=0.2 mol/L D、P3之后,水的电离程度一直减小
A、NH3·H2O的电离平衡常数为10-9.25 B、P2点由水电离出的c(H+)=1.0×10-7 mol/L C、P3为恰好完全反应点,c(Cl-)+c(NH )=0.2 mol/L D、P3之后,水的电离程度一直减小二、综合题
-
8. 乙酰水杨酸,俗称阿司匹林(
 ),是常用的解热镇痛药。合成原理:
),是常用的解热镇痛药。合成原理: 
查阅资料:
阿司匹林:相对分子质量为180,受热易分解,溶于乙醇、难溶于水;
水杨酸(
 ):溶于乙醇、微溶于水;
):溶于乙醇、微溶于水;乙酸酐[(CH3CO)2O]:无色透明液体,遇水形成乙酸。
实验室合成阿司匹林的步骤如下:
制备过程:
①如图1向三颈烧瓶中加入7 g水杨酸、新蒸出的乙酸酐10 mL,再加10滴浓硫酸反复振荡后,连接回流装置,搅拌,70℃加热半小时。
②冷却至室温后,将反应混合液倒入100 mL冷水中,并用冰水浴冷却15 min,用图2装置抽滤,洗涤得到乙酰水杨酸粗品。
提纯过程:
③将粗产品转至烧瓶中,装好回流装置,向烧瓶内加入100 mL乙酸乙酯和2粒沸石,加热回流,进行热溶解。然后趁热过滤,冷却至室温,抽滤,洗涤,干燥,得无色晶体状乙酰水杨酸。
纯度测定:
④取少量产品,加5 mL水充分溶解,滴加3滴1% FeCl3溶液,无明显变化。再准确称取产品0.3900 g,用20.00 mL乙醇溶解,加2滴酚酞,用0.1000 mol/L NaOH溶液滴定至终点,消耗NaOH溶液21.00 mL。
回答下列问题:
 (1)、步骤①中浓硫酸的作用是。(2)、步骤①中加热宜采用 , 冷凝回流过程中外界(填化学式)可能进入三颈烧瓶,导致发生副反应(填化学方程式),降低了水杨酸的转化率。(3)、抽滤相对于普通过滤的优点是。(4)、步骤③中肯定用不到的装置是。(填字母序号)
(1)、步骤①中浓硫酸的作用是。(2)、步骤①中加热宜采用 , 冷凝回流过程中外界(填化学式)可能进入三颈烧瓶,导致发生副反应(填化学方程式),降低了水杨酸的转化率。(3)、抽滤相对于普通过滤的优点是。(4)、步骤③中肯定用不到的装置是。(填字母序号) (5)、步骤③洗涤中洗涤剂最好选择_______。(填字母序号)A、15%的乙醇溶液 B、NaOH溶液 C、冷水 D、滤液(6)、步骤④中加FeCl3的作用是。样品纯度为%(精确到小数点后两位)。9. 随着电动汽车的大量使用,废旧锂电池的再利用成为科技工作者研究的重要课题,某化工厂从废旧锂电池正极材料(主要成分为LiCoO2、炭黑及铝片)中回收锂、铝、钴的流程如图所示。
(5)、步骤③洗涤中洗涤剂最好选择_______。(填字母序号)A、15%的乙醇溶液 B、NaOH溶液 C、冷水 D、滤液(6)、步骤④中加FeCl3的作用是。样品纯度为%(精确到小数点后两位)。9. 随着电动汽车的大量使用,废旧锂电池的再利用成为科技工作者研究的重要课题,某化工厂从废旧锂电池正极材料(主要成分为LiCoO2、炭黑及铝片)中回收锂、铝、钴的流程如图所示。 (1)、CoC2O4中钴元素化合价为 , 料渣1的成分是。(2)、酸浸还原过程中,Na2SO3的作用是(用离子方程式表示),还要防火防爆,原因是。(3)、常温下,当pH=4.7时,溶液中沉淀完全(c(Al3+)≤10-5 mol/L),则Ksp[Al(OH)3]最大值为 , 以料渣2为原料制备Al的过程简述为。(4)、磷酸二异辛酯必须具有的两种物理性质是 , 54.9 g CoC2O4·2H2O在空气中充分加热至330℃时,固体质量不再变化时称得固体为24.1 g,则得到X的化学方程式为。10. 苯乙烯是重要的有机合成单体,常用乙苯为原料合成。(1)、以CO2和乙苯为原料合成的苯乙烯,其过程如图1,有“一步”途径1和“二步”途径2的两种推测:
(1)、CoC2O4中钴元素化合价为 , 料渣1的成分是。(2)、酸浸还原过程中,Na2SO3的作用是(用离子方程式表示),还要防火防爆,原因是。(3)、常温下,当pH=4.7时,溶液中沉淀完全(c(Al3+)≤10-5 mol/L),则Ksp[Al(OH)3]最大值为 , 以料渣2为原料制备Al的过程简述为。(4)、磷酸二异辛酯必须具有的两种物理性质是 , 54.9 g CoC2O4·2H2O在空气中充分加热至330℃时,固体质量不再变化时称得固体为24.1 g,则得到X的化学方程式为。10. 苯乙烯是重要的有机合成单体,常用乙苯为原料合成。(1)、以CO2和乙苯为原料合成的苯乙烯,其过程如图1,有“一步”途径1和“二步”途径2的两种推测:
则CO2(g)+
 (g)
(g)  (g)+CO(g)+H2O(g)的K3(用含K1、K2的代数式表达)。(2)、向刚性容器中充入10 mol CO2和10 mol乙苯,发生反应CO2(g)+
(g)+CO(g)+H2O(g)的K3(用含K1、K2的代数式表达)。(2)、向刚性容器中充入10 mol CO2和10 mol乙苯,发生反应CO2(g)+ (g)
(g)  (g)+CO(g)+H2O(g),在不同温度下测得平衡时各物质的体积分数如图2。可知∆H30。相同温度下CO2转化率低于乙苯,推知发生了副反应CO(g)+H2O(g) CO2(g)+H2(g),由图像知该反应∆H0。
(g)+CO(g)+H2O(g),在不同温度下测得平衡时各物质的体积分数如图2。可知∆H30。相同温度下CO2转化率低于乙苯,推知发生了副反应CO(g)+H2O(g) CO2(g)+H2(g),由图像知该反应∆H0。  (3)、某研究团队找到乙苯直接脱氢的高效催化剂,反应原理如图:
(3)、某研究团队找到乙苯直接脱氢的高效催化剂,反应原理如图: (g) H2(g)+
(g) H2(g)+  (g) ∆H1
(g) ∆H1①已知部分化学键键能数据如表所示:
共价键
C-C
C-H
C=C
H-H
键能(kJ/mol)
347.7
413.4
615
436
则∆H1=。
②实际过程中,通常向乙苯中掺入水蒸气,保持体系总压为100 kPa的条件下进行。乙苯平衡转化率与温度、投料比m[m= ]的关系如图3。则投料比m1、m2、m3由大到小的关系为。
③若m2=5:1,则A点温度下,该反应的平衡常数Kp=。若其他条件不变,将恒压调整为恒容状态,则A点对应的乙苯的平衡转化率(填“增大”、“不变”或“减小”)。
 (4)、实验测得,乙苯脱氢的速率方程为 正=k正p乙苯 , 逆=k逆p苯乙烯p氢气(k正、k逆为速率常数,只与温度有关),图4中③代表lgk逆随 的变化关系,则能代表lgk正随 的变化关系的是。
(4)、实验测得,乙苯脱氢的速率方程为 正=k正p乙苯 , 逆=k逆p苯乙烯p氢气(k正、k逆为速率常数,只与温度有关),图4中③代表lgk逆随 的变化关系,则能代表lgk正随 的变化关系的是。 11. 镍是一种亲铁元素,地核主要由铁、镍元素组成。(1)、基态镍原子的价电子排布式为。(2)、配合物Ni(CO)4常温为液体,其最可能的晶体类型是 , 配位原子为。CO与N2互为等电子体,熔沸点更高的是CO,其原因是。(3)、NiSO4溶液与丁二酮肟的反应如图,该反应可以用来鉴别Ni2+。
11. 镍是一种亲铁元素,地核主要由铁、镍元素组成。(1)、基态镍原子的价电子排布式为。(2)、配合物Ni(CO)4常温为液体,其最可能的晶体类型是 , 配位原子为。CO与N2互为等电子体,熔沸点更高的是CO,其原因是。(3)、NiSO4溶液与丁二酮肟的反应如图,该反应可以用来鉴别Ni2+。
①丁二酮肟中四种元素电负性由大到小的顺序为 , 碳原子的杂化轨道类型为。
②二(丁二酮肟)合镍(II)中存在的化学键有(填选项字母)。
A.σ键 B.π键 C.配位健 D.氢键 E.范德华力
(4)、镍可做许多有机物与氢气加成的催化剂,例如吡啶( )的反应方程式为:
)的反应方程式为: 3H2+


吡啶中大Π键可以表示为。
(5)、某种镁、镍和碳三种元素形成的晶体具有超导性。该晶体可看作是镁原子做顶点,镍原子作面心的面心立方堆积(晶胞结构如图,未标出碳原子位置),碳原子只填充在由镍构成的八面体空隙。
①图中碳原子的位置位于晶胞的。
②已知晶胞中相邻且最近的镁、碳原子间核间距为a nm,NA为阿伏加德罗常数的值,其密度为g/cm3(列出算式即可)。
12. 化合物H是用于治疗慢性阻塞性肺病奥达特罗的合成中间体,其合成路线如图: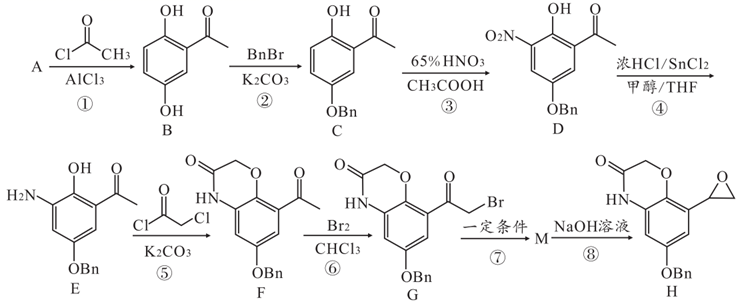
已知:I.BnBr代表
 II.
II. 
回答下列问题:
(1)、A的名称为;B中官能团的名称为。(2)、D→E的反应类型为 , 反应⑤条件中K2CO3的作用是。(3)、有机物G、M的分子式分别为C17H14O4NBr、C17H16O4NBr,则M→H的反应方程式为。(4)、有机物N是反应②过程中的副产物,其分子式为C22H20O3 , 则N的结构简式为。(5)、B的同分异构体中,既能水解,又能使FeCl3溶液显紫色的有种。(6)、参照上述合成路线和信息,请写出以苯酚和光气(COCl2)为原料合成 的路线。
的路线。