山西运城市2020年高考化学一模试卷
试卷更新日期:2021-08-04 类型:高考模拟
一、单选题
-
1. 化学与生产生活息息相关,下列有关说法正确的是( )A、预防新冠病毒用95%的酒精比用75%的酒精效果好 B、“雷雨发庄稼”既涉及到氮的固定又涉及到农作物对NH4+的吸收 C、一束光通过气溶胶时会产生一条光亮的通路,这是胶体特有的现象 D、漂白粉、漂白液和漂粉精的有效成分都是次氯酸钙2. 设NA为阿伏加德罗常数的值,下列说法错误的是( )A、28g乙烯和环烷的混合气体中含有的碳原子数为2NA B、2.0gD2O中含有的质子数、电子数均为NA C、常温下,5.6gFe与含0.2molHNO3的溶液充分作用,最少失去的电子数为0.15NA D、含1molCl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA3. 如图是某有机化合物的结构简式,下列有关说法正确的是( )
 A、该有机物的分子式为C17H13O5 B、该分子中含有4种共6个官能团 C、该分子中最多有八个碳原子共面 D、该有机物可以使溴水褪色,是因为分子中含有羟基4. 图(1)是实验室合成溴苯并检验其部分生成物的装置,下列说法错误的是( )
A、该有机物的分子式为C17H13O5 B、该分子中含有4种共6个官能团 C、该分子中最多有八个碳原子共面 D、该有机物可以使溴水褪色,是因为分子中含有羟基4. 图(1)是实验室合成溴苯并检验其部分生成物的装置,下列说法错误的是( ) A、苯和液溴在A中发生反应的化学方程式为:
A、苯和液溴在A中发生反应的化学方程式为: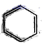 +Br2
+Br2  +HBr
B、实验中C中的液体逐渐变为浅红色,是因为溴具有挥发性
C、D,E,F均具有防倒吸的作用,其中F不可以用图(2)所示装置代替
D、D中石蕊试液慢慢变红,E中产生浅黄色沉淀
5. 氮氧化物(NOx)是有毒的大气污染物,研究发现,可以采用如图装置有效去除氮的氧化物,下列说法正确的是( )
+HBr
B、实验中C中的液体逐渐变为浅红色,是因为溴具有挥发性
C、D,E,F均具有防倒吸的作用,其中F不可以用图(2)所示装置代替
D、D中石蕊试液慢慢变红,E中产生浅黄色沉淀
5. 氮氧化物(NOx)是有毒的大气污染物,研究发现,可以采用如图装置有效去除氮的氧化物,下列说法正确的是( ) A、电解过程中,Pt电极I上发生氧化反应 B、电解过程中,Pt电极II上发生反应:4OH--4e-=2H2O+O2↑ C、电解过程中,左极室pH会逐渐减小, D、若NOx为NO,转移1mol电子时吸收塔中消耗0.5molS2O42-6. W、X、Y、Z、Q为原子序数依次增大的前20号元素,W、X、Z形成的一种化合物A为无色油状液体,是中学化学中常用的无机试剂。Y和Q形成的化合物QY2可与化合物A反应,生成的气体WY可腐蚀玻璃。下列说法错误的是( )A、Y的最高价氧化物对应的水化物的酸性比Z的强 B、W和Q可以形成离子化合物 C、简单离子半径Z>Q>X>Y>W D、X的简单气态氢化物比Z的更稳定7. 室温下用等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系正确的是( )
A、电解过程中,Pt电极I上发生氧化反应 B、电解过程中,Pt电极II上发生反应:4OH--4e-=2H2O+O2↑ C、电解过程中,左极室pH会逐渐减小, D、若NOx为NO,转移1mol电子时吸收塔中消耗0.5molS2O42-6. W、X、Y、Z、Q为原子序数依次增大的前20号元素,W、X、Z形成的一种化合物A为无色油状液体,是中学化学中常用的无机试剂。Y和Q形成的化合物QY2可与化合物A反应,生成的气体WY可腐蚀玻璃。下列说法错误的是( )A、Y的最高价氧化物对应的水化物的酸性比Z的强 B、W和Q可以形成离子化合物 C、简单离子半径Z>Q>X>Y>W D、X的简单气态氢化物比Z的更稳定7. 室温下用等浓度的NaOH溶液滴定25.00mL0.1000mol·L-1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系正确的是( )已知:①Ka1(H2C2O4)=5.4×10-2 Ka2(H2C2O4)=5.4×10-5
②设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
A、滴入NaOH溶液体积为25.00mL时:c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+) B、pH=7的溶液:c(Na+)=c(C2O42-)+c(HC2O4-) C、当c(Na+)=2c(总)时:c(OH-)=c(H+)+c((HC2O4-)+c(H2C2O4) D、0.1000mol·L-1H2C2O4溶液:c(H+)=0.1000mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4)二、综合题
-
8. 某小组为测定化合物Co(NH3)yClx(其中Co为+3价)的组成,进行如下实验。(1)、氯的测定:准确称取2.675g该化合物,配成溶液后用1.00mol·L-1AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀(Ag2CrO4为砖红色)且不再消失时,消耗AgNO3溶液30.00mL。[已知:Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.12×10-12]
①AgNO3标准溶液需要放在棕色的滴定管中的原因是。(用化学方程式表示)
②若滴定终点读数时滴定管下口悬挂了一滴液体,会使得测定结果。(填“偏大”、“偏小”、“无影响”)
③用K2CrO4溶液作指示剂的理由是。
(2)、氨的测定:再准确称取2.675g该化合物,加适量水溶解,注入如图4。(填仪器名称)中,然后通过仪器3滴加足量的NaOH溶液,加热1装置,产生的氨气被5中的盐酸吸收,多余的盐酸再用NaOH标准溶液反滴定,经计算,吸收氨气消耗1.00mol·L-1盐酸60.00mL。
装置A在整个实验中的作用是 , 如果没有6中的冰盐水,会使得测定结果(填“偏大”、“偏小”、“无影响”)。
(3)、通过处理实验数据可知该化合物的组成为。9. 五氧化二钒(V2O5)为强氧化剂,易被还原成各种低价氧化物,在工业生产中常用作催化剂,即触媒。实验室以含钒废料(含V2O3、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
已知I.25℃时,难溶电解质的溶度积常数如表所示:

II.NH4VO3在水中的溶解度:20℃、4.8g·L-1;60℃、24.2g·L-1。
回答下列问题:
(1)、“焙烧”的目的是。(2)、“滤渣1”的用途为 (写出一种即可)。(3)、滤渣2成分为。通过列式计算说明,常温下,若“调pH”为6,Cu2+是否沉淀完全。(溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全)(4)、“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为。(5)、滤渣3成分为MnCO3 , 请写出“沉锰”的离子方程式。(6)、V2O5最重要的应用是在接触法制硫酸时,作SO2氧化为SO3的催化剂。该催化反应中VO2为中间产物,请用化学方程式表示该催化过程:、。10. 磷酸是重要的化学试剂和工业原料。请回答下列问题:(1)、已知:25℃时,磷酸和碳酸的电离常数如下表所示。
向Na2CO3溶液中滴加少量H3PO4溶液,反应的离子方程式为。
(2)、已知:I.CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ∆H= -271kJ·mol-1
II.5CaO(s)+3H3PO4(l)+HF(g)=Ca3(PO4)3F(s)+5H2O(l) ∆H=-937 kJ·mol-1
回答下列问题:
①工业上用Ca3(PO4)3F和硫酸反应制备磷酸的热化学方程式为。
②一定条件下,在密闭容器中只发生反应II,达到平衡后缩小容器容积,HF的平衡转化率 (填“增大”“减小”或“不变”,下同);HF的平衡浓度。
(3)、工业上用磷尾矿制备Ca3(PO4)3F时生成的副产物CO可用于制备H2 , 原理为CO(g)+H2O(g)=CO2(g)+H2(g) ∆H。①一定温度下,向10L密闭容器中充入0.5molCO和1molH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L-1·min-1。则CO的平衡转化率a= , 该反应的平衡常数K=。
②在压强不变的密闭容器中发生上述反应,设起始的 =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H0(填“>”“<”或“=”,下同)。a1,理由为。
 11. 碳族元素的单质和化合物具有非常重要的作用。请回答下列问题。(1)、碳族元素中最早用于制造半导体器件的是 (填元素名称),其价电子排布式为。(2)、CH3OH分子中C原子的杂化方式为 , SCN-的空间构型为。(3)、①烷烃(CnH2n+2)随n的增大其熔沸点升高,原因是。
11. 碳族元素的单质和化合物具有非常重要的作用。请回答下列问题。(1)、碳族元素中最早用于制造半导体器件的是 (填元素名称),其价电子排布式为。(2)、CH3OH分子中C原子的杂化方式为 , SCN-的空间构型为。(3)、①烷烃(CnH2n+2)随n的增大其熔沸点升高,原因是。②硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都很少,原因是。
(4)、如图是SiO2晶胞,构成二氧化硅晶体结构的最小环是由个原子构成。已知晶胞参数为apm,则其晶胞密度为 g·cm-3。 12. 化合物H是药物合成的种中间体,可通过以下方法合成:
12. 化合物H是药物合成的种中间体,可通过以下方法合成: (1)、B中官能团名称为。(2)、G→H的反应类型为。(3)、已知C的一种同分异构体为:
(1)、B中官能团名称为。(2)、G→H的反应类型为。(3)、已知C的一种同分异构体为: ,下列说法正确的是。
,下列说法正确的是。
a.能发生酯化反应
b.能发生银镜反应
c.1mol该物质完全水解能消耗3molNaOH
d.该分子的核磁共振氢谱中峰面积之比为1:2:6:2
e.其在酸性条件下的水解产物之一能与FeCl3溶液发生显色反应
(4)、 中手性碳原子个数为。 (5)、E的分子是为C14H17O3N,E经还原得到F,写出E→F的反应方程式:。(6)、已知:①
中手性碳原子个数为。 (5)、E的分子是为C14H17O3N,E经还原得到F,写出E→F的反应方程式:。(6)、已知:①
②苯胺(
 易被氧化
易被氧化请以甲苯和(CH3CO)2O为原料制备
 ,写出制备的合成路线流程图(无机试剂任选)。
,写出制备的合成路线流程图(无机试剂任选)。