河北省邯郸市2020年高考化学一模试卷
试卷更新日期:2021-08-04 类型:高考模拟
一、单选题
-
1. 化学与生产、生活有着密切的联系,下列有关说法正确是( )A、古代制盐(NaCl)有“东晒西煮”之说,该说法体现了古代制盐利用了水解原理 B、宋代烧制的青白瓷“光致茂美、洁白不疵”,烧制青白瓷的主要原料为黏土 C、75%的医用酒精可以灭活新型冠状病毒,是利用了乙醇的强氧化性 D、《元夕同杂宾里中观放烟火》中“百枝然火龙衔烛,七采络缨吐凤吐花”描述的是颜色反应的现象2. 设NA为阿伏加德罗常数的值,下列有关说法正确是( )A、1L0.1mol•L-1NaNO2溶液中NO2-的数目为0.1NA B、3.1g乙二醇中含有羟基的数目为NA C、5.85gNa37Cl中所含质子总数为2.8NA D、2.4g镁条在足量的由N2和O2组成的混合气体中完全燃烧时,转移的电子总数一定为0.2NA3. 关于信息素N(结构如图所示),下说列法不正确是( )
 A、至少有6个碳原子一定共平面 B、能使少量酸性高锰酸钾溶液褪色 C、分子式为C11H20O D、能发生酯化反应4. 溴乙烷是无色油状液体沸点为38.4℃,难溶于水,能溶于多种有机溶剂.以NaBr固体、C2H5OH、浓H2SO4、水为原料,对反应后的混合液微热可在烧杯中得到粗产品(溴乙烷),反应装置如图(已略去夹持和加热装置),反应原理:①NaBr+H2SO4(浓)=NaHSO4+HBr;②CH3CH2OH+HBr CH3CH2Br+H2O。下列有关说法正确是( )
A、至少有6个碳原子一定共平面 B、能使少量酸性高锰酸钾溶液褪色 C、分子式为C11H20O D、能发生酯化反应4. 溴乙烷是无色油状液体沸点为38.4℃,难溶于水,能溶于多种有机溶剂.以NaBr固体、C2H5OH、浓H2SO4、水为原料,对反应后的混合液微热可在烧杯中得到粗产品(溴乙烷),反应装置如图(已略去夹持和加热装置),反应原理:①NaBr+H2SO4(浓)=NaHSO4+HBr;②CH3CH2OH+HBr CH3CH2Br+H2O。下列有关说法正确是( ) A、烧瓶中试剂加入的先后顺序:浓硫酸、水、溴化钠、乙醇 B、可用
A、烧瓶中试剂加入的先后顺序:浓硫酸、水、溴化钠、乙醇 B、可用 装置代替倒置漏斗装置
C、冷凝水从b口进a口出
D、粗产品经水洗涤、蒸发结晶得到纯净的溴乙烷
5. 化合物M的结构如图所示,X、Y、Z、W是原子序数依次增大的短周期主族元素,其中W的核外电子数是Y的两倍。下列说法正确是( )
装置代替倒置漏斗装置
C、冷凝水从b口进a口出
D、粗产品经水洗涤、蒸发结晶得到纯净的溴乙烷
5. 化合物M的结构如图所示,X、Y、Z、W是原子序数依次增大的短周期主族元素,其中W的核外电子数是Y的两倍。下列说法正确是( ) A、简单离子的半径:W>Z>Y B、最简单氢化物的沸点:W>X>Y C、Y、W均能和Z形成两种化合物 D、W的单质不能溶于XW26. 某研究团队实现了电化学合成(又称电解合成)H2O2 , 该方法的原理如图所示,下列有关说法不正确是( )
A、简单离子的半径:W>Z>Y B、最简单氢化物的沸点:W>X>Y C、Y、W均能和Z形成两种化合物 D、W的单质不能溶于XW26. 某研究团队实现了电化学合成(又称电解合成)H2O2 , 该方法的原理如图所示,下列有关说法不正确是( )
 A、电极a为阳极,CEM为阳离子交换膜 B、该方法是一种制取H2O2的绿色方法 C、电极b上的电极反应式为O2+H+-2e-=HO2- D、通过调节通入去离子水的量可以控制流出溶液中H2O2的浓度7. 在不同温度下,水溶液中pH和pOH的关系如图所示,已知pH=-lgc(H+),pOH=-lgc(OH-)。下列说法一定正确是( )
A、电极a为阳极,CEM为阳离子交换膜 B、该方法是一种制取H2O2的绿色方法 C、电极b上的电极反应式为O2+H+-2e-=HO2- D、通过调节通入去离子水的量可以控制流出溶液中H2O2的浓度7. 在不同温度下,水溶液中pH和pOH的关系如图所示,已知pH=-lgc(H+),pOH=-lgc(OH-)。下列说法一定正确是( ) A、水的电离程度,B>A>D B、1mol•L-1Na2SO4溶液不可能处于B点 C、向C点水溶液中通入HCl,则C点变为E点 D、0.1mol•L-1NaHA溶液的pH和pOH的关系如图中E点所示,此时溶液中离子的物质的量浓度关系:c(HA-)>c(A2-)>c(H2A)
A、水的电离程度,B>A>D B、1mol•L-1Na2SO4溶液不可能处于B点 C、向C点水溶液中通入HCl,则C点变为E点 D、0.1mol•L-1NaHA溶液的pH和pOH的关系如图中E点所示,此时溶液中离子的物质的量浓度关系:c(HA-)>c(A2-)>c(H2A)二、综合题
-
8. 过二硫酸钠(Na2S2O8)也叫高硫酸钠,可用于废气处理及有害物质氧化降解.用(NH4)2S2O8溶液和一定浓度的NaOH溶液混合可制得Na2S2O8晶体,同时还会放出氨气。某化学兴趣小组利用该原理在实验室制备Na2S2O8晶体(装置如图所示).

已知:反应过程中发生的副反应为2NH3+3Na2S2O8+6NaOH 6Na2SO4+6H2O+N2
(1)、图中装有NaOH溶液的仪器的名称为 , 反应过程中持续通入氮气的目的是。(2)、(NH4)2S2O8可由电解硫酸铵和硫酸的混合溶液制得,写出电解时阳极的电极反应式:。(3)、Na2S2O8溶于水中,会发生一定程度的水解,最终仅生成H2SO4、Na2SO4和另一种常温下为液态且具有强氧化性的物质,写出该反应的化学方程式:。(4)、Na2S2O8具有强氧化性,该兴趣小组设计实验探究不同环境下Na2S2O8氧化性的强弱。将MnSO4•H2O(1.69g)与过量Na2S2O8(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如表格所示)。环境
调节溶液氧化环境时的现象
加热煮沸3min期间产生的现象
中性
加入VmL蒸馏水,无明显现象
30s时开始有大量气泡冒出,3min后溶液变深棕色,溶液中有悬浮小颗粒
碱性
加入VmL某浓度的NaOH溶液,瞬间变为棕色(MnO2)
10s后溶液逐渐变为深紫色(MnO4-),没有明显冒气泡现象
酸性
加入VmL稀H2SO4无明显现象
煮沸3min后,有气泡冒出
①在(填“中性”“酸性”或“碱性”)条件下,Na2S2O8的氧化能力最强。
②中性氧化时,会产生大量气泡,其原因为。
③若用0.1mol•L-1的H2O2溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为;达到滴定终点时,消耗H2O2溶液的体积为V1rnL。则碱性氧化后的溶液中NaMnO4的质量为 g(用含V1的代数式表示,5H2O2~2 )。
9. 锡酸钠晶体(Na2SnO3•3H2O2)在染料工业用作媒染剂。以锡渣废料(主要成分是SnO,还含有少量Fe、Te、Sb、Pb、As等元素的氧化物)为原料,制备锡酸钠晶体的工艺流程图如图:
已知:水碎液中溶质的主要成分为Na2SnO3、Na3AsO4、Na3SbO4、Na2PbO2、Na2TeO3。
(1)、“碱溶”时,SnO发生反应的化学方程式为。(2)、工业上制备锡酸钠晶体(Na2SnO3•3H2O)时,会将“水碎渣”再次水洗,其目的是。(3)、“除Sb”时发生反应的离子方程式为。(4)、“除Te”过程中氧化剂与还原剂的物质的量之比为 , 该过程中反应时间、反应温度对Te的脱除率的影响关系如图,则70℃后随温度升高Te的脱除率下降的原因可能是;“除Te”的最优反应时间和反应温度分别为、。 (5)、已知锡酸钠的溶解度一般随着温度的升高而升高,则在“浓缩、结晶”时,加入NaOH的原因是。10. 甲醇制氢作为一种绿色能源技术备受关注。(1)、I.甲醇裂解制氢法
(5)、已知锡酸钠的溶解度一般随着温度的升高而升高,则在“浓缩、结晶”时,加入NaOH的原因是。10. 甲醇制氢作为一种绿色能源技术备受关注。(1)、I.甲醇裂解制氢法该方法的主反应:CH3OH(g) CO(g)+2H2(g) △H1>0此反应能自发进行的原因是。
(2)、一定温度下,向某一刚性恒容密闭容器中充入CH3OH(g),发生反应CH3OH(g) CO(g)+2H2(g),反应起始时CH3OH(g)的压强为5.00MPa,t h后反应达到平衡,此时H2的物质的量分数为60%,则0~t h内的平均反应速率v(CO)=MPa•h-1 , CH3OH的平衡转化率α(CH3OH)= , 此时平衡常数Kp=(Kp为以平衡分压表示的平衡常数)。(3)、科研人员通过计算机模拟用Pd(III)催化甲醇裂解的反应机理,得到附着在Pd(III)表面上甲醇变换的反应历程图[如图1,附在Pd(III)表面的物种用*标注],此历程中活化能最小的反应方程式为。 (4)、II.甲醇水蒸气重整制氢法
(4)、II.甲醇水蒸气重整制氢法该方法的部分反应如下:
主反应:CH3OH(g)+H2O(g) CO2(g)+3H2(g) △H2=+49kJ•mol-1
副反应:H2(g)+CO2(g) CO(g)+H2O(g) △H3=-41kJ·mol-1
①相同条件下,甲醇水蒸气重整制氢法与甲醇裂解制氢法相比较,从经济效益和绿色化学角度分析,前者先进之处在于。
②在某催化剂的作用下,在相同时间内,不同温度下测得CH3OH的转化率、CO的生成率与温度的变化关系如图2所示。

随着温度的升高,CH3OH实际反应转化率不断接近平衡状态转化率的原因是(填字母)。
A.主反应的活化能降低
B.主反应的反应速率增大
C.CH3OH的平衡转化率降低
随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是。为提高CH3OH的转化率且使副反应不向正反应方向进行,可采取的措施有(任写一条)。
11. KMnO4(s)受热分解制备氧气是实验室制氧气的常用方法,它也是一种高效氧化剂,是氧化还原滴定实验中常用的试剂,可以作为标准溶液滴定一些具有还原性的物质(Fe2+、C2O42-等)的溶液,如5C2O42-+2MnO4-+l6H++4H2O=2[Mn(H2O)6]2++10CO2↑。(1)、基态Mn2+的核外电排布式为。(2)、如果在空气中焙烧KMnO4 , 可获得Mn3O4(可改写为MnO•Mn2O3),则Mn3O4中Mn的化合价为。(3)、石墨烯(如图A)是一种由碳原子组成六边形呈蜂巢晶格的二维碳纳米材料,当石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图B)。
石墨烯结构中1号C的杂化方式为;该C与相邻的两个C形成的键角(填“>”“<”“=”)120°。氧化石墨烯结构中1号C与相邻C(填“有”或“没有”)形成π键。
(4)、铁形成的晶体类型因为铁原子排列方式的不同而不同,其中一种晶胞结构如图所示。晶体中铁原子周围距离最近且等距的铁原子数为。形成铁碳合金时,存在一种碳原子插入到晶胞中每条棱的中点和晶胞的体心的结构,该物质的化学式为;设NA为阿伏加德罗常数的值,该铁碳晶胞的晶胞参数为apm,则C原子间的最短距离为pm,该铁碳晶胞的密度为 g•cm-3。 12. 有机化合物H(根皮素)是一种新型天然皮肤美白剂,H的一种合成路线如图:
12. 有机化合物H(根皮素)是一种新型天然皮肤美白剂,H的一种合成路线如图:
已知:
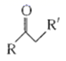
 +H2O
+H2O回答下列问题:
(1)、A的化学名称是 , E中官能团的名称为。(2)、由B生成C和由C生成D的反应类型分别为、。(3)、H的分子式为。(4)、E→G的化学方程式为。(5)、M是D的同分异构体,同时符合下列条件的M的结构有种(不考虑立体异构)。①能与FeCl3溶液发生显色反应②能发生银镜反应
其中核磁共振氢谱有5组峰,且峰面积之比为1:2:2:2:1的M的结构简式为。
(6)、设计以2-氯丙烷和1,3-丙二醛为起始原料制备 的合成路线(无机试剂及溶剂任选)。
的合成路线(无机试剂及溶剂任选)。