高中化学人教版(2019)必修第一册第四章第一节 原子结构与元素周期表
试卷更新日期:2021-08-03 类型:同步测试
一、单选题
-
1. 科学家根据 与 的比例,为月球起源的假说提供证据。 与 具有相同的( )A、核外电子排布 B、质量数 C、中子数 D、质量2. 第75号元素铼是广泛用于航空发动机涡轮叶片的稀土元素。从信息中不能获取的是( )A、质量数 B、周期表中位置 C、质子数 D、核外电子排布3. 下列说法错误的是( )A、“溴”被称为“海洋元素” B、氯原子的结构示意图:
 C、 、 表示2种核素
D、透闪石 用氧化物的形式表示为:2CaO∙5MgO∙8SiO2∙H2O
4. 同位素有广泛的用途,如13C呼气法在医学上常用于幽门螺旋杆菌的诊断。下列说法正确的是( )A、13C的核外电子数是6 B、13C的摩尔质量是13 C、13C与14N的中子数不同 D、13C与14N的质子数相同5. 据探测月球土壤中吸附着数百万吨可作为核聚变材料的
C、 、 表示2种核素
D、透闪石 用氧化物的形式表示为:2CaO∙5MgO∙8SiO2∙H2O
4. 同位素有广泛的用途,如13C呼气法在医学上常用于幽门螺旋杆菌的诊断。下列说法正确的是( )A、13C的核外电子数是6 B、13C的摩尔质量是13 C、13C与14N的中子数不同 D、13C与14N的质子数相同5. 据探测月球土壤中吸附着数百万吨可作为核聚变材料的 。下列有关
。下列有关  的说法正确的是:( ) A、质量数为2 B、质子数为2 C、质子数为3 D、质量数为16. X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是( )A、X、Y生成H2的物质的量之比一定为 B、X、Y消耗酸的物质的量之比一定为 C、产物中X、Y化合价之比一定为 D、由 一定能确定产物中X、Y的化合价7. 已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如下所示,其中Y的最高化合价为+3。下列说法不正确的是( )
的说法正确的是:( ) A、质量数为2 B、质子数为2 C、质子数为3 D、质量数为16. X、Y均为短周期金属元素,同温同压下,0.1molX的单质与足量稀盐酸反应,生成H2体积为V1L;0.1molY的单质与足量稀硫酸反应,生成H2体积为V2L。下列说法错误的是( )A、X、Y生成H2的物质的量之比一定为 B、X、Y消耗酸的物质的量之比一定为 C、产物中X、Y化合价之比一定为 D、由 一定能确定产物中X、Y的化合价7. 已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如下所示,其中Y的最高化合价为+3。下列说法不正确的是( ) A、还原性: B、X能从 中置换出Z C、Y能与 反应得到Fe D、M最高价氧化物的水化物能与其最低价氢化物反应8. 铍(4Be)的右下角元素是铝,根据“对角线规则”,下列描述错误的( )A、BeO是两性氧化物 B、已知AlCl3是共价化合物,则BeCl2也可能是共价化合物 C、Be(OH)2既能与H2SO4溶液反应也能与NaOH溶液反应 D、Be(OH)2与NaOH溶液反应后生成NaBeO2和H2O9. 利用高聚物PVDF(如图)为基质可以制取高分子膜、固体电解质,在污水处理及电池制造中应用广泛。短周期元素X、Y、Z原子序数依次增大,已知X原子核内不含中子,Y原子最外层电子数是电子层数的2倍,元素Z在化合物中不显正价。下列叙述错误的是( )
A、还原性: B、X能从 中置换出Z C、Y能与 反应得到Fe D、M最高价氧化物的水化物能与其最低价氢化物反应8. 铍(4Be)的右下角元素是铝,根据“对角线规则”,下列描述错误的( )A、BeO是两性氧化物 B、已知AlCl3是共价化合物,则BeCl2也可能是共价化合物 C、Be(OH)2既能与H2SO4溶液反应也能与NaOH溶液反应 D、Be(OH)2与NaOH溶液反应后生成NaBeO2和H2O9. 利用高聚物PVDF(如图)为基质可以制取高分子膜、固体电解质,在污水处理及电池制造中应用广泛。短周期元素X、Y、Z原子序数依次增大,已知X原子核内不含中子,Y原子最外层电子数是电子层数的2倍,元素Z在化合物中不显正价。下列叙述错误的是( ) A、元素Z的氢化物是一种弱酸 B、元素X是宇宙中含量最丰富的元素 C、上述高聚物具有良好的耐化学腐蚀性、耐氧化性等优点 D、形成上述高聚物的单体分子中各原子最外层均满足8电子稳定结构10. 已知X、Y、Z、W是四种原子序数依次增大的短周期元素,其中只有W是金属。X、Z是人体中含量最高的物质的两种组成元素,Y与Z处于相邻位置。则下列说法中正确的是( )A、由W、Y、Z三种元素组成的盐的水溶液一定是中性的 B、X和Y的单质之间的化合反应不需要任何条件即可发生 C、X、Z、W组成的化合物可能不溶于水 D、W的氢氧化物一定是强碱11. 1919年卢瑟福在核反应中用 粒子(即氦核轰击短周期非金属 原子,得到核素 和一新的粒子M,其过程为: 。其中元素X、Y、M的质子数之和为16,下列说法正确的是( )A、粒子M中含有1个中子 B、最简单氢化物的还原性:X<Y C、 中所有原子均为8电子稳定结构 D、X和Y只能形成两种化合物12. 2020年12月17日,嫦娥五号返回器携带月球土壤样品着陆地球,实现了中国首次月球无人采样返回,助力月球成因和演化历史等科学研究。2021年2月22日,嫦娥五号带回的月壤在人民大会堂首次公开亮相。据科学家预测,月球的土壤中吸附着数百万吨的3He,而在地球上元素则主要以4He的形式存在。下列说法正确的是( )A、4He原子核内含有4个质子 B、3He与4He互为同位素 C、3He与4He的电子数不同 D、4He的最外层电子数为2,故4He易失去最外层电子13. 已知A的原子序数是x,B-与A3+具有相同的电子层结构,则B元素的原子序数为( )A、x+4 B、x-4 C、x+1 D、x-114. 阴离子Xn-含中子N个,X的质量数为A,则agX的氢化物中含质子的物质的量是( )A、 (N-a)mol B、 (n+A)mol C、 (N+n)mol D、 (A-N+n)mol15. 2020年12月17日,嫦娥五号返回器携带2公斤月壤返回地球。经分析,月壤中吸附大量的 , 是清洁、安全和高效的核聚变发电的燃料,地球上氦元素则主要以 形式存在。下列说法正确的是( )A、 的核外电子数为3 B、 和 互为同位素 C、 发生核聚变时吸收大量能量 D、 化学性质非常活泼16. X、Y、Z均为元素周期表中前20号元素,Xa+、Yb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )A、已知mXa+与nYb- , 得m+a=n-b B、离子半径:Yb->Z(b+1)->Xa+ C、Z(b+1)-的还原性一定大于Yb- D、气态氢化物的稳定性Hb+1Z一定大于HbY
A、元素Z的氢化物是一种弱酸 B、元素X是宇宙中含量最丰富的元素 C、上述高聚物具有良好的耐化学腐蚀性、耐氧化性等优点 D、形成上述高聚物的单体分子中各原子最外层均满足8电子稳定结构10. 已知X、Y、Z、W是四种原子序数依次增大的短周期元素,其中只有W是金属。X、Z是人体中含量最高的物质的两种组成元素,Y与Z处于相邻位置。则下列说法中正确的是( )A、由W、Y、Z三种元素组成的盐的水溶液一定是中性的 B、X和Y的单质之间的化合反应不需要任何条件即可发生 C、X、Z、W组成的化合物可能不溶于水 D、W的氢氧化物一定是强碱11. 1919年卢瑟福在核反应中用 粒子(即氦核轰击短周期非金属 原子,得到核素 和一新的粒子M,其过程为: 。其中元素X、Y、M的质子数之和为16,下列说法正确的是( )A、粒子M中含有1个中子 B、最简单氢化物的还原性:X<Y C、 中所有原子均为8电子稳定结构 D、X和Y只能形成两种化合物12. 2020年12月17日,嫦娥五号返回器携带月球土壤样品着陆地球,实现了中国首次月球无人采样返回,助力月球成因和演化历史等科学研究。2021年2月22日,嫦娥五号带回的月壤在人民大会堂首次公开亮相。据科学家预测,月球的土壤中吸附着数百万吨的3He,而在地球上元素则主要以4He的形式存在。下列说法正确的是( )A、4He原子核内含有4个质子 B、3He与4He互为同位素 C、3He与4He的电子数不同 D、4He的最外层电子数为2,故4He易失去最外层电子13. 已知A的原子序数是x,B-与A3+具有相同的电子层结构,则B元素的原子序数为( )A、x+4 B、x-4 C、x+1 D、x-114. 阴离子Xn-含中子N个,X的质量数为A,则agX的氢化物中含质子的物质的量是( )A、 (N-a)mol B、 (n+A)mol C、 (N+n)mol D、 (A-N+n)mol15. 2020年12月17日,嫦娥五号返回器携带2公斤月壤返回地球。经分析,月壤中吸附大量的 , 是清洁、安全和高效的核聚变发电的燃料,地球上氦元素则主要以 形式存在。下列说法正确的是( )A、 的核外电子数为3 B、 和 互为同位素 C、 发生核聚变时吸收大量能量 D、 化学性质非常活泼16. X、Y、Z均为元素周期表中前20号元素,Xa+、Yb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )A、已知mXa+与nYb- , 得m+a=n-b B、离子半径:Yb->Z(b+1)->Xa+ C、Z(b+1)-的还原性一定大于Yb- D、气态氢化物的稳定性Hb+1Z一定大于HbY二、多选题
-
17. 今年是门捷列夫发现元素周期律150周年,联合国将2019年定为“国际化学元素周期表年”。下列有关化学元素周期表的说法正确的是( )A、元素周期表共有18列 B、ⅦA 族元素的非金属性自上而下依次减弱 C、主族元素均呈现与其族数相同的最高化合价 D、第二周期主族元素的原子半径自左向右依次增大18. X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是( )A、X、Y、Z、W四种元素都位于元素周期表的p区 B、Z元素的离子半径大于W元素的离子半径 C、Z元素的单质在一定条件下能与X元素的单质反应 D、Y元素最高价氧化物的晶体具有很高的熔点和沸点
三、填空题
-
19. 短周期元素A,B,C在周期表中的位置关系如图所示,A,C两元素的原子核外电子数之和等于B原子的质子数则:A,B,C的元素符号分别是、、。
 20. 在短周期元素中:原子核外电子总数是其最外层电子数2倍的元素是 , 原子电子层数和核外最外层电子数相等的元素是 , 最外层电子数为电子层2倍的元素是。21. 画出下列元素的原子结构示意图。
20. 在短周期元素中:原子核外电子总数是其最外层电子数2倍的元素是 , 原子电子层数和核外最外层电子数相等的元素是 , 最外层电子数为电子层2倍的元素是。21. 画出下列元素的原子结构示意图。①核电荷数为13的元素:。
②某元素原子的最外层电子数等于次外层电子数: 。
③L 层电子数是M层电子数2倍的元素: 。
四、综合题
-
22. 元素周期表的一部分如图所示。回答下列问题:
 (1)、X的原子结构示意图为 , 其最简单氢化物的电子式为。(2)、Y 元素位于元素周期表中第周期族。(3)、Z、Y 最简单氢化物热稳定性由强到弱的顺序为(填化学式)。(4)、W 的最高价氧化物对应水化物的化学式为 , 该水化物中含有(填“共价键”、“离子键”)。(5)、用电子式表示 WY 的形成过程:。23. 元素周期表是学习化学的重要工具,如图为元素周期表中部分元素的相关信息,利用如图回答相关问题。
(1)、X的原子结构示意图为 , 其最简单氢化物的电子式为。(2)、Y 元素位于元素周期表中第周期族。(3)、Z、Y 最简单氢化物热稳定性由强到弱的顺序为(填化学式)。(4)、W 的最高价氧化物对应水化物的化学式为 , 该水化物中含有(填“共价键”、“离子键”)。(5)、用电子式表示 WY 的形成过程:。23. 元素周期表是学习化学的重要工具,如图为元素周期表中部分元素的相关信息,利用如图回答相关问题。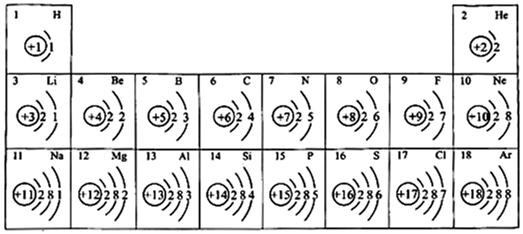 (1)、原子序数为4的元素符号为。(2)、C、N、O排在同一周期是因为(填“质子数”“电子层数”或“最外层电子数”)相同。(3)、He和Mg的化学性质(填“相似”或“不相似”)。(4)、画出Na+的结构示意图。(5)、一个磷原子含有个质子,一个NH 含有个电子。24. 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。(1)、硒在元素周期表中的位置如图所示:
(1)、原子序数为4的元素符号为。(2)、C、N、O排在同一周期是因为(填“质子数”“电子层数”或“最外层电子数”)相同。(3)、He和Mg的化学性质(填“相似”或“不相似”)。(4)、画出Na+的结构示意图。(5)、一个磷原子含有个质子,一个NH 含有个电子。24. 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取硒。(1)、硒在元素周期表中的位置如图所示:

①Se在元素周期表中位置表示为 , H2Se的电子式为
②从原子结构角度解释硫与硒元素性质相似与不同的原因:同一主族。
(2)、阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:ⅰ.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ⅱ.用水吸收ⅰ中混合气体,可得Se固体
①请写出C与浓H2SO4反应的化学方程式。
②焙烧过程产生的烟气中含有少量SeO2的,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为。
③ 写出步骤ⅱ中的化学方程式。
(3)、下列说法合理的是。a.SeO2既有氧化性又有还原性 b.原子半径由大到小顺序:Se>Br>Cl
c.热稳定性:H2Se<HCl<H2S d.酸性:HeSeO4<HbrO4<HClO4
五、推断题
-
25. 下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答下列问题。
ⅠA
0
1
①
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
②
③
Ne
3
④
Mg
⑤
P
⑥
⑦
(1)、⑦、②两者核电荷数之差是。(2)、①~⑦七种元素中原子半径最大的是(填元素符号)。(3)、②、⑥、⑦三种元素的最高价氧化物的水化物酸性最强的是(填化学式)。(4)、①、②两种元素可形成多种化合物,其中化合物A的产量是衡量一个国家石油化工发展水平的标志,写出化合物A与⑦元素单质反应的化学方程式 , 其反应类型属于。26. A,B,C,D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。 请回答下列问题: (1)、D的化学式为 。(2)、反应③的离子方程式为 。(3)、Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
(1)、D的化学式为 。(2)、反应③的离子方程式为 。(3)、Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。