高中化学人教版(2019)必修第一册第三章实验活动2 铁及其化合物的性质
试卷更新日期:2021-08-03 类型:同步测试
一、单选题
-
1. 下列实验操作、现象和所得结论都正确的是( )
选项
实验
现象
结论
A
向滴有酚酞的 Na2CO3 溶液中加入少量氯化钡固体,振荡
溶液红色变浅
Na2CO3溶液存在水解平衡
B
向X溶液中滴加几滴新制氯水,振 荡 ,再加入少量KSCN溶液
溶液变为红色
X溶液中一定含有Fe2+
C
检验食盐是否加碘( KIO3), 取少量食盐溶于水,用淀粉碘化钾试纸检验
试纸不变蓝
该食盐不含有KIO3
D
向蛋白质溶液中加入CuSO4或( NH4)2 SO4 的饱和溶液
均有沉淀生成
蛋白质均发生了盐析
A、A B、B C、C D、D2. 下列实验操作、现象及结论都正确的是( )选项
实验操作
现象
结论
A
将Fe(NO3)2样品溶于足量的H2SO4溶液中,再滴加少量的KSCN溶液
溶液不变红
溶液中一定没有Fe3+
B
向滴加酚酞的氨水中加蒸馏水稀释
溶液红色变浅
溶液中所有离子浓度均减小
C
向Na2CO3稀溶液中逐滴滴入同浓度、同体积的水杨酸(
 )溶液,边滴加边振荡
)溶液,边滴加边振荡无气体产生
电离常数:K1(碳酸)>K2(水杨酸)
D
取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液
无淡黄色沉淀
CH3CH2Br没有水解
A、A B、B C、C D、D3. 某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4.某实验小组以该废催化剂为原料,回收锌和铜,设计实验流程如图:
下列说法错误的是( )
A、步骤①操作中,生成的气体可用CuSO4溶液吸收 B、检验滤液1中是否含有Fe2+ , 可以选用KSCN和新制的氯水 C、步骤②操作中,应先加1.0mol·L-1H2SO4 , 然后不断搅拌下缓慢加入6%H2O2 D、滤渣1中含有SiO2 , 滤渣2中含有S和SiO24. 图示的实验或操作正确的是( )A
B
C
D
熔化NaOH
制取少量
萃取振荡时放气
分离甲苯和水
A、A B、B C、C D、D5. 室温下进行下列实验,根据实验操作、现象和所得到的实验结论均正确的是( )选项
实验操作和现象
实验结论
A
常温下,用pH计测定等物质的量浓度的NaHCO3、NaClO4两种盐溶液的pH,测得NaHCO3的pH大于NaClO4
非金属性:Cl>C
B
向含有Na+、K+、NO 、SO 的溶液中逐滴滴加盐酸,立即产生气泡
SO 和H+反应产生SO2气体
C
向某溶液中滴加氯水后在滴加KSCN溶液,溶液呈红色
溶液中一定含有Fe3+
D
向2mL 0.1mol/L Na2S溶液中滴入2mL0.1mol/LZnSO4溶液,再加入几滴0.1mol/L CuSO4溶液。开始有沉淀产生,后有黑色沉淀生成
Ksp(CuS)>Ksp(ZnS)
A、A B、B C、C D、D6. 下列实验操作或装置能达到实验目的的是( ) A、用甲装置测定0.1mol·L-1KClO溶液的pH B、用乙装置制备纯净干燥的Cl2 C、用丙装置验证蔗糖与浓硫酸反应产生SO2 D、用丁装置可检验FeSO4溶液中的Fe2+是否被氧化7. 下列化学实验操作、现象和结论均正确的是( )
A、用甲装置测定0.1mol·L-1KClO溶液的pH B、用乙装置制备纯净干燥的Cl2 C、用丙装置验证蔗糖与浓硫酸反应产生SO2 D、用丁装置可检验FeSO4溶液中的Fe2+是否被氧化7. 下列化学实验操作、现象和结论均正确的是( )选项
操作
现象
结论
A
将苯与液溴反应产生的气体通入AgNO3溶液中
AgNO3溶液中出现淡黄色沉淀
证明苯与液溴发生了取代反应
B
向Al与Fe2O3反应后的固体产物中先加稀硫酸溶解,再加入几滴KSCN溶液
溶液不变红
无法证明反应后固体产物中是否含有Fe2O3
C
向H2O2溶液中加入几滴FeCl3溶液
溶液中产生气泡
发生的离子反应为:2Fe3++H2O2=O2↑+2Fe2++2H+
D|
向淀粉溶液中加入适量20%H2SO4溶液,加热,冷却后加NaOH溶液至碱性,再滴加少量碘水
溶液未变蓝
淀粉已完全水解
A、A B、B C、C D、D8. 下列有关实验错误的是( )A、中和反应反应热的测定,需要准确读取酸碱溶液混合后的最高温度 B、将4.0g NaOH置于100mL容量瓶中,加水配制1.000mo/LNaOH溶液 C、除去甲烷中的乙烯,可以依次通过酸性KMnO4溶液、NaOH溶液、浓H2SO4 D、探究Fe2+能转化为Fe3+ , 可以向FeCl2溶液中依次滴加KSCN溶液、氯水9. 下列实验操作、现象及结论正确的是( )选项
实验
操作、现象及结论
A
探究Na2O2与水反应
将2mL水滴入盛有1g过氧化钠试管中,立即把带火星木条伸入试管,木条复燃,证明有氧气产生
B
鉴别NaHCO3与Na2CO3
取少许两种物质,加入几滴水,插入温度计,温度降低的是Na2CO3
C
检验Fe3+中是否含Fe2+
向溶液中加入KSCN溶液,变红则含Fe2+
D
检验溶液中是否含Cl-
向某溶液中加入盐酸酸化的AgNO3溶液,有白色沉淀,说明含有Cl-
A、A B、B C、C D、D10. 下列“实验结论”与“实验操作及现象”不相符的一组是( )选项
实验操作及现象
实验结论
A
向某溶液中加入足量稀盐酸,无明显现象;再加入 溶液,有白色沉淀产生
原溶液中一定含有
B
某溶液中滴加 溶液,无明显现象;再滴加氯水,溶液呈红色
原溶液一定含
C
向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的气体
该溶液中一定含有
D
向某溶液中加入浓 溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体
该溶液中一定含有
A、A B、B C、C D、D11. 下列实验中,依据实验操作及现象,得出的结论正确的是( )操 作
现 象
结 论
A
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
B
将稀硝酸加入过量铁粉中,充分反应后再滴加KSCN溶液
有气体生成,溶液不呈血红色
稀硝酸将Fe氧化为Fe2+
C
向蔗糖中加入浓硫酸
蔗糖变成疏松多孔的海绵状炭
浓硫酸具有吸水性
D
向5 mL KI溶液中加入1 mL相同浓度FeCl3溶液,充分反应后滴入KSCN溶液
溶液变血红色
KI与FeCl3的反应有一定限度
A、A B、B C、C D、D12. 下列说法正确的有( )①向沸水中逐滴加入少量饱和 溶液,可制得 胶体
②用pH试纸测得氯水的
③除去 气体中的 ,可将气体通入饱和食盐水中
④ 能与 溶液、 溶液反应,所以 是两性氧化物
⑤铅酸蓄电池放电时的正极电极反应为
⑥由 可推出
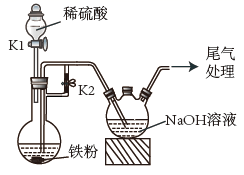
A、6个 B、3个 C、4个 D、2个13. 某兴趣小组探究 SO2 气体还原 Fe3+ , 他们使用的药品和装置如下图所示,下列说法不合理的是( ) A、B 中现象为溶液蓝色褪去 B、装置 C 的作用是吸收 SO2 尾气,防止污染空气 C、为了验证 A 中发生了氧化还原反应,加入 KMnO4 溶液,紫红色褪去 D、反应后,A 中溶液的酸性增强14. 下列物质反应后一定有+3价铁生成的是( )
A、B 中现象为溶液蓝色褪去 B、装置 C 的作用是吸收 SO2 尾气,防止污染空气 C、为了验证 A 中发生了氧化还原反应,加入 KMnO4 溶液,紫红色褪去 D、反应后,A 中溶液的酸性增强14. 下列物质反应后一定有+3价铁生成的是( )①过量的Fe在Cl2中燃烧;②Fe和过量盐酸反应;③向FeCl2溶液中通入少量Cl2;④将Fe和Fe2O3的混合物溶于盐酸中
A、① B、①③ C、①②③ D、①②③④15. 下列实验操作和现象、结论或目的均正确的是( )选项
操作和现象
结论或目的
A
将饱和的 溶液滴加到浓 溶液中
制备 胶体
B
向钠与水反应形成的溶液中滴加几滴酚酞,溶液变红
钠与水反应生成了碱
C
向 溶液中加入一小块钠,生成气体和沉淀
沉淀为
D
向某溶液中通入 ,再加入 溶液,溶液变红色
原溶液中一定含有
A、A B、B C、C D、D16. 下列各图示中能较长时间看到 Fe(OH)2白色沉淀的是( )(已知:苯为难溶于水且密度比水小的液体)



 A、①②③ B、①②④ C、①③④ D、②③④17. 下列离子检验操作、结论均合理的是( )A、用AgNO3溶液检验Cl-时,先加入适量稀盐酸以排除CO32-干扰 B、某溶液中滴加KSCN溶液呈红色,说明不含Fe2+ C、某溶液中滴加氯水后再滴加KSCN溶液呈红色,说明原溶液含有Fe3+ D、某无色溶液中滴加氯水后溶液呈棕色,再滴加淀粉溶液显蓝色,说明原溶液中含有I-18. 欲进行下列实验,其方案设计合理的是( )
A、①②③ B、①②④ C、①③④ D、②③④17. 下列离子检验操作、结论均合理的是( )A、用AgNO3溶液检验Cl-时,先加入适量稀盐酸以排除CO32-干扰 B、某溶液中滴加KSCN溶液呈红色,说明不含Fe2+ C、某溶液中滴加氯水后再滴加KSCN溶液呈红色,说明原溶液含有Fe3+ D、某无色溶液中滴加氯水后溶液呈棕色,再滴加淀粉溶液显蓝色,说明原溶液中含有I-18. 欲进行下列实验,其方案设计合理的是( ) A、图1为制备Fe(OH)2 B、图2为比较Na2CO3和NaHCO3的稳定性 C、图3为验证SO2的还原性 D、图4为验证Cl2具有漂白性19. 固体X可能含有Cu、Fe2O3、Na2SO3、(NH4)2SO4、KNO3中的几种。进行如下实验:
A、图1为制备Fe(OH)2 B、图2为比较Na2CO3和NaHCO3的稳定性 C、图3为验证SO2的还原性 D、图4为验证Cl2具有漂白性19. 固体X可能含有Cu、Fe2O3、Na2SO3、(NH4)2SO4、KNO3中的几种。进行如下实验:
下列说法正确的是( )
A、X中含有Fe2O3、(NH4)2SO4 , 可能含有Cu、KNO3、Na2SO3 B、白色沉淀一定含有BaSO4 , 可能含有BaSO3 C、若乙是有色气体,则X中含有KNO3 D、取少许溶液丙,加入KSCN,如果出现血红色,则X中不含Cu二、多选题
-
20. 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器)( )
实验目的
玻璃仪器
试剂
A
配制100mL一定物质的量浓度的NaCl溶液
100mL容量瓶、胶头滴管、烧杯、量筒、玻璃棒
蒸馏水、NaCl固体
B
制备Fe(OH)3胶体
烧杯、酒精灯、胶头滴管
蒸馏水、饱和FeCl3溶液
C
测定NaOH溶液浓度
烧杯、锥形瓶、胶头滴管、酸式滴定管
待测NaOH溶液、已知浓度的盐酸、甲基橙试剂
D
制备乙酸乙酯
试管、量筒、导管、酒精灯
冰醋酸、无水乙醇、饱和Na2CO3溶液
A、A B、B C、C D、D21. 根据下列实验操作和现象所得结论正确的是( )选项
实验操作和现象
实验结论
A
在小烧杯中滴有少量水,加入20gBa(OH)2·8H2O晶体和10gNH4Cl晶体,用玻璃棒快速搅拌并触摸烧杯外壁,发现烧杯外壁很冷
Ba(OH)2·8H2O与NH4Cl的反应为吸热反应
B
将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红
Fe(NO3)2已变质
C
用3mL稀盐酸与过量Zn反应,当气泡稀少时,加入1mL浓盐酸,又迅速产生较多气泡
盐酸浓度增大,反应速率加快
D
向5mL0.1mol·L-1FeCl3溶液中滴入0.1 mol·L-1KI溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,溶液变红
Fe3+与I-的反应有一定限度
A、A B、B C、C D、D22. 下列关于Fe(OH)2的制备能够成功的是( )A、向FeCl2溶液中逐滴加入NaOH溶液 B、向FeSO4溶液中逐滴加入氨水 C、先将装有NaOH溶液的长滴管插入FeSO4溶液液面下,再挤出NaOH溶液可制得Fe(OH)2白色沉淀 D、取适量新配制的FeSO4溶液于试管中,再加入一层植物油(密度小于水,且不溶于水),然后向试管内逐滴加入NaOH溶液三、填空题
-
23.
用下面两种方法均可制得Fe(OH)2白色沉淀.
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入 .
(2)除去蒸馏水中溶解的O2常采用 的方法.
(3)制取Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.这样操作的理由是:防止发生反应 .(填化学方程式)
方法二 在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备.
(4)在试管Ⅰ里加入的试剂是 .
(5)为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 .
 24.
24.在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2 .
(1)在试管I中加入的试剂是 .
(2)为了制得Fe(OH)2白色沉淀,在试管I和Ⅱ中加入试剂,打开止水夹,塞紧塞子后观察到试管I产生大量气体.一段时间后,检验到试管Ⅱ支管出口的气体只有一种时,再进行的操作是 ,使试管I中的溶液进入到试管Ⅱ中溶液底部,产生Fe(OH)2 .
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 .
(4)反应结束后,将Fe(OH)2沉淀倒出,在空气中迅速变为灰绿色,最后变为红褐色,其原因是 (用化学方程式表示).

四、实验探究题
-
25. 打印机墨粉中的 含量是衡量墨粉质量优劣的重要指标之一、已知:墨粉中除了 晶体粉粒外,其余成分均不溶于水且不与酸反应。
为测定墨粉中 的含量,进行了如下实验:

完成下列填空:
(1)、检验第一份取少许,选用(填试剂名称),现象是。
(2)、测定 含量方法一
已知:
①试剂①是 ,加入足量 反应后,还需要充分加热,充分加热的目的是。
②试剂②是(填名称),其作用是。
(3)、测定 含量方法二
已知:
①试剂③是Zn粉,向第三份溶液中缓慢加入Zn粉末,当观察到较多气泡产生时,即停止加入Zn粉,写出该过程中发生的离子方程式 , 这样操作的原因是。
②用第三份实验数据计算墨粉中的 的含量。(只列计算式,不计算)
③试剂③不能用铁粉,可能的原因是。
26. 研究发现,NO在心脑血管调节、免疫调节等方面有着十分重要的作用,但NO无法直接作为药物使用。科学家发现NO 有着与NO相似的功效,可以用作药物。某研究小组对亚硝酸盐转化为NO的反应进行了研究。(1)、NO中N元素的化合价呈现正价,用原子结构解释原因为。(2)、为研究NO 的转化,甲同学完成了如下实验:实验方案
实验现象

i.溶液先变黄色,迅速变为棕色
ii.将棕色溶液加热,颜色变浅,冷却
资料:FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0
在冷却后的溶液中滴加(填“试剂和现象”),说明有Fe3+生成。从而证明Fe2+可以还原NO 。
(3)、乙同学认为甲同学的实验方案不严谨,其理由是。并进一步利用下列实验装置进行实验,以验证甲同学的实验结论是正确的。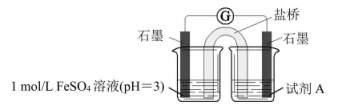
①右侧烧杯中试剂A是。
②实验证据是。
(4)、写出NaNO2溶液与FeSO4溶液反应的离子方程式。(5)、解释“棕色溶液加热,颜色变浅”的原因是。(6)、研究表明,亚硝酸盐能够被人体内含Fe2+等的还原性酶还原为NO,NO的生物学作用揭示着无机分子在医学领域中的重要作用,它与血红素铁具有很高的亲合力,以取代O2的位置。因此,亚硝酸盐作为药物使用时,必须严格控制剂量。若服用过量,可能会产生的影响是。27. 蛭石是一种铝硅酸盐(不溶于稀酸、碱),加热后体积会增大为原体积的60倍,具有理想的保温及涵水功能,是种植业的优良基质材料。一种“暖宝宝”内充Fe粉、蛭石粉、活性炭、NaCl固体和吸水性树脂,使用时去掉不透气的外包装使透气内袋暴露在空气中,即可发热至53℃左右。某化学兴趣小组设计了以下实验,探究已使用过的“暖宝宝”成分、回收蛭石,并制备“引火铁”(一种抛撒到空气中即可自燃的超细铁粉)。(实验方案)

(实验装置)(制引火铁)

回答下列问题:
(1)、在“暖宝宝”的使用过程中,蛭石粉的作用是。影响“暖宝宝”发热的持续时间和温度的主要因素是。(2)、“实验方案”中“操作A”的具体内容为。(3)、有关使用后的“暖宝宝”中铁元素的存在形式,下列说法正确的是_______。A、一定含有Fe、Fe2+、Fe3+ B、一定含Fe3+ C、一定含有Fe2+、Fe3+ D、可能含Fe(4)、制引火铁的“实验装置”中有两处明显的缺陷,分别是和。(5)、制取CO时,浓硫酸的作用是。实验开始时,应先点燃(填“X”或“Y”)处酒精灯。(6)、“引火铁”在空气中能自燃的原因是。28. 已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验: (1)、装碱石灰的仪器是(填仪器名称)。(2)、圆底烧瓶中发生反应的离子方程式。(3)、装置的连接顺序为a→→→→→b→c→f。(4)、反应一段时间后想熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
(1)、装碱石灰的仪器是(填仪器名称)。(2)、圆底烧瓶中发生反应的离子方程式。(3)、装置的连接顺序为a→→→→→b→c→f。(4)、反应一段时间后想熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
①淡黄色溶液中加入试剂X,请写出X的化学式。
②固体混合物的成分是(填化学式,已知混合物只有两种物质)
(5)、已知红色褪去的同时有气体生成,经检验为O2 , 该小组同学对红色褪去的原因提出了三种假设。假设Ⅰ:H2O2还原Fe3+ , 使其全部转变为Fe2+;
假设Ⅱ:H2O2分解生成O2 , O2氧化试剂X:
假设Ⅲ:。
并对假设进行了以下实验研究:
①取褪色后溶液并分成三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同浓度的FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2 , 无明显变化。
分析并得出结论:实验②说明假设是不正确:实验①②得出假设是正确的。
五、推断题
-
29. 是中学常见的几种化合物,相关物质间的转化关系如图所示:

已知: 是生活中常见的金属单质, 都是氧化物且A是红棕色粉末。回答下列问题:
(1)、单质X与A反应的化学方程式是。(2)、若试剂1和试剂2均为强电解质。①若试剂1为强碱,则试剂1与B反应的离子方程式为。
②若试剂1和试剂2为同种物质,则C溶液显(填“酸性”、“碱性”或“中性”)。
(3)、若试剂2是稀硝酸。①写出单质Y与稀硝酸反应生成E的离子方程式。
②可用于检验D的阳离子的试剂是。
30. 为了探究某带结晶水的固体X(含四种元素)的组成和性质,进行了如下实验:
已知:D为无色、有刺激性气味的有毒气体。请回答:
(1)、X中含有的元素为H、O、;X的化学式为;(2)、下列说法错误的是___________;A、固体A的分解为氧化还原反应 B、固体C具有磁性,俗称磁性氧化铁 C、气体D和E均为共价化合物 D、溶液F具有强酸性(3)、写出F →G的离子方程式;(4)、D在适当的温度并有催化剂存在的条件下,可以被氧气氧化,生成E。写出D→E的化学方程式;(5)、另设计实验方案,用化学方法检验固体A中的阳离子。31. 下图是无机物A~H在一定条件下的转化关系(反应条件及部分产物未列出)。其中,其中①、②是化工生产中重要的反应。B是非金属单质,G是金属单质,H是黄绿色气体。 (1)、反应②的化学方程式为 , 该反应在化工生产中的目的是。(2)、检验I中阳离子的实验操作为。(3)、在化工生产中每燃烧0.12 kg A就会放出853 kJ热量,则A燃烧的热化学方程式为。
(1)、反应②的化学方程式为 , 该反应在化工生产中的目的是。(2)、检验I中阳离子的实验操作为。(3)、在化工生产中每燃烧0.12 kg A就会放出853 kJ热量,则A燃烧的热化学方程式为。

