安徽省合肥市包河区2021年中考化学三模试卷
试卷更新日期:2021-08-03 类型:中考模拟
一、单选题
-
1. 劳动创造幸福。“五一劳动节”期间,同学们所做下列家务劳动涉及化学变化的是( )A、晾晒洗好的湿衣服 B、把活性炭放到冰箱中除异味 C、用洗洁精清洗碗筷 D、用食醋清洗水瓶底部的水垢2. 2021年世界地球日的主循环题是“修复我们的地球,关注地球健康”。下列做法不符合该主题的是( )A、乘坐轻轨出行,缓解温室效应 B、大力开采化石燃料,确保经济快速发展 C、使用教材,减少纸张浪费 D、实验室生锈的铁钉、废铜片等放入可回收垃圾箱3. 规范实验操作是实验成功的基础和关键,下列实验操作正确的是( )A、
 检查装置气密性
B、
检查装置气密性
B、 铁丝在氧气中燃烧
C、
铁丝在氧气中燃烧
C、 镁条和稀盐酸反应
D、
镁条和稀盐酸反应
D、 蒸发结晶
4. 2020年5月17日至23日是我国第六届全民营养周,以“合理膳食,免疫基石”为传播主题,开启了“健康中国,营养先行”的全民营养新时代。下列说法正确的是( )A、铁是人体必需的微量元素,摄入越多越好 B、为减轻体重,小彤采用每天不吃早餐等节食方法 C、每天食用适量新鲜蔬菜和水果以补充维生素 D、奶茶品种多样口感好,小丽每天至少一杯奶茶或水果茶,代替饮水5. 丹青是我国古绘画中常用的颜色,丹指朱砂(主要成分为硫化汞),硫、汞元素在元素周期表中的信息如图所示。下列说法正确的是( )
蒸发结晶
4. 2020年5月17日至23日是我国第六届全民营养周,以“合理膳食,免疫基石”为传播主题,开启了“健康中国,营养先行”的全民营养新时代。下列说法正确的是( )A、铁是人体必需的微量元素,摄入越多越好 B、为减轻体重,小彤采用每天不吃早餐等节食方法 C、每天食用适量新鲜蔬菜和水果以补充维生素 D、奶茶品种多样口感好,小丽每天至少一杯奶茶或水果茶,代替饮水5. 丹青是我国古绘画中常用的颜色,丹指朱砂(主要成分为硫化汞),硫、汞元素在元素周期表中的信息如图所示。下列说法正确的是( )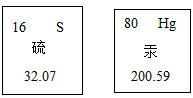 A、硫原子的中子数为 16 B、汞和硫都属于非金属元素 C、汞的相对原子质量为 200.59g D、硫化汞中硫元素和汞元素的质量比为 1∶16. 建构模型是学习化学的重要方法,下列有关模型正确的是( )A、
A、硫原子的中子数为 16 B、汞和硫都属于非金属元素 C、汞的相对原子质量为 200.59g D、硫化汞中硫元素和汞元素的质量比为 1∶16. 建构模型是学习化学的重要方法,下列有关模型正确的是( )A、 合成材料模型
B、
合成材料模型
B、 空气组成模型
C、
空气组成模型
C、 化学反应分类
D、
化学反应分类
D、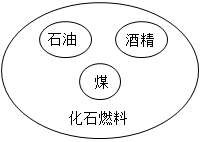 化石燃料模型
7. 据《科学》杂志报道,地塞米松是首个被证明能减少新冠肺炎死亡病例的药物。地塞米松的化学式为C22H29FO5 , 下列关于地塞米松的叙述正确的是( )A、地塞米松属于有机高分子化合物 B、地塞米松中碳元素的质量分数最高 C、地塞米松由22个碳原子、29个氢原子、1个氟原子和5个氧原子构成 D、地塞米松的相对分子质量是392g8. 物质的鉴别和除杂是重要的实验技能,下列实验操作(括号内为杂质)正确的是( )
化石燃料模型
7. 据《科学》杂志报道,地塞米松是首个被证明能减少新冠肺炎死亡病例的药物。地塞米松的化学式为C22H29FO5 , 下列关于地塞米松的叙述正确的是( )A、地塞米松属于有机高分子化合物 B、地塞米松中碳元素的质量分数最高 C、地塞米松由22个碳原子、29个氢原子、1个氟原子和5个氧原子构成 D、地塞米松的相对分子质量是392g8. 物质的鉴别和除杂是重要的实验技能,下列实验操作(括号内为杂质)正确的是( )选项
物质
目的
主要实验操作
A
CaCO3粉末(CaCl2)
除杂
加入足量的稀盐酸,过滤
B
NH4Cl和KCl固体
鉴别
加熟石灰研磨,闻气味
C
氢气和甲烷
鉴别
点燃,在火焰上方罩一个干冷烧杯
D
FeCl2溶液(CuCl2溶液)
分离
加过量锌粉,充分反应后过滤
A、A B、B C、C D、D9. 如图是某化学反应的微观模型示意图,下列叙述正确的是( ) A、反应前后各元素化合价不变 B、二氧化碳和乙烯均属于氧化物 C、该化学变化中发生改变的微粒是原子 D、参加反应的CO2和H2分子个数比为1∶310. 学习化学,提高学科核心素养,学会从化学的视角认识世界。下列说法正确的是( )A、合金具有更高的强度和硬度,更好的抗腐蚀性,因此,合金具有更广泛的用途 B、由同种分子构成的物质是纯净物,所以纯净物一定由同种分子构成 C、催化剂在反应前后质量不变,因此反应前后质量不变的物质一定是催化剂 D、天然气经压缩储存在钢瓶中,说明甲烷分子体积变小了11. 某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙,下列说法正确的是( )
A、反应前后各元素化合价不变 B、二氧化碳和乙烯均属于氧化物 C、该化学变化中发生改变的微粒是原子 D、参加反应的CO2和H2分子个数比为1∶310. 学习化学,提高学科核心素养,学会从化学的视角认识世界。下列说法正确的是( )A、合金具有更高的强度和硬度,更好的抗腐蚀性,因此,合金具有更广泛的用途 B、由同种分子构成的物质是纯净物,所以纯净物一定由同种分子构成 C、催化剂在反应前后质量不变,因此反应前后质量不变的物质一定是催化剂 D、天然气经压缩储存在钢瓶中,说明甲烷分子体积变小了11. 某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙,下列说法正确的是( )
A、该温度下,KNO3的溶解度为30g B、乙溶液的质量分数为30% C、降低温度,可以使甲溶液变成饱和溶液 D、升高温度,甲、乙两溶液的质量分数都增大12. 如图为CO 还原CuO微型”实验装置(夹持仪器略)。已知 。说法正确的是( ) A、甲可以随时控制反应的发生和停止 B、挤压甲中胶头滴管的同时点燃酒精灯 C、乙中固体减少的质量等于丙中增加的质量 D、此装置内空间较小,空气易排尽,实验危险系数小
A、甲可以随时控制反应的发生和停止 B、挤压甲中胶头滴管的同时点燃酒精灯 C、乙中固体减少的质量等于丙中增加的质量 D、此装置内空间较小,空气易排尽,实验危险系数小二、综合题
-
13. 阅读下列科技短文,回答问题。
2021年3月20日,“考古中国”重大项目工作进展会在四川省成都市召开,通报三星堆遗址重要考古成果—新发现6座三星堆文化“祭祀坑”,新出土重要文物500多件,有高2.62米的青铜大立人、高3.95米的青铜神树、由金箔包裹的权杖、重约286克的金面具及玉石器和象牙等,多属前所未见的稀世之珍。
青铜是金属冶铸史上最早出现的合金,与纯铜相比,其强度高、熔点低、铸造性好、耐磨且耐腐蚀。《周礼•考工记》中对制作钟鼎、斧斤、戈戟等青铜器物中铜锡的比例作了详细的规定(见图)。在地下埋藏的青铜器表面会出现绿色的铜锈,其主要成分为碱式碳酸铜。
 (1)、下列属于金属材料的是(填字母序号)。
(1)、下列属于金属材料的是(填字母序号)。A 青铜大立人 B 金面具 C 象牙 D 玉石器
(2)、青铜与纯铜相比,提升了哪些性能(答一条即可)。(3)、依据图2可知,用于生产戈戟的青铜器中,铜和锡的比例为。(4)、铜锈的主要成分是Cu2(OH)2CO3 , 其中铜元素的化合价是 , 请写出铜生锈的化学方程式。14. 实验探究是化学学习的重要手段。如图是实验室制取气体的常用装置。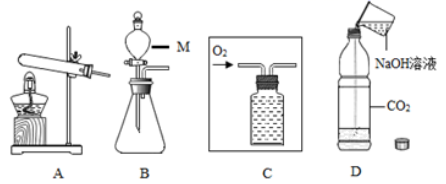 (1)、仪器M的名称。(2)、写出用 A 装置制取氧气的化学方程式;若用C装置收集氧气,请将装置补画完整。(3)、实验室制取二氧化碳和氢气都可选用B装置,原因是。(4)、向图D中的塑料软瓶中倒入约三分之一体积的NaOH溶液,迅速拧紧瓶盖,振荡,可观察到瓶子变瘪。该实验现象(填“能”或“不能”)证明二氧化碳与氢氧化钠发生了反应。15. 某工厂为实现“碳中和”目标,设计了一种“捕捉”CO2的减排方案,流程如下:
(1)、仪器M的名称。(2)、写出用 A 装置制取氧气的化学方程式;若用C装置收集氧气,请将装置补画完整。(3)、实验室制取二氧化碳和氢气都可选用B装置,原因是。(4)、向图D中的塑料软瓶中倒入约三分之一体积的NaOH溶液,迅速拧紧瓶盖,振荡,可观察到瓶子变瘪。该实验现象(填“能”或“不能”)证明二氧化碳与氢氧化钠发生了反应。15. 某工厂为实现“碳中和”目标,设计了一种“捕捉”CO2的减排方案,流程如下:
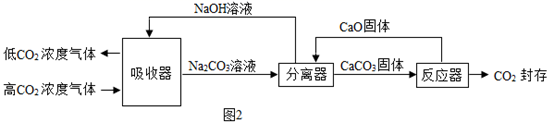 (1)、“碳中和”目的是使碳排放与碳吸收达平衡,最终实现零碳排放。结合图1,提出一种可行的碳吸收方式:。(2)、“碳捕获”并封存被认为是目前减缓全球变暖最经济可行的方式。图2是一种利用NaOH溶液实现“碳捕获”的技术主要流程。
(1)、“碳中和”目的是使碳排放与碳吸收达平衡,最终实现零碳排放。结合图1,提出一种可行的碳吸收方式:。(2)、“碳捕获”并封存被认为是目前减缓全球变暖最经济可行的方式。图2是一种利用NaOH溶液实现“碳捕获”的技术主要流程。①分离器中,Na2CO3参与反应的化学方程式为。
②用该技术进行“碳捕获”有效利用了原材料,在该过程中被循环利用的物质有。
(3)、实验室用澄清石灰水检验CO2也是“捕捉”CO2的过程。工厂却不宜采用澄清石灰水“捕捉”CO2的减排方案,原因是。16. 酸碱中和反应是初中阶段重要的一类反应,某校学习小组以中和反应为项目进行如下研究。(1)、(认识中和反应)当两种化合物互相交换成分,生成物中有生成时,复分解反应才可以发生;中和反应属于复分解反应。
(2)、稀盐酸和氢氧化钠溶液混合没有明显现象,请设计实验证明稀盐酸与稀氢氧化钠溶液发生了中和反应,并完成实验报告。实验用品包括烧杯、胶头滴管、玻璃棒、稀盐酸、稀氢氧化钠溶液、酚酞溶液。
实验步骤
实验现象
实验结论
一段时间后溶液由红色变为无色
证明稀盐酸与稀氢氧化钠溶液发生了中和反应
(3)、(探究中和反应)(提出问题)中和反应的实质是什么?
(查阅资料)a.一定体积的溶液中,离子的数目越多,其离子的浓度越大。电导率传感器用于测量溶液的导电性强弱,电导率值越大溶液导电能力越强。溶液的导电强弱主要与溶液中可自由移动离子的浓度和种类有关。如果离子的浓度和种类发生变化,则溶液的电导率也随之发生变化。
b.BaSO4难溶于水,即在水中难电离。
c.蒸馏水几乎不导电。
恒温条件下,向20mL一定浓度的稀Ba(OH)2溶液中滴加2滴无色酚酞溶液,插入电导率传感器,然后逐滴滴加稀硫酸,边滴加边用磁力搅拌器不断搅拌,测得溶液的电导率变化如甲图曲线所示。请写出Ba(OH)2与稀硫酸反应的化学方程式。
 (4)、通过对甲图曲线的分析,下列说法正确的是_______(填字母)。A、M点前曲线下降的过程中,H+和OH-结合成H2O,Ba2+和 结合成BaSO4 B、M点时离子浓度几乎为零 C、M点后溶液电导率逐渐增大,仅由于溶液中H+浓度逐渐增大(5)、(拓展探究)
(4)、通过对甲图曲线的分析,下列说法正确的是_______(填字母)。A、M点前曲线下降的过程中,H+和OH-结合成H2O,Ba2+和 结合成BaSO4 B、M点时离子浓度几乎为零 C、M点后溶液电导率逐渐增大,仅由于溶液中H+浓度逐渐增大(5)、(拓展探究)恒温条件下,向20mL一定浓度的稀氢氧化钠溶液中滴加2滴无色酚酞溶液,插入电导率传感器,然后逐滴滴加稀盐酸,边滴加边用磁力搅拌器不断搅拌,测得溶液的电导率变化如乙图曲线所示。通过对乙图曲线的分析,下列说法错误的是(填字母)。

A 开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B 电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C 整个实验过程中,溶液中 Na+数目一直增大
(6)、N点时,溶液中所含的离子有(填离子符号)。(7)、从微观视角认识物质世界是研究化学的一种重要思维方法。下图表示乙图反应过程中烧杯中不同时间点的微观粒子示意图,按时间先后排列的顺序为(填字母)。
 (8)、恒温条件下,向20mL同浓度的稀Ba(OH)2溶液中插入电导率传感器,然后滴加稀CuSO4溶液,请你预测,溶液的电导率变化与上图中的(填“甲”或“乙”)曲线更接近。17. 为了研究图一装置的工作原理,在装置左侧连接压强传感器,测定制取二氧化碳过程中的压强变化,如图二所示。
(8)、恒温条件下,向20mL同浓度的稀Ba(OH)2溶液中插入电导率传感器,然后滴加稀CuSO4溶液,请你预测,溶液的电导率变化与上图中的(填“甲”或“乙”)曲线更接近。17. 为了研究图一装置的工作原理,在装置左侧连接压强传感器,测定制取二氧化碳过程中的压强变化,如图二所示。 (1)、实验室用大理石和稀盐酸制取2.2g二氧化碳气体,求参加反应的碳酸钙的质量。(2)、请描述ab时间段,装置内出现的现象。
(1)、实验室用大理石和稀盐酸制取2.2g二氧化碳气体,求参加反应的碳酸钙的质量。(2)、请描述ab时间段,装置内出现的现象。