华师大版初中科学九上2.2重要的酸同步练习
试卷更新日期:2021-07-30 类型:同步测试
一、单选题
-
1. 下列物质不能使金属生成金属氧化物的是( )A、氧气 B、浓硫酸 C、稀硫酸 D、硝酸2. 在浓硫酸的运输过程中,能将浓硫酸盛放在铁制的容器中。其原因是( )A、铁的化学性质稳定,不与硫酸反应 B、铁与浓硫酸反应生成致密的氧化物 C、铁与浓硫酸反应生成FeSO4保护层 D、铁与浓硫酸反应生成Fe2(SO4)3保护层3. 盐酸先生闯迷宫(如图),请你帮他选择行进路线(不发生化学反应)( )
 A、A B、B C、C D、D4. 下列关于硫酸的认识,正确的是( )A、组成:硫酸溶液中H+和 的数目相同 B、性质:能与CO2、SO3等非金属氧化物反应 C、用途:可用于实验室制备CuSO4等硫酸盐 D、生产:含硫酸废水用CaCl处理后直接排放5. 某同学设计了如图装置以探究“微粒是不断运动的”,一段时间后,可观察到紫色石蕊变红,则物质A是( )
A、A B、B C、C D、D4. 下列关于硫酸的认识,正确的是( )A、组成:硫酸溶液中H+和 的数目相同 B、性质:能与CO2、SO3等非金属氧化物反应 C、用途:可用于实验室制备CuSO4等硫酸盐 D、生产:含硫酸废水用CaCl处理后直接排放5. 某同学设计了如图装置以探究“微粒是不断运动的”,一段时间后,可观察到紫色石蕊变红,则物质A是( ) A、浓氨水 B、浓硫酸 C、生石灰 D、浓盐酸6. 实验室用石灰石与稀盐酸反应制取氢气,发生装置如图所示,打开活塞,注入稀盐酸, 发现稀盐酸未能与有孔塑料板上的石灰石接触,但此时已无稀盐酸可加,则下列溶液中,最适宜从长颈漏斗添加的是 ( )
A、浓氨水 B、浓硫酸 C、生石灰 D、浓盐酸6. 实验室用石灰石与稀盐酸反应制取氢气,发生装置如图所示,打开活塞,注入稀盐酸, 发现稀盐酸未能与有孔塑料板上的石灰石接触,但此时已无稀盐酸可加,则下列溶液中,最适宜从长颈漏斗添加的是 ( )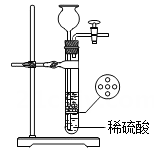 A、硫酸钠溶液 B、碳酸钠溶液 C、氢氧化钠溶液 D、澄清石灰水7. 归纳总结是学习科学的重要方法。小金同学在学习酸知识后,结合常见酸(HCl、H2SO4)的性质与变化绘制出下图。图中“—”两端的物质都能够发生反应,其中酸碱中和反应生成盐和水,则其它连线的产物也都是盐和水的是( )
A、硫酸钠溶液 B、碳酸钠溶液 C、氢氧化钠溶液 D、澄清石灰水7. 归纳总结是学习科学的重要方法。小金同学在学习酸知识后,结合常见酸(HCl、H2SO4)的性质与变化绘制出下图。图中“—”两端的物质都能够发生反应,其中酸碱中和反应生成盐和水,则其它连线的产物也都是盐和水的是( ) A、A B、B C、C D、D8. 向含有一定量稀盐酸和氯化钙的混合溶液中逐滴加入碳酸钠溶液,下列图象能正确反映变化关系的是( )A、
A、A B、B C、C D、D8. 向含有一定量稀盐酸和氯化钙的混合溶液中逐滴加入碳酸钠溶液,下列图象能正确反映变化关系的是( )A、 B、
B、 C、
C、 D、
D、 9. 通过观察和实验等方法,人们找到物质变化的证据。下列四组研究化学反应快慢的对比实验中,各组所用溶液浓度相同且适宜、所用固体表面积相同,其中现象最不明显的一组是( )A、
9. 通过观察和实验等方法,人们找到物质变化的证据。下列四组研究化学反应快慢的对比实验中,各组所用溶液浓度相同且适宜、所用固体表面积相同,其中现象最不明显的一组是( )A、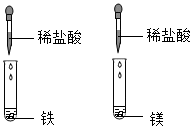 B、
B、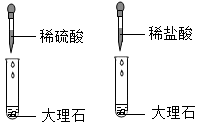 C、
C、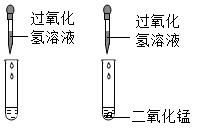 D、
D、 10. 镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3 ,La(OH)3 是不溶于水的碱,而LaCl 3 、La(NO3 )3 都可溶于水。由此判断下列几组物质,不能直接反应制取LaCl3 的是( )A、La2 O3 和盐酸 B、La(OH)3和盐酸 C、NaCl和La(OH)3 D、La和盐酸11. 科学实验室的铅蓄电池中装有硫酸,如果不慎将硫酸洒到大理石地面上,会发出嘶嘶声并有气体产生。这种气体是( )A、CO2 B、N2 C、H2 D、O212. 柠檬酸(C6H8O7)是一种较强的有机酸,主要用于制作香料或作为饮料的酸化剂,化学性质与稀盐酸相似。下列物质不能与柠檬酸反应的是( ) 。A、Fe B、CO2 C、CuO D、NaOH13. 硫酸是一种常见的酸。下列关于硫酸的说法中,正确的是( )A、组成:硫酸溶液中有H+和SO42-两种微粒,且数目相同 B、性质:能与碱、多种金属和CO2、SO3等非金属氧化物反应 C、用途:可用于清除铁表面的氧化铁和生产化肥硫酸铵 D、检验:滴入氯化钡溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解14. 认真细致的观察和分析实验现象,有助于获得化学知识并学会科学探究的方法。以下分析你认为合理的是( )A、在碳酸钠溶液中滴加酚酞试液变红色,可证明碳酸钠属于碱类 B、某固体中加入稀盐酸产生气体,可证明该固体一定含有碳酸根离子 C、氯化钠晶体不导电,说明氯化钠晶体中不存在离子 D、浓盐酸具有挥发性,所以将浓盐酸放置于空气中浓度会减小15. 小敏同学往氢氧化钠溶液中滴加稀盐酸研究中和反应时,忘记了滴加酸碱指示剂。为了确认滴加的盐酸是否已经过量,小敏从烧杯中取少量反应后的溶液于试管中,用某种试剂进行检验。下表是小敏同学设计的实验方案,其中正确的是( )
10. 镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3 ,La(OH)3 是不溶于水的碱,而LaCl 3 、La(NO3 )3 都可溶于水。由此判断下列几组物质,不能直接反应制取LaCl3 的是( )A、La2 O3 和盐酸 B、La(OH)3和盐酸 C、NaCl和La(OH)3 D、La和盐酸11. 科学实验室的铅蓄电池中装有硫酸,如果不慎将硫酸洒到大理石地面上,会发出嘶嘶声并有气体产生。这种气体是( )A、CO2 B、N2 C、H2 D、O212. 柠檬酸(C6H8O7)是一种较强的有机酸,主要用于制作香料或作为饮料的酸化剂,化学性质与稀盐酸相似。下列物质不能与柠檬酸反应的是( ) 。A、Fe B、CO2 C、CuO D、NaOH13. 硫酸是一种常见的酸。下列关于硫酸的说法中,正确的是( )A、组成:硫酸溶液中有H+和SO42-两种微粒,且数目相同 B、性质:能与碱、多种金属和CO2、SO3等非金属氧化物反应 C、用途:可用于清除铁表面的氧化铁和生产化肥硫酸铵 D、检验:滴入氯化钡溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解14. 认真细致的观察和分析实验现象,有助于获得化学知识并学会科学探究的方法。以下分析你认为合理的是( )A、在碳酸钠溶液中滴加酚酞试液变红色,可证明碳酸钠属于碱类 B、某固体中加入稀盐酸产生气体,可证明该固体一定含有碳酸根离子 C、氯化钠晶体不导电,说明氯化钠晶体中不存在离子 D、浓盐酸具有挥发性,所以将浓盐酸放置于空气中浓度会减小15. 小敏同学往氢氧化钠溶液中滴加稀盐酸研究中和反应时,忘记了滴加酸碱指示剂。为了确认滴加的盐酸是否已经过量,小敏从烧杯中取少量反应后的溶液于试管中,用某种试剂进行检验。下表是小敏同学设计的实验方案,其中正确的是( )实验方案
使用的试剂
现象及结论
A
酚酞试剂
如果溶液不变色,表明盐酸已经过量
B
硫酸铜
如果没有沉淀,表明盐酸已经过量
C
硝酸银溶液
如果有白色沉淀产生,表明盐酸已经过量
D
氧化铁粉末
如果溶液变黄,表明盐酸已经过量
A、A B、B C、C D、D16. 如图围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化坝、碳酸钙、硝酸银五种物质相邻棋子间的连线表示物质间可以反应,已知与戊的反应中:甲-戊的反应类型不同于其它几个反应:丙-戊反应能产生一种气体。且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )

甲
乙
丙
丁
戊
A
铁
硝酸银
碳酸钙
氢氧化钡
稀盐酸
B
硝酸银
铁
稀盐酸
氢氧化钡
碳酸钙
C
硝酸银
铁
碳酸钙
氢氧化钡
稀盐酸
D
铁
氢氧化钡
碳酸钙
硝酸银
稀盐酸
A、A B、B C、C D、D17. 某同学为验证“分子是运动的”,设计了甲、乙、丙、丁四个实验。能达到目的是( )
 A、甲、乙、丙 B、甲、乙、丁 C、甲、丙、丁 D、乙、丙、丁18. 下列有关硫酸的叙述中不正确的是( )A、硫酸溶液中K+、Ca2+、OH-、Cl-可以大量共存 B、硫酸和盐酸溶液中都含有H+ , 因此它们的化学性质相似 C、在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中,并不断搅拌 D、稀硫酸滴加到氢氧化钡溶液中,出现白色沉淀,即可说明反应已经发生19. 如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲——戊的反应类型不同于其他几个反应;丙——戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )
A、甲、乙、丙 B、甲、乙、丁 C、甲、丙、丁 D、乙、丙、丁18. 下列有关硫酸的叙述中不正确的是( )A、硫酸溶液中K+、Ca2+、OH-、Cl-可以大量共存 B、硫酸和盐酸溶液中都含有H+ , 因此它们的化学性质相似 C、在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中,并不断搅拌 D、稀硫酸滴加到氢氧化钡溶液中,出现白色沉淀,即可说明反应已经发生19. 如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲——戊的反应类型不同于其他几个反应;丙——戊反应能产生一种气体,且该气体还能与丁反应生成沉淀。则下列对应关系正确的是( )
甲
乙
丙
丁
戊
A
铁
硝酸银
碳酸钙
氢氧化钡
稀盐酸
B
硝酸银
铁
稀盐酸
氢氧化钡
碳酸钙
C
硝酸银
铁
碳酸钙
氢氧化钡
稀盐酸
D
铁
氢氧化钡
碳酸钙
硝酸银
稀盐酸
A、A B、B C、C D、D20. 白蚁能分泌蚁酸,其化学性质与盐酸相似。据此推断,下列最不容易被蚁酸腐蚀的是( )A、镀锌水管 B、大理石地板 C、铝合金门窗 D、铜制饰品二、填空题
-
21. 根据酸的化学性质回答下列问题。
 (1)、酸溶液有相似化学性质的原因是溶液中都含有(填离子符号)(2)、图中的X代表一类物质,则X为(填物质类别)。(3)、请写出符合性质②,反应前后溶液颜色发生改变的一个反应的化学方程式。22. 有些酸随着浓度的改变会表现出不同的化学性质。请回答下列问题:(1)、用毛笔蘸取稀硫酸在竹片上画花,然后烘干,水洗,在竹片上就得到一幅精美的呈黑色或褐色的竹片画。在烘干的过程中稀硫酸变为浓硫酸,制作竹片画时就利用了浓硫酸的性;(2)、在加热的条件下浓硫酸与铜反应的化学方程式是Cu+2H2SO4(浓) CuSO4+SO2↑+2X,则X的化学式是。但足量的铜和浓硫酸充分反应后溶液中仍有少量硫酸剩余,其原因是。23. 如图是某学生设计的一种有洗气、检验、贮气等用途的装置。当除去氧气中混有的水蒸气时,混合气体应从(填“A”或“B”)处导管进入,瓶中盛有的物质可以是。
(1)、酸溶液有相似化学性质的原因是溶液中都含有(填离子符号)(2)、图中的X代表一类物质,则X为(填物质类别)。(3)、请写出符合性质②,反应前后溶液颜色发生改变的一个反应的化学方程式。22. 有些酸随着浓度的改变会表现出不同的化学性质。请回答下列问题:(1)、用毛笔蘸取稀硫酸在竹片上画花,然后烘干,水洗,在竹片上就得到一幅精美的呈黑色或褐色的竹片画。在烘干的过程中稀硫酸变为浓硫酸,制作竹片画时就利用了浓硫酸的性;(2)、在加热的条件下浓硫酸与铜反应的化学方程式是Cu+2H2SO4(浓) CuSO4+SO2↑+2X,则X的化学式是。但足量的铜和浓硫酸充分反应后溶液中仍有少量硫酸剩余,其原因是。23. 如图是某学生设计的一种有洗气、检验、贮气等用途的装置。当除去氧气中混有的水蒸气时,混合气体应从(填“A”或“B”)处导管进入,瓶中盛有的物质可以是。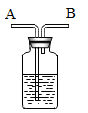 24. 硫酸、盐酸是重要的化工原料。(1)、浓硫酸在实验室常用作干燥剂,是因为浓硫酸有性。(2)、98%的浓硫酸稀释为稀硫酸时,一定要将沿烧杯壁缓慢地注入盛有的烧杯里,并用搅拌。(3)、盐酸在下列用途中,不能用硫酸代替盐酸的是(填编号)
24. 硫酸、盐酸是重要的化工原料。(1)、浓硫酸在实验室常用作干燥剂,是因为浓硫酸有性。(2)、98%的浓硫酸稀释为稀硫酸时,一定要将沿烧杯壁缓慢地注入盛有的烧杯里,并用搅拌。(3)、盐酸在下列用途中,不能用硫酸代替盐酸的是(填编号)① 金属表面除锈 ② 制造药物氯化锌 ③除去NaCl中的少量NaOH
25. 科学使世界变得绚丽多彩。如图是物质之间发生化学反应的颜色变化。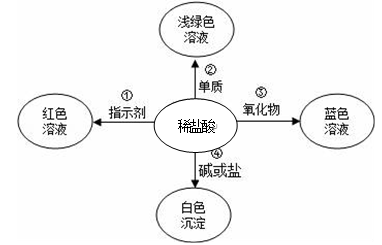 (1)、请你在编号③处填入一种物质,③是;(2)、若编号④的物质是盐,要产生白色沉淀,可能是下列物质中的______。A、硝酸银 B、氯化钡 C、氢氧化钠26. 某同学对酸的化学性质进行了归纳,如图所示,回答下列问题。
(1)、请你在编号③处填入一种物质,③是;(2)、若编号④的物质是盐,要产生白色沉淀,可能是下列物质中的______。A、硝酸银 B、氯化钡 C、氢氧化钠26. 某同学对酸的化学性质进行了归纳,如图所示,回答下列问题。 (1)、性质3箭头上方的反应物质类别为。(2)、根据性质5,硫酸可以与下列哪些物质发生反应。
(1)、性质3箭头上方的反应物质类别为。(2)、根据性质5,硫酸可以与下列哪些物质发生反应。A.烧碱溶液 B.纯碱溶液 C.氯化钡溶液 D.食盐溶液
27. 某推销员这样向你推销他的产品“我厂生产的浓盐酸质优价廉,浓度高达90%……”,你会买他的盐酸吗?为什么?28. 用火柴梗蘸一点浓硫酸,放置一会儿,火柴梗颜色变黑,这是因为浓硫酸具有性的缘故。浓硫酸可做某些气体的干燥剂,这是因为它具有性的缘故。学了酸的知识后,小明知道了不同的酸有共同的化学性质,其原因是酸在水溶液中电离出来的阳离子全都是离子的缘故。29. 以化合价为纵坐标,物质的类别为横坐标所绘制的图象叫价类图.如图为硫的价类图,请分析该图后填空: (1)、E点表示的是二氧化硫,写出它的一条物理性质;(2)、A点表示的物质类别是;(3)、写出由B点表示的化合物与氢氧化钠溶液反应的化学方程式 .30. “探险队员”——盐酸,不小心走进了科学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过.
(1)、E点表示的是二氧化硫,写出它的一条物理性质;(2)、A点表示的物质类别是;(3)、写出由B点表示的化合物与氢氧化钠溶液反应的化学方程式 .30. “探险队员”——盐酸,不小心走进了科学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或水溶液),盐酸必须避开它们,否则就无法通过. (1)、请你帮助他走出迷宫(请用图中物质前的序号依次连接起来表示他所走的路线)入口→→出口.(2)、在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有个,其中能“吃掉”盐酸的盐是.(3)、在不能与盐酸反应的物质中,写出一个能与硝酸银溶液反应的化学方程式
(1)、请你帮助他走出迷宫(请用图中物质前的序号依次连接起来表示他所走的路线)入口→→出口.(2)、在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有个,其中能“吃掉”盐酸的盐是.(3)、在不能与盐酸反应的物质中,写出一个能与硝酸银溶液反应的化学方程式三、解答题
-
31. 构建模型和构建知识网络是科学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
 (1)、如用湿润的 pH 试纸测定盐酸的 pH,则结果会(填“偏大”、“偏小”、“无影响”)。(2)、写出一个符合图中③的化学方程式。(3)、图中性质④属于反应(填基本反应类型)。32. 实验室需要把 98%的浓硫酸稀释成 10%的稀硫酸进行实验,稀释时应把(选填“浓硫酸慢慢倒入水中”或“水慢慢倒入浓硫酸中”),并不断地搅拌。两种液体切不可倒过来稀释,请解释原因。
(1)、如用湿润的 pH 试纸测定盐酸的 pH,则结果会(填“偏大”、“偏小”、“无影响”)。(2)、写出一个符合图中③的化学方程式。(3)、图中性质④属于反应(填基本反应类型)。32. 实验室需要把 98%的浓硫酸稀释成 10%的稀硫酸进行实验,稀释时应把(选填“浓硫酸慢慢倒入水中”或“水慢慢倒入浓硫酸中”),并不断地搅拌。两种液体切不可倒过来稀释,请解释原因。
33. 将未经砂布打磨的铝条放入盛有足量稀硫酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。 (1)、由图象可知密闭容器内发生了反应(选填“吸热”或“放热");(2)、请对曲线各部分变化情况作出解释。34. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。小柯用放置很久的铝箔与稀盐酸反应,如图横坐标表示反应时间,根据图像判断,纵坐标可以表示的信息是 , 并作出解答。
(1)、由图象可知密闭容器内发生了反应(选填“吸热”或“放热");(2)、请对曲线各部分变化情况作出解释。34. 铝箔是现代生活中常见的包装材料,放置久了,其银白色光泽会变暗淡,故又称假银箔。小柯用放置很久的铝箔与稀盐酸反应,如图横坐标表示反应时间,根据图像判断,纵坐标可以表示的信息是 , 并作出解答。
四、实验探究题
-
35. 为验证“酸的化学通性”,某班同学在实验室进行如下实验。请分析并回答相关问题:
 (1)、写出能证明A中反应发生的现象。(2)、要全面验证酸的化学通性,D试管中能与酸反应的固体单质是(写一种即可)。(3)、实验完成后,将全部废液倒入废液缸内,测得pH=2,则废液中所含溶质最多有种(溶质不计指示剂与气体)。36. 为探究酸碱中和反应,小毛同学设计了如下实验。
(1)、写出能证明A中反应发生的现象。(2)、要全面验证酸的化学通性,D试管中能与酸反应的固体单质是(写一种即可)。(3)、实验完成后,将全部废液倒入废液缸内,测得pH=2,则废液中所含溶质最多有种(溶质不计指示剂与气体)。36. 为探究酸碱中和反应,小毛同学设计了如下实验。【实验探究一】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并玻璃棒搅拌,观察到溶液的温度升高,由此现象推断两者能发生反应的结论。通过查阅相关资料后,小毛同学发现此结论不够严谨,设计了下列3个对比实验: ①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化: ②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化 ③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化用数字化实验技术测得3个实验中溶液温度随时间变化的关系如图所示:
 (1)、由图分析,小毛同学确认盐酸和氢氧化钠溶液的确发生了反应,理由是。(2)、从微观角度分析,此酸碱反应的温度变化主要是由于(填离子符号)两种离子发生反应放出热量的缘故。(3)、【实验探究二】
(1)、由图分析,小毛同学确认盐酸和氢氧化钠溶液的确发生了反应,理由是。(2)、从微观角度分析,此酸碱反应的温度变化主要是由于(填离子符号)两种离子发生反应放出热量的缘故。(3)、【实验探究二】在50mL一定浓度的氢氧化钠溶液中滴加2-3滴无色酚酞试液,再逐滴加入一定浓度的盐酸,并用玻璃棒搅拌,溶液颜色由红色刚好变为无色时,可说明两者发生了反应。
取一定量反应后的无色溶液加热蒸发,在蒸发的过程中,“意外”发现溶液由无色又变成红色。同学们认为反应后无色溶液中溶质的成分除酚酞、NaCl外,还存在少量NaOH。 查阅资料:酚酞在p<8.2的溶液中呈无色,在8.2pH<14的溶液中呈红色。 原因分析:。
37. 某兴趣小组对“稀盐酸与石灰石是否恰好完全反应”展开了系列实验(稀盐酸与石灰石中杂质不反应)。[实验操作]取一块碳酸钙于试管中,往试管中加入5亳升稀盐酸。
[实验现象]①开始时石灰石表面有大量气泡;②反应停止后,试管底部有块状固体残留、固体表面无气泡;③试管内溶液呈无色。
①[初步分析]反应停止后,某同学根据上述实验现象进行初步判断,得出了石灰石没有反应完的结论。支持该同学得出这一结论的依据是(填上述实验现象的序号);
②[小组讨论]大家讨论后认为,要判断是否恰好完全反应,可以从液体和固体两条途径进行
探究:一是探究残留液体中是否还有盐酸;二是探究残留块状固体中是否还有碳酸钙。
③[继续探究]对原残留液体是否还有盐酸的探究,有同学取原残留液体,滴加AgNO3溶液,产生白色沉淀,再滴加稀硝酸沉淀不溶解。于是根据这一现象,得出了原残留液体中存在盐酸的结论。但小金认为根据这一现象是不能得出原残留液中存在盐酸的结论,小金的理由是。
④探究残留块状固体中是否还有碳酸钙。小科取原残留块状固体用水洗净后加入稀盐酸,出现了的现象,于是得出残留块状固体中还存在碳酸钙;
⑤[实验结论]在原反应结束时,稀盐酸与碳酸钙没有恰好完全反应,固体中还有碳酸钙残留。
38. 实验室中常需要使用硫酸。 (1)、在小纸片上涂上少量浓硫酸,放置一会后,可观察到。(2)、用温度计的液泡蘸取少量浓硫酸,放置在空气中一会儿,可观察到温度计显示温度升高,其原因是。(3)、浓硫酸稀释过程如图所示,b中盛放的物质是。39. 在拓展性课程活动中,小明利用以下常见物品验证酸的一些性质:白醋(含3%的醋酸)、食品干燥剂(主要成分是CaO)、鸡蛋壳、牵牛花汁液、铁钉、纯碱(碳酸钠)。
(1)、在小纸片上涂上少量浓硫酸,放置一会后,可观察到。(2)、用温度计的液泡蘸取少量浓硫酸,放置在空气中一会儿,可观察到温度计显示温度升高,其原因是。(3)、浓硫酸稀释过程如图所示,b中盛放的物质是。39. 在拓展性课程活动中,小明利用以下常见物品验证酸的一些性质:白醋(含3%的醋酸)、食品干燥剂(主要成分是CaO)、鸡蛋壳、牵牛花汁液、铁钉、纯碱(碳酸钠)。【查阅资料】牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色。
【实验过程】
(1)、小明知道酸能够与铁发生反应产生氢气,但当他将足量的白醋加入放有铁钉的容器中,并没有看到明显的气泡产生。小明很疑惑,于是提出猜想:气泡不明显可能与酸的浓度有关。要验证与酸的浓度有关,应选择下列试剂中的 (填字母)。A、3%的盐酸 B、5%的醋酸 C、5%的盐酸(2)、小明利用已有物品还想验证酸与碱的反应,请你帮助完成下列实验设计。步骤
操作
现象
1
将食品干燥剂缓慢地加入到适量的清水中,搅拌后静置
放出大量的热
2
取步骤1中的上层清液,先加入牵牛花汁液,
溶液由无色变为蓝色,再变为紫色,最后变为红色
【评价反思】科学来源于生活,生活中的许多事物能更好地帮助我们学习和理解科学。
五、综合说理题
-
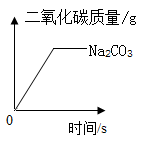
40. 在相同条件下,取相等质量的块状CaCO3和粉末状NaCO3 , 分别与足量等质量分数的盐酸充分反应。根据实验测定:其中粉末状Na2CO3与盐酸反应产生CO2的质量随反应时间变化如图所示。请在图中画出块状CaCO3与盐酸反应产生CO2的质量随反应时间变化大致曲线,并用科学原理加以解释。