华师大版初中科学八上第六章 第二节元素同步练习
试卷更新日期:2021-07-29 类型:同步测试
一、单选题
-
1. 假设1个甲原子的质量为Akg,1个标准的碳原子的实际质量Bkg,则甲原子的相对原子质量可以表示为( )A、 千克 B、12 C、 D、2. 下列元素分类正确的是( )A、金属元素:钙、镁、钡、铜、铁、汞 B、非金属元素:碳、氢、氧、氮、磷、金 C、稀有元素:氦、氖、氩、氪、氯、氡 D、人体必需的微量元素:铁、碘、氟、硒、钙、铅3. 下列化学用语中,既能表示一种元素,又能表示一个原子,还能表示一种物质的是( )A、H B、He C、O2 D、I4. 钪在元素周期表中的信息如图,其单质在工业上常用来制耐高温合金等。则( )
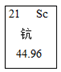 A、钪原子的原子核中有21个中子 B、钪元素的元素符号为Sc C、钪元素的相对原子质量为44.96g D、钪单质稍微加热就会熔化5. 2021年4月13日,日本政府决定将福岛核污水排入大海。核污水中含大量对人体有害的放射性物质,如锶的同位素。如图是元素周期表中锶的有关信息,下列说法错误的是( )
A、钪原子的原子核中有21个中子 B、钪元素的元素符号为Sc C、钪元素的相对原子质量为44.96g D、钪单质稍微加热就会熔化5. 2021年4月13日,日本政府决定将福岛核污水排入大海。核污水中含大量对人体有害的放射性物质,如锶的同位素。如图是元素周期表中锶的有关信息,下列说法错误的是( )
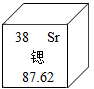 A、锶原子的质量为87.62克 B、锶原子的核外电子数为38 C、锶原子的核内质子数为38 D、锶原子的相对原子质量为87.626. 已知某氧原子的实际质量为m,其相对原子质量为16。有一种铕原子的相对原子质量为152,铕(Eu)原子的质量为( )A、 B、 C、 D、7. 2019年是元素周期表诞生第150周年。下表是元素周期表的一部分,从表中不能获取的信息是( )
A、锶原子的质量为87.62克 B、锶原子的核外电子数为38 C、锶原子的核内质子数为38 D、锶原子的相对原子质量为87.626. 已知某氧原子的实际质量为m,其相对原子质量为16。有一种铕原子的相对原子质量为152,铕(Eu)原子的质量为( )A、 B、 C、 D、7. 2019年是元素周期表诞生第150周年。下表是元素周期表的一部分,从表中不能获取的信息是( ) A、 元素在周期表中的位置 B、原子的质子数 C、元素的相对原子质量 D、原子的中子数8. 如图是元素周期表中的部分信息。下列叙述错误的是( )
A、 元素在周期表中的位置 B、原子的质子数 C、元素的相对原子质量 D、原子的中子数8. 如图是元素周期表中的部分信息。下列叙述错误的是( ) A、硼元素为非金属元素 B、碳元素原子的质子数为6 C、金刚石是由碳元素组成的单质 D、氮元素的相对原子质量为14.01g9. 我国的北斗导航卫星系统采用铷原子钟,授时精度达到百亿分之三秒。铷元素的部分信息如图所示,下列有关铷的说法不正确的是( )
A、硼元素为非金属元素 B、碳元素原子的质子数为6 C、金刚石是由碳元素组成的单质 D、氮元素的相对原子质量为14.01g9. 我国的北斗导航卫星系统采用铷原子钟,授时精度达到百亿分之三秒。铷元素的部分信息如图所示,下列有关铷的说法不正确的是( )
 A、属于金属元素 B、铷原子核外有37个电子 C、相对原子质量为85.47g D、元素符号为Rb10. 铱﹣192是一种放射性物质,对人体有严重辐射伤害。如图所示是元素周期表中铱元素的有关信息,下列说法错误的是( )
A、属于金属元素 B、铷原子核外有37个电子 C、相对原子质量为85.47g D、元素符号为Rb10. 铱﹣192是一种放射性物质,对人体有严重辐射伤害。如图所示是元素周期表中铱元素的有关信息,下列说法错误的是( )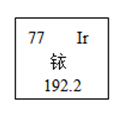 A、铱元素原子的原子核内有77个质子 B、铱元素是金属元素 C、铱元素原子的核外有77个电子 D、铱元素的相对原子质量为192.2g11. 科学家发现一种新元素。该元素原子核外电子数为117,中子数为174,相对原子质量为291,元素名称Ununseptium,符号Uus。请模仿图中甲,将该元素对应信息编写到图乙中相应位置,“①”处应填( )
A、铱元素原子的原子核内有77个质子 B、铱元素是金属元素 C、铱元素原子的核外有77个电子 D、铱元素的相对原子质量为192.2g11. 科学家发现一种新元素。该元素原子核外电子数为117,中子数为174,相对原子质量为291,元素名称Ununseptium,符号Uus。请模仿图中甲,将该元素对应信息编写到图乙中相应位置,“①”处应填( )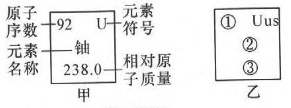 A、291 B、174 C、117 D、5712. 下列关于符号“K”所表示的意义,正确的是( )
A、291 B、174 C、117 D、5712. 下列关于符号“K”所表示的意义,正确的是( )①钾元素②钾的原子核③一个钾元素④一个钾原子⑤金属钾
A、①②⑤ B、②③④⑤ C、①④⑤ D、①③④⑤13. 如图是金元素在元素周期表中的信息示意图,从图中获取的信息正确的是( ) A、金元素属于非金属元素 B、一个金原子的中子数为197.0 C、一个金原子的核外电子数为118 D、一个金原子核带有79个单位的正电荷14. 某元素R的化合价是奇数(不变化合价),已知其氧化物的相对分子质量为m,其氯化物的相对分子质量为n,则R的化合价为 ( )A、+ B、+ C、+ D、+15. 用以作为相对原子质量标准的碳-12可以写成C-12 。1个C-12的原子的质量为a千克,1个CO2分子的质量为b千克,若以CO2分子中的1个氧原子质量的`1/16作为相对原子质量的标准,则CO2的相对分子质量是( )A、 B、 C、 D、16. 元素周期表是学习和研究化学的重要工具,可以从表中获得许多信息,下表是元素周期表的一部分,有关推断不正确的是( )
A、金元素属于非金属元素 B、一个金原子的中子数为197.0 C、一个金原子的核外电子数为118 D、一个金原子核带有79个单位的正电荷14. 某元素R的化合价是奇数(不变化合价),已知其氧化物的相对分子质量为m,其氯化物的相对分子质量为n,则R的化合价为 ( )A、+ B、+ C、+ D、+15. 用以作为相对原子质量标准的碳-12可以写成C-12 。1个C-12的原子的质量为a千克,1个CO2分子的质量为b千克,若以CO2分子中的1个氧原子质量的`1/16作为相对原子质量的标准,则CO2的相对分子质量是( )A、 B、 C、 D、16. 元素周期表是学习和研究化学的重要工具,可以从表中获得许多信息,下表是元素周期表的一部分,有关推断不正确的是( )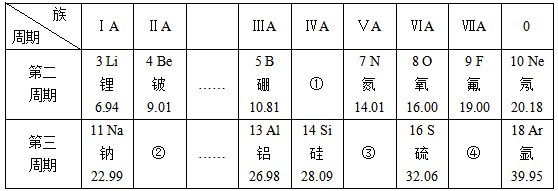 A、①代表的是碳元素 B、②元素的原子容易失去两个电子 C、③元素与氮元素的化学性质相似 D、元素②和④组成物质的化学式为MgCl17. 已知一个SO2分子的质量为n千克,一个SO3分子的质量为m千克(设两分子中的硫原子和氧原子分别相同),若以一个氧原子质量的1/16作为相对原子质量的标准,则SO2的相对分子质量为( )A、 B、 C、 D、18. 作为相对原子质量标准的碳-12可以写成12C。1个12C的质量为a kg,1个12CO2的质量为b kg,若以12CO2中的1个氧原子质量的1/12作为相对原子质量的标准,则12CO2的相对分子质量是 ( )A、 B、 C、 D、19. X元素1个原子的质量是m克,Y元素的相对原子质量为A;化合物XY2的相对分子质量是M,则W克XY2中含有Y的原子数是( )A、 B、 C、 D、
A、①代表的是碳元素 B、②元素的原子容易失去两个电子 C、③元素与氮元素的化学性质相似 D、元素②和④组成物质的化学式为MgCl17. 已知一个SO2分子的质量为n千克,一个SO3分子的质量为m千克(设两分子中的硫原子和氧原子分别相同),若以一个氧原子质量的1/16作为相对原子质量的标准,则SO2的相对分子质量为( )A、 B、 C、 D、18. 作为相对原子质量标准的碳-12可以写成12C。1个12C的质量为a kg,1个12CO2的质量为b kg,若以12CO2中的1个氧原子质量的1/12作为相对原子质量的标准,则12CO2的相对分子质量是 ( )A、 B、 C、 D、19. X元素1个原子的质量是m克,Y元素的相对原子质量为A;化合物XY2的相对分子质量是M,则W克XY2中含有Y的原子数是( )A、 B、 C、 D、二、填空题
-
20. A是相对原子量最小的元素,B元素组成的一种单质可供人体呼吸,C元素是地壳中含量最多的金属元素,请写出相应的化学式:A元素和B元素组成的一种化合物 , C元素组成的单质。21. 元素周期表是学习和研究科学的重要工具。下表是元素周期表的一部分,据表回答问题:
 (1)、原子序数为11和17的两种元素组成的物质是生活中一种必不可少的物质,该物质是由(选填“分子”“原子”或“离子”)构成。(2)、核磁共振(NMR)技术已广泛应用于医学领域,已知只有质子数为奇数的原子才有NMR现象,表中标号为①~⑤的五种元素的原子,能产生NMR现象的是(填写元素符号)。22. 某有机物CaHb的一个分子实际质量是m千克,其中的碳原子均为碳-12原子。已知碳-12原子实际质量是n千克,则该有机物的相对分子质量是。若H原子全为质量数相同的原子,则一个H原子的实际质量是千克。23. 元素周期表将已知元素科学有序的排列起来,便于研究它们的性质和用途。据表回答问题:
(1)、原子序数为11和17的两种元素组成的物质是生活中一种必不可少的物质,该物质是由(选填“分子”“原子”或“离子”)构成。(2)、核磁共振(NMR)技术已广泛应用于医学领域,已知只有质子数为奇数的原子才有NMR现象,表中标号为①~⑤的五种元素的原子,能产生NMR现象的是(填写元素符号)。22. 某有机物CaHb的一个分子实际质量是m千克,其中的碳原子均为碳-12原子。已知碳-12原子实际质量是n千克,则该有机物的相对分子质量是。若H原子全为质量数相同的原子,则一个H原子的实际质量是千克。23. 元素周期表将已知元素科学有序的排列起来,便于研究它们的性质和用途。据表回答问题: (1)、写出由表格中③④两种元素组成的化合物的化学式。(2)、在①②③④四种元素中,化学性质相似的是。(用序号①②③④表示)(3)、有种单质,每个分子均由60个①元素原子构成,该物质的化学式为。(4)、2017年5月9日,中国科学院、国家语言文字工作委员会、全国科学技术名词审定委员会正式向社会发布113号、115号、117号、118号元素中文名称。其中113号元素的部分信息如图所示,则该元素是(填“金属”、“非金属”)24. 根据下面元素周期表,回答有关问题:
(1)、写出由表格中③④两种元素组成的化合物的化学式。(2)、在①②③④四种元素中,化学性质相似的是。(用序号①②③④表示)(3)、有种单质,每个分子均由60个①元素原子构成,该物质的化学式为。(4)、2017年5月9日,中国科学院、国家语言文字工作委员会、全国科学技术名词审定委员会正式向社会发布113号、115号、117号、118号元素中文名称。其中113号元素的部分信息如图所示,则该元素是(填“金属”、“非金属”)24. 根据下面元素周期表,回答有关问题: (1)、编号①②③④代表元素周期表中的四种元素,其中属于金属元素的是(填序号)。(2)、①处元素和②处元素形成的化合物的化学式为。25. 已知氧原子的相对原子质量为16,银原子的相对原子质量为108,若银原子的实际质量为m,则氧原子的实际质量可以表示为。26. 写出下列符号的意义或相应的符号(1)、N:.(2)、n个二氧化碳分子: .(3)、4个硫酸根离子:.(4)、铝离子:.(5)、氧化铁中铁元素为+3价.27. 下表为元素周期表的一部分,请认真阅读后,回答下列问题:
(1)、编号①②③④代表元素周期表中的四种元素,其中属于金属元素的是(填序号)。(2)、①处元素和②处元素形成的化合物的化学式为。25. 已知氧原子的相对原子质量为16,银原子的相对原子质量为108,若银原子的实际质量为m,则氧原子的实际质量可以表示为。26. 写出下列符号的意义或相应的符号(1)、N:.(2)、n个二氧化碳分子: .(3)、4个硫酸根离子:.(4)、铝离子:.(5)、氧化铁中铁元素为+3价.27. 下表为元素周期表的一部分,请认真阅读后,回答下列问题: (1)、原子序数为8的元素是 , 它位于元素周期表中的第周期,第族。(2)、原子序数为16的硫元素的相对原子质量是。(3)、金属元素名称一般有“金”字旁,固态非金属元素名称有“石”字旁,气态非金属元素名称有“气”字头。则硅元素属于(填“金属”“固态菲金属”或“气态非金属”,下同)元素,氟元素属于元素,锂元素属于元素。28. 为了便于研究元素的性质,科学家把所有的已知元素科学有序地排列起来,得到元素周期表。请阅读下列元素周期表(部分),并按要求作答。
(1)、原子序数为8的元素是 , 它位于元素周期表中的第周期,第族。(2)、原子序数为16的硫元素的相对原子质量是。(3)、金属元素名称一般有“金”字旁,固态非金属元素名称有“石”字旁,气态非金属元素名称有“气”字头。则硅元素属于(填“金属”“固态菲金属”或“气态非金属”,下同)元素,氟元素属于元素,锂元素属于元素。28. 为了便于研究元素的性质,科学家把所有的已知元素科学有序地排列起来,得到元素周期表。请阅读下列元素周期表(部分),并按要求作答。 (1)、图中位于第2周期、ⅦA族的元素,该原子的原子核内中子数为;(2)、第13号元素与地壳中含量最多的元素可组成的物质是(填化学式);(3)、第11号元素与第17号元素组成的化合物是生活中常用的调味品,构成该物质的微粒是 , (填具体微粒的符号);(4)、下列各组元素具有相似化学性质的是__________(填字母)。A、C 和Ne B、Be和Mg C、Al和Si D、F和Cl29. 下面是钠元素和氯元素在元素周期表中的信息和3种粒子的结构示意图。请回答下列问题:
(1)、图中位于第2周期、ⅦA族的元素,该原子的原子核内中子数为;(2)、第13号元素与地壳中含量最多的元素可组成的物质是(填化学式);(3)、第11号元素与第17号元素组成的化合物是生活中常用的调味品,构成该物质的微粒是 , (填具体微粒的符号);(4)、下列各组元素具有相似化学性质的是__________(填字母)。A、C 和Ne B、Be和Mg C、Al和Si D、F和Cl29. 下面是钠元素和氯元素在元素周期表中的信息和3种粒子的结构示意图。请回答下列问题: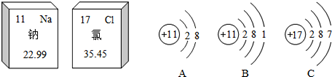 (1)、氯原子的核电荷数是;相对原子质量为。(2)、钠原子与氯原子的最本质区别是。(3)、在钠和氯气的反应中,得到电子的是原子;Na+的结构示意图是(填字母)。
(1)、氯原子的核电荷数是;相对原子质量为。(2)、钠原子与氯原子的最本质区别是。(3)、在钠和氯气的反应中,得到电子的是原子;Na+的结构示意图是(填字母)。三、解答题
-
30. 在“宏观﹣微观﹣符号”之间建立联系,是学习化学的一种重要思维方式。如图是元素周期表中部分元素的原子结构模型图,根据所学知识回答下列问题.
 (1)、A属于元素(填元素种类);(2)、D原子与钠发生化学反应时易(填“得到”或“失去”)电子;(3)、由B元素和D元素组成的化合物的化学式为;(4)、E粒子带1个单位正电荷,则该粒子的符号为;(5)、F为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 .A、原子序数Z>Y B、核外电子数:X=Y C、Y和Z的化学性质相似31. 元素周期表中,核电荷数从 1 到 18 的元素的原子结构示意图如下图。根据已有的结 构理论回答下列问题:
(1)、A属于元素(填元素种类);(2)、D原子与钠发生化学反应时易(填“得到”或“失去”)电子;(3)、由B元素和D元素组成的化合物的化学式为;(4)、E粒子带1个单位正电荷,则该粒子的符号为;(5)、F为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 .A、原子序数Z>Y B、核外电子数:X=Y C、Y和Z的化学性质相似31. 元素周期表中,核电荷数从 1 到 18 的元素的原子结构示意图如下图。根据已有的结 构理论回答下列问题: (1)、已知 M2-核外有 x 个电子,其中相对原子质量为 a,则该粒子含有的中子数为 ;(2)、1-18 号元素中,A 原子的核电荷数为 m,已知 A2-和 B3+具有相同的电子层结构,则 B 原子核中 的质子数为 ;(3)、具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有一些相似的结构和性质。 下列各组粒子中属于等电子体的是 (填字母序号);A、NO 和 O2 B、CO 和 N2 C、SO2 和 CO2 D、PO4和SO4(4)、某粒子的结构示意图
(1)、已知 M2-核外有 x 个电子,其中相对原子质量为 a,则该粒子含有的中子数为 ;(2)、1-18 号元素中,A 原子的核电荷数为 m,已知 A2-和 B3+具有相同的电子层结构,则 B 原子核中 的质子数为 ;(3)、具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有一些相似的结构和性质。 下列各组粒子中属于等电子体的是 (填字母序号);A、NO 和 O2 B、CO 和 N2 C、SO2 和 CO2 D、PO4和SO4(4)、某粒子的结构示意图 ,当 x-y=8 时,该粒子的符号为 。 32. 尿素[CO(NH2)2]和碳酸氢铵(NH4HCO3)是常见的氮肥。根据资料:某地尿素的市场价格为 2500 元/t,碳酸氢铵的市场价格为 800 元/t。若分别用 10000 元采购尿素和碳酸氢铵, 请通过计算说明哪种化肥所含氮元素的质量多?(要求写计算过程和结果)33. 不少同学爱吃的辣条被营养专家称作“垃圾食品”, 此类食品不宜多吃、常吃。这是因为在制作过程中不仅产生大量有害气体污染环境,而且食物中还会产生一些强致癌物质, 如在食物的煎炸过程中会产生一种有害物质——丙烯醛,化学式为 C2H3CHO,请计算:(1)、丙烯醛中的 C、H、O 元素的质量比是(2)、112 克丙烯醛中碳元素的质量为多少?(请写出计算过程)34. 元素周期表是学习和研究化学的重要工具。如图是元素周期表部分内容,请根据表中信息完成相关问题。
,当 x-y=8 时,该粒子的符号为 。 32. 尿素[CO(NH2)2]和碳酸氢铵(NH4HCO3)是常见的氮肥。根据资料:某地尿素的市场价格为 2500 元/t,碳酸氢铵的市场价格为 800 元/t。若分别用 10000 元采购尿素和碳酸氢铵, 请通过计算说明哪种化肥所含氮元素的质量多?(要求写计算过程和结果)33. 不少同学爱吃的辣条被营养专家称作“垃圾食品”, 此类食品不宜多吃、常吃。这是因为在制作过程中不仅产生大量有害气体污染环境,而且食物中还会产生一些强致癌物质, 如在食物的煎炸过程中会产生一种有害物质——丙烯醛,化学式为 C2H3CHO,请计算:(1)、丙烯醛中的 C、H、O 元素的质量比是(2)、112 克丙烯醛中碳元素的质量为多少?(请写出计算过程)34. 元素周期表是学习和研究化学的重要工具。如图是元素周期表部分内容,请根据表中信息完成相关问题。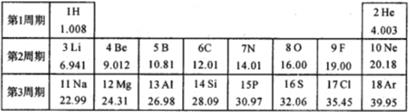 (1)、第三周期中的稀有气体元素的质子数是。(2)、元素周期表的纵行叫做族,分为主族、副族、VⅢ族和0族。主族用字母“A”来表示,共有七个主族,依次用IA族、ⅡA族、ⅢA族、ⅣA族、VA族、ⅥA族、VⅡA族表示。同主族元素化学性质相似。X²+的核外电子数目为18,则X在第四周期第族。(3)、下列各组中的两种元素具有相似化学性质的是 。A、N C B、F Cl C、Mg Al D、Ne Na(4)、核电荷数1-18的非金属元素A和B,可形成原子个数比1:1和2∶1的两种常温下的化合物,写出这两种化合物的化学式。
(1)、第三周期中的稀有气体元素的质子数是。(2)、元素周期表的纵行叫做族,分为主族、副族、VⅢ族和0族。主族用字母“A”来表示,共有七个主族,依次用IA族、ⅡA族、ⅢA族、ⅣA族、VA族、ⅥA族、VⅡA族表示。同主族元素化学性质相似。X²+的核外电子数目为18,则X在第四周期第族。(3)、下列各组中的两种元素具有相似化学性质的是 。A、N C B、F Cl C、Mg Al D、Ne Na(4)、核电荷数1-18的非金属元素A和B,可形成原子个数比1:1和2∶1的两种常温下的化合物,写出这两种化合物的化学式。四、实验探究题
-
35. 到19世纪末,经几代科学家对光合作用的不断探索,得到结论:光合作用的反应物是H2O和CO2 , 产物是O2和有机物。为了探究产物O2中的O元素的来源,科学兴趣小组从元素守恒的角度进行了如下猜想。
猜想一:O2中的O元素全部来源于CO2;
猜想二:O2中的O元素全部来自于H2O;
猜想三:O2中的O元素来源于CO2和H2O。
为了求证,他们查阅了以下资料:
资料一:范尼尔通过实验得出紫硫细菌合成有机物的反应式,与高等植物光合作用的
反应式进行比较研究后,建立了猜想。
紫硫细菌:CO2+2H2S (CH2O)(糖类)+2S+H2O
高等植物:CO2+2H2O (CH2O)(糖类)+O2+H2O
资料二:美国科学家鲁宾、卡门给三组小球藻提供含有一定比例180的水和碳酸氢盐(碳酸氢盐给小球藻的光合作用提供全部的CO2 , 而且不产生水,其他条件均相同),光照相同时间后,分别检测小球藻释放氧气中18O的比例,实验结果如表所示。(18O可作为示踪原子)
组别
水中18O的比例(%)
碳酸氢盐中18O的比例(%)
释放的氧气中18O的比例(%)|
1
0.85
0.41
0.84
2
0.85
0.55
0.85
3
0.85
0.61
0.85
资料三:
Ⅰ.16O表示中子数为 8的氧原子,18O是表示中子数为10的氧原子, 所以1个18O的质量是一个16O的质量9/8倍;自然界的氧气在标准状况下的密度为1.43千克/米3 , 其中16O占99.76% (可视为100%) ;
Ⅱ.在相同的温度和压强下,相同体积的气体具有相同的分子数。
Ⅲ.鲁宾和卡门通过测生成氧气的密度来确定氧气中18O含量。
(1)、资料一的实验结论支持猜想(选填 “一”、“二”或“三”)的观点:(2)、根据资料二鲁宾、卡门的实验结果,可得出的结论及相应的依据分别是。(3)、若有一瓶氧气,里面的氧原子全部由18O。结合资料,计算在标准状况下该瓶氧气的密度为千克/米3。36. 元素周期表是化学学习和研究的重要工具。如图所示为元素周期表的一部分: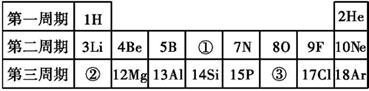 (1)、②所示元素与③所示元素的元素符号分别是和。它们在元素周期表里属于同一(选填“周期”或“族”),写出②所示元素与氧元素组成的化合物的化学式。(2)、③所示元素原子的核外电子数是 , 它在发生化学反应时容易(选填“得到”或“失去”)电子,形成的离子符号是。37. 为纪念门捷列夫制作的元素周期表问世150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表是学习化学的重要工具,它反映了元素性质的递变规律和元素之间的内在联系。如图是元素周期表一部分的电子层排布规律,我们对它们进行研究:
(1)、②所示元素与③所示元素的元素符号分别是和。它们在元素周期表里属于同一(选填“周期”或“族”),写出②所示元素与氧元素组成的化合物的化学式。(2)、③所示元素原子的核外电子数是 , 它在发生化学反应时容易(选填“得到”或“失去”)电子,形成的离子符号是。37. 为纪念门捷列夫制作的元素周期表问世150周年,联合国将2019年定为“国际化学元素周期表年”。元素周期表是学习化学的重要工具,它反映了元素性质的递变规律和元素之间的内在联系。如图是元素周期表一部分的电子层排布规律,我们对它们进行研究: (1)、第17号元素属于元素(填“金属”或“非金属”),它在化学反应中容易电子(填“得”或“失”);(2)、元素周期表中每一个横行叫做一个周期,每一个纵列叫做一个族,下列说法正确的是 。A、同一周期,各元素原子的电子层数相同 B、同一周期,各元素原子的最外层电子数相同 C、同一族,各元素原子的电子层数相同 D、同一族,各元素原子的最外层电子数相同
(1)、第17号元素属于元素(填“金属”或“非金属”),它在化学反应中容易电子(填“得”或“失”);(2)、元素周期表中每一个横行叫做一个周期,每一个纵列叫做一个族,下列说法正确的是 。A、同一周期,各元素原子的电子层数相同 B、同一周期,各元素原子的最外层电子数相同 C、同一族,各元素原子的电子层数相同 D、同一族,各元素原子的最外层电子数相同