华师大版初中科学八上第六章 第一节构成物质的微粒同步练习
试卷更新日期:2021-07-29 类型:单元试卷
一、单选题
-
1. 2021年4月,我国科学家首次合成的铀-214,是目前已知质量最小的铀原子。其相对原子质量为214,质子数是92。则铀-214原子的核外电子数为( )A、92 B、122 C、214 D、3062. 下列粒子中,能直接构成物质的是( )A、质子 B、分子 C、中子 D、电子3. 下列粒子中不能直接构成物质的是( )A、核外电子 B、原子 C、分子 D、离子4. 了解物理规律的发现过程,学会像科学家那样观察和思考,往往比掌握知识本身更重要。下列描述与事实不相符的是( )A、汤姆生发现了比原子小的多的电子 B、法拉第发现了电流周围存在磁场 C、卢瑟福提出原子核式结构模型 D、拉瓦锡通过实验测定了空气中氧气的大致含量5. 2021年4月13日,日本政府正式决定将福岛第一核电站的上百万吨核污水排入大海,多国对此表示反对。核污水中含有氚,右图为氚原子结构示意图,由图可知氚原子( )
 A、含有2个质子 B、核电荷数为1 C、相对原子质量为4 D、质子数和中子数相等6. 有一种人造氢原子(可表示为4H)的原子核中有3个中子,它可以结合成4H2分子。一个4H2分子中,下列微粒的个数不等于2的是( )A、原子 B、质子 C、中子 D、电子7. 二氧化碳和二氧化硫都是由AB2型分子构成的物质,但分子中A原子和B原子的空间位置不同,其模型如右图所示。根据此模型,下列叙述错误的是( )
A、含有2个质子 B、核电荷数为1 C、相对原子质量为4 D、质子数和中子数相等6. 有一种人造氢原子(可表示为4H)的原子核中有3个中子,它可以结合成4H2分子。一个4H2分子中,下列微粒的个数不等于2的是( )A、原子 B、质子 C、中子 D、电子7. 二氧化碳和二氧化硫都是由AB2型分子构成的物质,但分子中A原子和B原子的空间位置不同,其模型如右图所示。根据此模型,下列叙述错误的是( ) A、两种物质都由两种元素组成 B、两种物质中碳元素和硫元素化合价相同 C、两种物质的化学性质相同 D、分子中原子空间位置不同是因为A原子种类不同8. 乙烯是脐橙等水果的环保催熟气体。乙烯的分子结构如图所示,则下列说法正确的是( )
A、两种物质都由两种元素组成 B、两种物质中碳元素和硫元素化合价相同 C、两种物质的化学性质相同 D、分子中原子空间位置不同是因为A原子种类不同8. 乙烯是脐橙等水果的环保催熟气体。乙烯的分子结构如图所示,则下列说法正确的是( )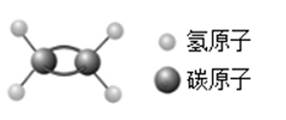 A、保持乙烯化学性质的微粒是乙烯分子 B、乙烯参与化学反应时,乙烯分子保持不变 C、乙烯分子由碳元素和氢元素组成 D、1个乙烯分子中含有2个氢分子9. 截至2020年底,“中国天眼”(FAST)已发现脉冲星超过240颗,脉冲星即旋转的中子星。在中子星,巨大的压力将核外电子压缩到原子核中,电子与质子“中和”为中子,整个中子星就是由这样的原子核紧挨在一起形成的。以下对中子的说法和对中子星的分析,错误的是( )A、中子不显电性 B、中子由夸克构成 C、中子星上存在丰富的氢离子 D、中子星的密度远大于地球10. 下列关于原子的叙述中正确的是( )A、原子的质量主要集中在核外电子上 B、核外电子对原子在化学反应中的表现有很大影响 C、所有元素的原子核都是由质子和中子构成的 D、构成原子核的质子和中子是不能再分的粒子11. 为了护航“亚运会”的环境质量,我市重点整治了工业废气、汽车尾气。下图是汽车尾气处理过程中使用催化剂发生的某个反应的微观示意图(图中一种小球代表一种元素的原子)。下列说法正确的是( )
A、保持乙烯化学性质的微粒是乙烯分子 B、乙烯参与化学反应时,乙烯分子保持不变 C、乙烯分子由碳元素和氢元素组成 D、1个乙烯分子中含有2个氢分子9. 截至2020年底,“中国天眼”(FAST)已发现脉冲星超过240颗,脉冲星即旋转的中子星。在中子星,巨大的压力将核外电子压缩到原子核中,电子与质子“中和”为中子,整个中子星就是由这样的原子核紧挨在一起形成的。以下对中子的说法和对中子星的分析,错误的是( )A、中子不显电性 B、中子由夸克构成 C、中子星上存在丰富的氢离子 D、中子星的密度远大于地球10. 下列关于原子的叙述中正确的是( )A、原子的质量主要集中在核外电子上 B、核外电子对原子在化学反应中的表现有很大影响 C、所有元素的原子核都是由质子和中子构成的 D、构成原子核的质子和中子是不能再分的粒子11. 为了护航“亚运会”的环境质量,我市重点整治了工业废气、汽车尾气。下图是汽车尾气处理过程中使用催化剂发生的某个反应的微观示意图(图中一种小球代表一种元素的原子)。下列说法正确的是( ) A、该反应前后分子种类不变 B、反应生成的两种物质分子个数之比为1:1 C、乙和丁有相同的化学性质 D、反应物和生成物中只有一种单质12. 2020年12月17日,嫦娥五号返回器携带月壤样品回到地球。月壤中蕴含He - 3,它被认为是解决未来能源问题的重要物质之一。He - 3原子核内有2个质子和1个中子。地球上的氦元素主要以He - 4形式存在。下列说法正确的是( )A、He - 3、He - 4属于同种元素 B、He - 3原子比 He -4原子少一个电子 C、He -3和 He -4的相对原子质量相同 D、He - 3、He -4的原子核内具有相同的中子数13. 十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出的分子概念 认为:
A、该反应前后分子种类不变 B、反应生成的两种物质分子个数之比为1:1 C、乙和丁有相同的化学性质 D、反应物和生成物中只有一种单质12. 2020年12月17日,嫦娥五号返回器携带月壤样品回到地球。月壤中蕴含He - 3,它被认为是解决未来能源问题的重要物质之一。He - 3原子核内有2个质子和1个中子。地球上的氦元素主要以He - 4形式存在。下列说法正确的是( )A、He - 3、He - 4属于同种元素 B、He - 3原子比 He -4原子少一个电子 C、He -3和 He -4的相对原子质量相同 D、He - 3、He -4的原子核内具有相同的中子数13. 十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出的分子概念 认为:①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;
④分子是保持物质化学性质的一种粒子;⑤分子的质量等于构成它的原子的质量之 和;
⑥分子在不停的运动。
通过你的学习,你认为上述观点中存在明显不足的是()
A、①②⑤ B、①③ C、④⑤⑥ D、③14. 微粒是构成化学物质的基础,下列对微粒的描述正确的是( )A、仅由碳原子构成的物质属于单质 B、原子中一定含有质子、中子、电子 C、金刚石是由原子构成的,所以C60也是由原子构成的 D、氯原子和氯离子的核电荷数一定相等15. 化学上常用符号“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知abXn+和cdYm﹣的电子层排布完全相同,则下列关系正确的是( )A、b﹣a=d﹣c B、a+n=c﹣m C、a﹣n=c+m D、b﹣n=d+m16. 科学家最近制得了一种新型的氧分子O4 , 下列叙述正确的是( )A、O2、O4一都是由氧元素组成的单质 B、O4分子由4个氧元素组成 C、1个O4分子由2个O2分子构成 D、O4是由O2组成的混合物17. 如图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。下列说法正确的是( ) A、该原子核外有6个电子 B、该原子的核电荷数为4 C、该原子带电 D、该原子核由2个质子和2个中子构成18. 以下说法错误的是( )A、经测定某物质中只含一种元素,则该物质不可能是化合物 B、氯原子和氯离子的差别在于质子数不同 C、钠原子在反应中失去电子形成带正电荷的钠离子 D、与分子、原子一样,离子也是构成物质的基本粒子19. 下列关于分子、原子、离子的说法中正确的是( )
A、该原子核外有6个电子 B、该原子的核电荷数为4 C、该原子带电 D、该原子核由2个质子和2个中子构成18. 以下说法错误的是( )A、经测定某物质中只含一种元素,则该物质不可能是化合物 B、氯原子和氯离子的差别在于质子数不同 C、钠原子在反应中失去电子形成带正电荷的钠离子 D、与分子、原子一样,离子也是构成物质的基本粒子19. 下列关于分子、原子、离子的说法中正确的是( )①分子是化学变化中的最小粒子;②一切原子的原子核都由质子和中子构成;③碘由碘原子构成;④分子、原子、离子都可以直接构成物质;⑤原子得失电子后形成离子;⑥原子不能再分;⑦物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变;⑧同一种元素只能组成一种单质
A、②⑤⑥⑦ B、①④⑤ C、④⑤ D、③④⑤⑧20. X、Y、Z是三种不同的元素。已知X+、Y2+、Z2-三种离子具有相同的电子数。则X、Y、Z三种元素的核电荷数大小排序应为( )A、X<Y<Z B、Z<X<Y C、Y<Z<X D、Y<X<Z二、填空题
-
21. 2020年11月24日,“嫦娥五号”探测器在海南文昌发射升空;12月2日,“嫦娥五号”着陆器和上升器组合体完成了月球钻取采样及封装;12月17日,“嫦娥五号”返回器携带月球样品等着陆地球。(1)、与地球土壤相比,月壤不含(选填序号)。
①空气 ②水分 ③矿物颗粒 ④腐殖质
(2)、月壤中有丰富的资源,尤其是可用于可控核聚变的燃料He-3。如图所示为He-3原子的结构示意图,则He-3原子核外的电子数为 , 相对原子质量为。He-3和He-4互为同位素原子,因为它们原子核内。 22. 图甲是钠在元素周期表中的部分信息,则钠原子的核电荷数为。图乙形象地表示了氯化钠的形成过程,钠原子一个电子形成阳离子,与分子、原子一样,离子也是构成物质的微粒。
22. 图甲是钠在元素周期表中的部分信息,则钠原子的核电荷数为。图乙形象地表示了氯化钠的形成过程,钠原子一个电子形成阳离子,与分子、原子一样,离子也是构成物质的微粒。 23. 结合所学知识回答有关下列问题:(1)、最近科学家成功制备了种含有铱元素(Ir)的带一个单位正电荷的离子(四氧化铱正离子)。结构模型如图所示,则该离子的符号为;
23. 结合所学知识回答有关下列问题:(1)、最近科学家成功制备了种含有铱元素(Ir)的带一个单位正电荷的离子(四氧化铱正离子)。结构模型如图所示,则该离子的符号为; (2)、考古学上常用碳-14原子测定文物年代,碳-14原子和碳-12原子在原子结构上的不同之处是 。24. 在分子、原子、质子、中子、电子、原子核这些微粒中:(1)、能保持物质化学性质的微粒有 。(2)、显示电中性的微粒有 。(3)、在同一原子里数目一定相等的是 。25. 对原子结构模型的形成,汤姆生、卢瑟福和玻尔等科学家做出了突出贡献。请根据所学完成下列 有关问题。
(2)、考古学上常用碳-14原子测定文物年代,碳-14原子和碳-12原子在原子结构上的不同之处是 。24. 在分子、原子、质子、中子、电子、原子核这些微粒中:(1)、能保持物质化学性质的微粒有 。(2)、显示电中性的微粒有 。(3)、在同一原子里数目一定相等的是 。25. 对原子结构模型的形成,汤姆生、卢瑟福和玻尔等科学家做出了突出贡献。请根据所学完成下列 有关问题。 (1)、汤姆生发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的粒子 是。(2)、1911年,卢瑟福等人进行了α粒子(α粒子是带两个单位正电荷的氦原子核)散射实验,为建立现代原子理论打下了基础。 如图a、b、c、d四条线中,不可能是α粒子在该实验中的运动轨迹的是。(3)、从原子结构模型建立的过程中,我们发现。(可多选)
(1)、汤姆生发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。汤姆生发现的粒子 是。(2)、1911年,卢瑟福等人进行了α粒子(α粒子是带两个单位正电荷的氦原子核)散射实验,为建立现代原子理论打下了基础。 如图a、b、c、d四条线中,不可能是α粒子在该实验中的运动轨迹的是。(3)、从原子结构模型建立的过程中,我们发现。(可多选)A.科学模型的建立是一个不断完善、不断修正的过程
B.模型在科学研 究中起着很重要的作用
C.玻尔原子模型的建立,使人们对原子结构的认识达到了完美的境界
D.人类借助模型的建立,对原子的认识逐渐接近本质
26. 人类对原子结构的认识,经历了汤姆生、卢瑟福和波尔等提出的模型的过程。
(1)、卢瑟福核式结构模型是利用a粒子轰击金箔实验的基础上提出的。下列能正确反映他的实验结果的示意图是(填序号)。
 (2)、从原子结构模型建立的过程'中,我们发现__________(填序号)。
(2)、从原子结构模型建立的过程'中,我们发现__________(填序号)。
A、科学模型的建立是一个不断完善、不断修正的过程
B、模型在科学研究中起着很重要的作用
C、波尔的原子模型建立,使人们对原子结构的认识达到了完美的境界
D、人类借助模型的建立,对原子的认识逐渐接近本质27. H+是结构最简单的一种阳离子,H+中含有的质子数为 , 电子数为。美国科学家在宇宙中发现了氢元素的一种新粒子,其组成可用H3+表示。在一个H3+粒子中含有个质子,个电子。28. 人们为了揭示原子结构的奥秘,经历了漫长的探究过程。1911年物理学家卢瑟福用带正电的α粒子轰击金属箔。实验发现:多数α粒子穿过金属箔后仍保持原来的运动方向,极少数α粒子发生了较大角度的偏转。 (1)、卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的。(2)、当用α粒子轰击金属箔时,图10中四条运动轨迹不可能出现的是(填字母)。29. 已知原子中:质子数(Z)+中子数(N)=质量数(A),表示X元素原子的质子数和质量数可用ZAX符号表示。据报道钬元素的原子 可有效治疗肝癌,该原子的中子数是 ,核电荷数是。现有 和 两种原子,则X和Y是否是同种元素? 。30. 将 3g 碳和 10g 氧气放入一密闭容器中,点火燃烧后,容器中的气体为(填“纯 净物”或“混合物”);已知同温同压下,气体体积之比等于分子个数之比,当恢复到原温度时,容器内的压强(填“增大”“减小”或“不变”)。
(1)、卢瑟福提出了原子的核式结构模型,认为原子的中心有一个很小的。(2)、当用α粒子轰击金属箔时,图10中四条运动轨迹不可能出现的是(填字母)。29. 已知原子中:质子数(Z)+中子数(N)=质量数(A),表示X元素原子的质子数和质量数可用ZAX符号表示。据报道钬元素的原子 可有效治疗肝癌,该原子的中子数是 ,核电荷数是。现有 和 两种原子,则X和Y是否是同种元素? 。30. 将 3g 碳和 10g 氧气放入一密闭容器中,点火燃烧后,容器中的气体为(填“纯 净物”或“混合物”);已知同温同压下,气体体积之比等于分子个数之比,当恢复到原温度时,容器内的压强(填“增大”“减小”或“不变”)。三、解答题
-
31. 探究原子结构的奥秘,19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
【进行实验】1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。

⑴放射源-放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍;
⑵金箔-作为靶子,厚度1um,重叠了3000层左右的原子;
⑶荧光屏-α粒子打在上面发出闪光;
⑷通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)、若原子质量、正电荷在原子内均匀分布,则极少数α粒子就(填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是。(2)、1um金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明________;A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的。 32. 1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验,他们用一束质量远大于电子的高速运动的α粒子轰击金箔,发现:“大多数α粒子能穿过金箔,一小部分发生偏转,少数被反弹回来”。回答下列问题。(1)、1个α粒子由两个中子和两个质子构成,则α粒子带电(填“正”或“负”)(2)、1个α粒子与一个He-4原子构成上的差别是。(3)、根据实验现象中α粒子“大多数”与“极少数”的对比分析,你能想象出关于Au原子结构的结论是。33. 小红同学在归纳总结初中化学知识时,将物质、元素、分子、原子四个概念总结为如图所示的关系。请你说出该图能反映出上述四个概念之间的哪些关系?
32. 1911年著名物理学家卢瑟福等人为探索原子的内部结构进行了如下实验,他们用一束质量远大于电子的高速运动的α粒子轰击金箔,发现:“大多数α粒子能穿过金箔,一小部分发生偏转,少数被反弹回来”。回答下列问题。(1)、1个α粒子由两个中子和两个质子构成,则α粒子带电(填“正”或“负”)(2)、1个α粒子与一个He-4原子构成上的差别是。(3)、根据实验现象中α粒子“大多数”与“极少数”的对比分析,你能想象出关于Au原子结构的结论是。33. 小红同学在归纳总结初中化学知识时,将物质、元素、分子、原子四个概念总结为如图所示的关系。请你说出该图能反映出上述四个概念之间的哪些关系? 34. H、 H、 H分别表示氢元素的三种原子,其上、下标的意义如图所示。 H、 H、 H可简写成1H、2H、3H。
34. H、 H、 H分别表示氢元素的三种原子,其上、下标的意义如图所示。 H、 H、 H可简写成1H、2H、3H。 (1)、1H、2H、3H三种原子中,数目不等(选填“质子”或“中子”或“电子”);(2)、相同分子数的2H2和3H2分别与足量O2反应全部转化成H2O,生成的质量前者(选填“大于”或“等于"或“小于”)后者。35. 伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是:一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。(1)、1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。
(1)、1H、2H、3H三种原子中,数目不等(选填“质子”或“中子”或“电子”);(2)、相同分子数的2H2和3H2分别与足量O2反应全部转化成H2O,生成的质量前者(选填“大于”或“等于"或“小于”)后者。35. 伟大的科学家费曼说:“假如只允许把人类的科学史压缩成一句话,它就会是:一切东西都是由原子构成”。人类在探索物质是由什么构成的历史长河中,充满了智慧。(1)、1803年,近代化学之父,英国科学家道尔顿(Dalton J)在前人研究的基础上,提出“道尔顿原子论”:一切物质都由原子构成,原子很小、呈圆球状、不可再分……但由于受当时实验条件限制,道尔顿无法用事实证明自己的观点。1811年,意大利化学家阿伏加德罗提出:有些物质也是由分子构成,原子的基本工作形式是分子。
1897年,汤姆森通过实验发现了电子,进一步发展了原子、分子论。汤姆森主要是纠正了“道尔顿原子论”中的观点。
1911年,卢瑟福又通过实验,推测原子是由和核外电子构成,并提出了沿用至今的现代原子结构理论。
(2)、道尔顿的原子论,不是事实的归纳,而是思维的产物,体现了直觉和想象在科学创造中的作用。在科学研究中,像汤姆森和卢瑟福这样,对实验现象进行解释的过程叫做。原子是一种看不见、摸不着的微粒,为了帮助人们理解原子的结构,这三位科学家都运用了来表达他们的理论成果。
四、实验探究题
-
36. 金属钠在氯气中燃烧时,钠原子了电子形成了带正电荷的钠离子(阳离子),氯原子电子形成了带负电荷的氯离子(阴离子)。带有相反电荷的钠离子和氯离子之间相互吸引,构成了电中性的氯化钠。
 37. 探究原子结构的奥秘,1911年英国科学家卢瑟福进行了著名的a粒子轰击金箔实验。
37. 探究原子结构的奥秘,1911年英国科学家卢瑟福进行了著名的a粒子轰击金箔实验。【实验装置】如图甲所示:
①a粒子发生器——放射性物质放出a粒子(带正电荷)质量是电子质量的7000多倍;
②金箔——作为靶子,厚度1μm,重叠了3000层左右的原子;
③探测屏——a粒子打在上面发出闪光。

[实验现象]如图乙所示:绝大多数a粒子穿过金箔后仍沿原来的方向前进,但是有少数a粒子却发生了的偏转,甚至有极少数a粒子几乎达到180°的偏转,像是被金箔弹了回来。
[分析解释]
(1)、卢瑟福推测“除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的”,其中的“很小的结构”指的是原子结构中的。支持卢瑟福推测的实验现象是。(2)、卢瑟福在分析实验结果的基础上,他提出了图丙所示的原子核式结构,卢瑟福的这一研究过程是个__________。A、建立模型的过程 B、得出结论的过程 C、提出问的过程 D、验证证据的过程38. 为进一步探究原子的结构,1911年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验。【收集证据】①绝大多数α粒子穿过金箔后仍沿原来的方向前进;②只有少数α粒子发生了的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°。
【解释与结论】
(1)、要发生大角度的散射,说明原子的大部分质量集中到了一个很小的结构且该结构带有与α粒子电性相同的电荷,这个很小的结构指的是;(2)、能说明原子内部绝大部分是空的证据是;(选填序号)(3)、根据卢瑟福的实验所产生的现象,能够获得的结论是 ;A、原子核体积很小 B、原子核质量较大 C、原子核带正电 D、核外电子带负电39. 人类对原子结构的认识永无止境。请根据所学知识回答: (1)、道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均(填“正确”或“错误”)(2)、卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由原子核和核外电子构成。如图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是个__________。A、建立模型的过程 B、得出结论的过程 C、提出问题的过程 D、验证证据的过程(3)、卢瑟福在α散射实验中(α粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是:
(1)、道尔顿最早提出原子的概念并认为原子是“不可再分的实心球体”,汤姆生认为原子是“嵌着葡萄干的面包”,如今这些观点均(填“正确”或“错误”)(2)、卢瑟福进行α粒子散射实验后,认为原子是“行星模型”,即原子是由原子核和核外电子构成。如图甲是卢瑟福用α粒子轰击原子而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是个__________。A、建立模型的过程 B、得出结论的过程 C、提出问题的过程 D、验证证据的过程(3)、卢瑟福在α散射实验中(α粒子带正电荷),断定原子中的绝大部分空间是空的,他的依据是: