备战2022 浙教版科学 中考高频考点 加强练 第78讲 金属的性质及应用
试卷更新日期:2021-07-29 类型:一轮复习
一、单选题
-
1. 小科为验证锌、铜、银三种金属的活动性顺序,设计了下列四种方案,其中合理的是( )A、
 B、
B、 C、
C、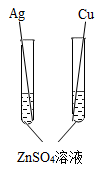 D、
D、 2. 下列有关说法正确的是( )A、O2具有助燃性 B、铁生锈属于物理变化 C、金属活动性Cu比Mg强 D、KClO3属于氧化物3. 小明将纸条分别紧紧卷在木棒和铁棒上,加热纸条(如图),木棒上的纸条立即燃烧,面铁棒上的纸条不会立即燃烧。据此推测木棒和铁棒具有不同的( )
2. 下列有关说法正确的是( )A、O2具有助燃性 B、铁生锈属于物理变化 C、金属活动性Cu比Mg强 D、KClO3属于氧化物3. 小明将纸条分别紧紧卷在木棒和铁棒上,加热纸条(如图),木棒上的纸条立即燃烧,面铁棒上的纸条不会立即燃烧。据此推测木棒和铁棒具有不同的( )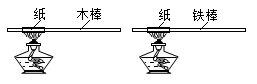 A、密度 B、导热性 C、硬度 D、延展性4. 如图所示为今年在三星堆遗址中发现的金面具残片,经测定该面具含金量约为85%。下列有关说法正确的是( )
A、密度 B、导热性 C、硬度 D、延展性4. 如图所示为今年在三星堆遗址中发现的金面具残片,经测定该面具含金量约为85%。下列有关说法正确的是( ) A、金的元素符号为aU B、金容易被锈蚀 C、金单质由金原子构成 D、金的相对原子质量为197g5. 如图所示为小嘉构建的甲、乙、丙,丁四种不同物质的关系图,“---”表示相邻的两种物质能发生反应。若甲为铁, 乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种, 则下列判断错误的是( )
A、金的元素符号为aU B、金容易被锈蚀 C、金单质由金原子构成 D、金的相对原子质量为197g5. 如图所示为小嘉构建的甲、乙、丙,丁四种不同物质的关系图,“---”表示相邻的两种物质能发生反应。若甲为铁, 乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种, 则下列判断错误的是( )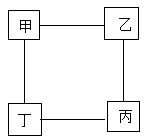 A、乙可能是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙不可能是稀H2SO46. 将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,能迅速比较出铁、铜金属活动性强弱的是( )A、蒸馏水 B、稀硫酸 C、硫酸钠溶液 D、氢氧化钠溶液7. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示气(已知甲、乙、丙在生成物中均显+2价)。则下列说法正确的是( )
A、乙可能是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙不可能是稀H2SO46. 将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,能迅速比较出铁、铜金属活动性强弱的是( )A、蒸馏水 B、稀硫酸 C、硫酸钠溶液 D、氢氧化钠溶液7. 现有质量相等的甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,生成氢气的质量与反应时间的关系如图所示气(已知甲、乙、丙在生成物中均显+2价)。则下列说法正确的是( )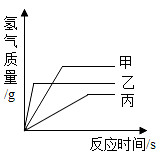 A、甲、乙、丙依次可能是Mg、Zn、Fe B、金属活动性:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙8. 2020年11月11日,中国的深海潜航器奋斗者号成功坐底10909米,创造了一项世界纪录。奋斗者号的成功,说明我国在钛合金材料的制造上有了较大突破。从物质分类角度判断,钛合金属于( )A、金属 B、非金属 C、氧化物 D、混合物9. 用等质量的锌、铁、镁三种金属分别与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( )
A、甲、乙、丙依次可能是Mg、Zn、Fe B、金属活动性:甲>乙>丙 C、相对原子质量:乙>丙>甲 D、消耗硫酸的质量:甲>乙>丙8. 2020年11月11日,中国的深海潜航器奋斗者号成功坐底10909米,创造了一项世界纪录。奋斗者号的成功,说明我国在钛合金材料的制造上有了较大突破。从物质分类角度判断,钛合金属于( )A、金属 B、非金属 C、氧化物 D、混合物9. 用等质量的锌、铁、镁三种金属分别与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是( ) A、反应后可能没有剩余的金属是锌和铁 B、反应后不一定有剩余的金属是镁 C、根据图像分析,金属镁产生氢气最多 D、曲线X、Y、Z分别表示锌、铁、镁的反应情况10. 下列符号所表示的元素全部为金属元素的( )A、Fe、Zn、Cl B、Al、Si 、Ca C、Mg、Cu、Hg D、S. P. C11. 记忆合金可在一定温度下拉成矫形弓丝,用以牙齿矫形,这主要利用了该合金的( )A、导热性 B、延展性 C、还原性 D、导电性12. 将等质量的甲、乙两金属分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系如图所示。关于甲、乙两金属,下列判断合理的是( )
A、反应后可能没有剩余的金属是锌和铁 B、反应后不一定有剩余的金属是镁 C、根据图像分析,金属镁产生氢气最多 D、曲线X、Y、Z分别表示锌、铁、镁的反应情况10. 下列符号所表示的元素全部为金属元素的( )A、Fe、Zn、Cl B、Al、Si 、Ca C、Mg、Cu、Hg D、S. P. C11. 记忆合金可在一定温度下拉成矫形弓丝,用以牙齿矫形,这主要利用了该合金的( )A、导热性 B、延展性 C、还原性 D、导电性12. 将等质量的甲、乙两金属分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系如图所示。关于甲、乙两金属,下列判断合理的是( ) A、铁、镁 B、锌、镁 C、锌、铁 D、铁、锌13. 溴元素的原子结构示意图及其在周期表中的信息如图所示,下列说法正确的是( )
A、铁、镁 B、锌、镁 C、锌、铁 D、铁、锌13. 溴元素的原子结构示意图及其在周期表中的信息如图所示,下列说法正确的是( )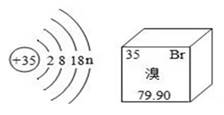 A、n=7 B、该元素为金属元素 C、相对原子质量和中子数均为35g D、原子序数、核电荷数、质子数均为79.9014. 人类用于制造触屏材料的铟,相关信息如图,下列说法中正确的是( )
A、n=7 B、该元素为金属元素 C、相对原子质量和中子数均为35g D、原子序数、核电荷数、质子数均为79.9014. 人类用于制造触屏材料的铟,相关信息如图,下列说法中正确的是( ) A、铟是一种非金属元素 B、原子的核电荷数为49 C、与其他元素根本区别是中子数不同 D、相对原子质量是114.8g15. 兴趣小组按如图流程进行实验(每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,下列说法不正确的是( )
A、铟是一种非金属元素 B、原子的核电荷数为49 C、与其他元素根本区别是中子数不同 D、相对原子质量是114.8g15. 兴趣小组按如图流程进行实验(每步均充分反应),反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象,下列说法不正确的是( )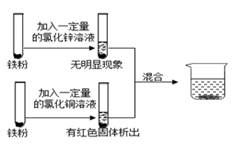 A、由实验可判断出铁、铜、锌的活动性顺序 B、两支试管混合后,固体总质量一定增加 C、滤液中的溶质一定有FeCl2、ZnCl2和CuCl2 D、滤渣中一定有Cu,一定没有Fe和Zn16. 将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是( )A、
A、由实验可判断出铁、铜、锌的活动性顺序 B、两支试管混合后,固体总质量一定增加 C、滤液中的溶质一定有FeCl2、ZnCl2和CuCl2 D、滤渣中一定有Cu,一定没有Fe和Zn16. 将质量相等的Mg、Al、Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能的是( )A、 B、
B、 C、
C、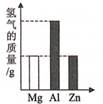 D、
D、 17. 将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )
17. 将等质量的镁、铁、锌,分别放入三份质量分数相同的稀盐酸中,反应生成的氢气质量与反应时间的关系如图所示。根据图中信息,下列判断正确的是( )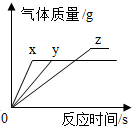 A、图线 Y 表示镁的反应情况 B、镁一定过量 C、锌一定过量 D、镁消耗稀盐酸的质量最大 试题卷 Ⅱ18. “愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是( )
A、图线 Y 表示镁的反应情况 B、镁一定过量 C、锌一定过量 D、镁消耗稀盐酸的质量最大 试题卷 Ⅱ18. “愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是( )①比较质量,质量大的是“愚人金”
②灼烧,表面变色的是“愚人金”
③浸没在稀硫酸中,表面有气泡的是“愚人金”
④浸没在硫酸锌溶液中,表面附着红色物质的是“愚人金”
A、②③ B、②④ C、①③ D、①④19. 如图是探究铁钉锈蚀条件的 4 个实验,一段时间后观察现象。下列说法不.正.确.的是( ) A、③中附着在棉花上的氯化钙的作用是作干燥剂 B、①②对比说明铁生锈需要空气 C、①中甲、乙、丙三处比较,生锈最明显的地方是丙 D、四个实验中,生锈最快的是④中的铁钉20. 如图所示为人们总结出来的常见金属的活动性顺序,下列有关说法错误的是( )
A、③中附着在棉花上的氯化钙的作用是作干燥剂 B、①②对比说明铁生锈需要空气 C、①中甲、乙、丙三处比较,生锈最明显的地方是丙 D、四个实验中,生锈最快的是④中的铁钉20. 如图所示为人们总结出来的常见金属的活动性顺序,下列有关说法错误的是( )
金属活动性由强逐渐减弱
A、常温下,铝制品比铁制品更容易腐蚀 B、排在氢前面的金属可以把酸里的氢置换出来 C、排在前面的金属可以将后面的金属从其盐溶液中置换出来 D、铜器时代早于铁器时代,这与两种金属的活动性有一定关系二、填空题
-
21. 2021年3月,四川三星堆遗址进行了新一轮考古发掘。至今三星堆已出土了黄金面具、青铜纵目面具等一批珍贵文物,如图。
 (1)、出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜(选填“强”或“弱”)。(2)、古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜 (CuFeS2),其中铁元素和铜元素均为+2价,硫元素的化合价为 。(3)、应用碳-14测出三星堆遗址距今3000年左右,碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中 数不同。22. 近年我省多地纷纷开展文明城市创建工作,垃圾分类回收是其中一项重要举措,我县街头垃圾桶如图所示,回答下列问题:
(1)、出土的黄金面具仍金光灿灿,而青铜纵目面具已锈迹斑斑,这说明金的活动性比铜(选填“强”或“弱”)。(2)、古代制作青铜器的铜来源于铜矿,如黄铜矿。黄铜矿的主要成分为二硫化亚铁铜 (CuFeS2),其中铁元素和铜元素均为+2价,硫元素的化合价为 。(3)、应用碳-14测出三星堆遗址距今3000年左右,碳-12和碳-14是碳元素的两种同位素原子,它们的主要区别是原子核中 数不同。22. 近年我省多地纷纷开展文明城市创建工作,垃圾分类回收是其中一项重要举措,我县街头垃圾桶如图所示,回答下列问题:
 (1)、图中标示的物质中,属于金属材料的是(写出1种)(2)、塑料矿泉水瓶应放入(填“可回收”或“不可回收”)筒中。(3)、内筒铝合金具有密度小,硬度大,具有一定的抗腐蚀等特性。但需要恰当使用,如铝与稀盐酸易反应:2Al+6HCl=2AlCl3+3H2↑,该反应属于化学反应基本类型中的。23. 铝是日常生活中常见的金属,请根据所学知识回答下列问题:.(1)、Al和CuSO4溶液反应的化学方程式为 。(2)、生活中铝比铁更耐腐蚀的原因是 (用化学反应方程式表示)。24. 金属在生产和生活中应用广泛。(1)、下列属于铁合金的是 (选填字母)。A、铁锈 B、纯铁 C、不锈钢(2)、某化工厂的废液中含有硝酸银、硝酸亚铁和硝酸锌。兴趣小组的同学们取适量的上述废液样品,将一定质量的镁粉加入样品中,充分反应后过滤,得到滤液和滤渣。
(1)、图中标示的物质中,属于金属材料的是(写出1种)(2)、塑料矿泉水瓶应放入(填“可回收”或“不可回收”)筒中。(3)、内筒铝合金具有密度小,硬度大,具有一定的抗腐蚀等特性。但需要恰当使用,如铝与稀盐酸易反应:2Al+6HCl=2AlCl3+3H2↑,该反应属于化学反应基本类型中的。23. 铝是日常生活中常见的金属,请根据所学知识回答下列问题:.(1)、Al和CuSO4溶液反应的化学方程式为 。(2)、生活中铝比铁更耐腐蚀的原因是 (用化学反应方程式表示)。24. 金属在生产和生活中应用广泛。(1)、下列属于铁合金的是 (选填字母)。A、铁锈 B、纯铁 C、不锈钢(2)、某化工厂的废液中含有硝酸银、硝酸亚铁和硝酸锌。兴趣小组的同学们取适量的上述废液样品,将一定质量的镁粉加入样品中,充分反应后过滤,得到滤液和滤渣。①若滤液为浅绿色,则滤液中除Fe(NO3)2外,一定含有的溶质还有。
②所得滤液的质量与废液样品的质量相比一定减小,其原因是。
25. 铁在潮湿空气中易生锈,其反应过程如下:
 (1)、步骤②中的反应物除Fe(OH)2外,还有(选填“O2”“H2O”或“O2和H2O”)。(2)、已知步骤③为分解反应,若x 为 2,则此分解反应的化学方程式为。26. 铜、铁、铝是生活中常见的金属,请回答:
(1)、步骤②中的反应物除Fe(OH)2外,还有(选填“O2”“H2O”或“O2和H2O”)。(2)、已知步骤③为分解反应,若x 为 2,则此分解反应的化学方程式为。26. 铜、铁、铝是生活中常见的金属,请回答: (1)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的。(2)、用等质量的锌、铁、镁三种金属分別与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是 (填字母)。A、曲线X、Y、Z分别表示锌、铁、镁的反应情况 B、反应后一定有剩余的金属是镁 C、反应后可能没有剩余的金属是锌和铁 D、三份盐酸均反应完27. 社会发展离不开金属材料,如硬铝是制作飞机机翼的材料,其主要成分为铝和铜等。现将一定量的硬铝粉末放入硝酸银溶液中,充分反应后,溶液呈蓝色,写出导致溶液呈蓝色的反应的化学方程式 , 此时溶液中一定有的溶质是(用化学式表示)。28. 铁、锌、镁是生活中常见的金属,请回答:
(1)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中的。(2)、用等质量的锌、铁、镁三种金属分別与三份溶质质量分数相同的稀盐酸充分反应。产生氢气的质量与反应时间的关系如图所示。下列说法中正确的是 (填字母)。A、曲线X、Y、Z分别表示锌、铁、镁的反应情况 B、反应后一定有剩余的金属是镁 C、反应后可能没有剩余的金属是锌和铁 D、三份盐酸均反应完27. 社会发展离不开金属材料,如硬铝是制作飞机机翼的材料,其主要成分为铝和铜等。现将一定量的硬铝粉末放入硝酸银溶液中,充分反应后,溶液呈蓝色,写出导致溶液呈蓝色的反应的化学方程式 , 此时溶液中一定有的溶质是(用化学式表示)。28. 铁、锌、镁是生活中常见的金属,请回答: (1)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中 的水蒸气和氧气,生成氢氧化亚铁等物质。该过程主要发生了变化。(2)、三份完全相同的稀盐酸分别与一定质量的锌、铁、镁充分反应,产生氢气的质量与反应时间的关系如图所示。下列说法中不正确的是 。A、曲线 X、Y、Z 分别表示镁、锌、铁的反应情况 B、三份稀盐酸可能都被完全反应 C、三种金属的质量关系一定是 m 镁<m 锌<m 铁 D、反应结束后铁、锌和镁一定都没有剩余29. 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni) ,伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。(1)、铸造以上硬币用到的材料都是(填“合成材料”或“金属材料”)。(2)、选择铸造硬币的材料不需要考虑的因素是 (填序号)。A、金属的导电性 B、金属的耐腐蚀性 C、金属的硬度 D、金属价格与硬币面值的吻合度(3)、以上硬币涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应:
(1)、“双吸剂”的主要成分是还原铁粉,常用于食品保鲜,其原因是铁粉能吸收空气中 的水蒸气和氧气,生成氢氧化亚铁等物质。该过程主要发生了变化。(2)、三份完全相同的稀盐酸分别与一定质量的锌、铁、镁充分反应,产生氢气的质量与反应时间的关系如图所示。下列说法中不正确的是 。A、曲线 X、Y、Z 分别表示镁、锌、铁的反应情况 B、三份稀盐酸可能都被完全反应 C、三种金属的质量关系一定是 m 镁<m 锌<m 铁 D、反应结束后铁、锌和镁一定都没有剩余29. 我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍(Ni) ,伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。(1)、铸造以上硬币用到的材料都是(填“合成材料”或“金属材料”)。(2)、选择铸造硬币的材料不需要考虑的因素是 (填序号)。A、金属的导电性 B、金属的耐腐蚀性 C、金属的硬度 D、金属价格与硬币面值的吻合度(3)、以上硬币涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应:Ni+H2SO4=NiSO4+H2↑ Fe+NiCl2=Ni+FeCl2
四种金属活动性由强到弱的顺序为(用元素符号表示)。
30. 向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入6.5克Zn,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到的质量为6.5克。取反应后的滤液观察,滤液 (填“一定”、“一定不”或“可能”)呈蓝色,滤渣中的物质一定有。31. 为了提高原料的利用率,现从含有金属镁、铁、铜的粉末中分离和提取出重要化工原料MgSO4和有关金属, 实验过程如下: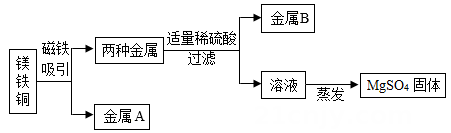 (1)、金属B是。(2)、写出上述实验过程中发生反应的化学方程式。32. 金属材料与人类的生产和生活密切相关。请回答:(1)、为了验证铝、铜、银三种金属的活动性顺序,设计了下列六种方案,其中可行的是序号)。①将铝、银分别浸入到硫酸铜溶液中:②将银分别浸入到硫酸铝、硫酸铜溶液中;③将铜、银分别浸入到硫酸铝溶液中;④将铜分别浸入到硫酸铝、硝酸银溶液中;⑤将等体积的三种金属打磨后分别与氧气反应,比较剧烈程度,⑥将铝和铜分别表入硝酸银溶液,再将铝和铜分别浸入稀盐酸溶液中(2)、在氯化铜和氯化亚铁的的溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和无色滤液。滤液中一定含有的溶质是(填化学式)33. 金属材料与人类的生产和生活密切相关.请回答:(1)、下列用品中,主要利用金属导热性的是 .A、铂金饰品 B、铁锅 C、铝导线(2)、自行车构件中的支架是铁制品,为防止它锈蚀,可在其表面刷漆,其防锈的原理是 .(3)、有X、Y、Z三种金属,它们具有如下性质:
(1)、金属B是。(2)、写出上述实验过程中发生反应的化学方程式。32. 金属材料与人类的生产和生活密切相关。请回答:(1)、为了验证铝、铜、银三种金属的活动性顺序,设计了下列六种方案,其中可行的是序号)。①将铝、银分别浸入到硫酸铜溶液中:②将银分别浸入到硫酸铝、硫酸铜溶液中;③将铜、银分别浸入到硫酸铝溶液中;④将铜分别浸入到硫酸铝、硝酸银溶液中;⑤将等体积的三种金属打磨后分别与氧气反应,比较剧烈程度,⑥将铝和铜分别表入硝酸银溶液,再将铝和铜分别浸入稀盐酸溶液中(2)、在氯化铜和氯化亚铁的的溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和无色滤液。滤液中一定含有的溶质是(填化学式)33. 金属材料与人类的生产和生活密切相关.请回答:(1)、下列用品中,主要利用金属导热性的是 .A、铂金饰品 B、铁锅 C、铝导线(2)、自行车构件中的支架是铁制品,为防止它锈蚀,可在其表面刷漆,其防锈的原理是 .(3)、有X、Y、Z三种金属,它们具有如下性质:①X、Z均不与稀盐酸反应②Y+2HCl═YCl2+H2↑③X+Z(NO3)2═X(NO3)2+Z则X、Y、Z三种金属活动性由强到弱的顺序是 .
34. 不锈钢产品在生活中应用广泛,不锈钢中含有铁、碳、硅和锰等元素。(1)、不锈钢产品不易锈蚀,其采用的防锈蚀的方法是。(2)、把铁矿石炼成钢铁是一个复杂的过程,可以利用氢气和铁矿石在高温下反应来完成,主要的化学方程式如下: Fe2O3+3H22Fe+3H2O ,这个反应属于基本反应类型中的反应,反应过程中体现了氢气具有性。35. 小柯进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定质量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。(1)、若反应后所得滤液呈无色,则滤渣中一定含有。(2)、反应后所得溶液与原硝酸银溶液的质量相比,质量(填“变大”,“变小”,“无法确定”)(3)、非金属单质也具有类似金属与盐溶液之间反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来。如在溶液中可发生下列反应: Cl2+2NaBr=2NaCl+Br2 , I2+Na2S=2NaI+S↓;Br2+2KI=2KBr+I2。由此可以判断非金属单质S、Cl2、I2、Br2活动性由强到弱顺序是。三、实验探究题
-
36. 学习了金属的性质之后,同学们决定用实验对铁、铝、铜三种金属的活动性顺序进行验证。请回答:
(一)验证实验
(1)、将两根粗细相同的、打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中,过一会儿取出铁丝,观察到就能得出三种金属的活动性顺序为:铝>铁>铜。(2)、将铁丝插入硫酸铜溶液中时,除了上述观象,同学们还发现容液中有较多气泡放出。为了确定生成了什么气体,同学们决定继续进行探究。[建立猜想]放出的气体可能是SO2、O2、H2的一种或几种。
[查阅资料]SO2易溶于水,化学性质与二氧化碳相似,也能使澄清石灰水变浑油,生成CaSO3
[方案设计]依据上述猜想,同学们分别设计了如下方案:
甲同学认为气体是O2 , 检验方法是 , 经检验不是O2。对于另两种气体的验证,同学合作设计了如图组合实验方案:
 (3)、实验开始时,先将收集到的气体从A通入一段时间后,再点燃C处酒精灯;这样操作的目的是。(4)、实验过程中根据现象,可以得出结论:铝丝与硫酸铜溶液反应时,产生的气体是氢气,硫酸铜溶液中可能含有酸。37. 某小组对纯铁丝与浓硫酸反应后的产物进行了验证。
(3)、实验开始时,先将收集到的气体从A通入一段时间后,再点燃C处酒精灯;这样操作的目的是。(4)、实验过程中根据现象,可以得出结论:铝丝与硫酸铜溶液反应时,产生的气体是氢气,硫酸铜溶液中可能含有酸。37. 某小组对纯铁丝与浓硫酸反应后的产物进行了验证。已知:2Fe+6H2SO4(浓)=Fe2(SO4)3+3SO2↑+6H2O,SO2能使品红溶液褪色。

 (1)、B和C位置连接品红溶液和无水硫酸铜装置接口顺序是e→→L。(2)、将反应后的溶液稀释,取稀释液滴加足量的NaOH溶液,观察到现象时,证明有Fe2(SO4)3存在。(3)、装置D的作用是。(4)、将装置末端的气体经干燥后,依次通过灼热的氧化铜和无水硫酸铜粉末,发现氧化铜粉末变成红色,同时无水硫酸铜粉末变成蓝色。分析其原因可能是。38. 在学习了金属与酸之间的反应后,为进一步探究温度对金属与酸反应速度的影响。小明用如图所示装置进行实验。
(1)、B和C位置连接品红溶液和无水硫酸铜装置接口顺序是e→→L。(2)、将反应后的溶液稀释,取稀释液滴加足量的NaOH溶液,观察到现象时,证明有Fe2(SO4)3存在。(3)、装置D的作用是。(4)、将装置末端的气体经干燥后,依次通过灼热的氧化铜和无水硫酸铜粉末,发现氧化铜粉末变成红色,同时无水硫酸铜粉末变成蓝色。分析其原因可能是。38. 在学习了金属与酸之间的反应后,为进一步探究温度对金属与酸反应速度的影响。小明用如图所示装置进行实验。可供选择的药品及器材:溶质质量分数为9.8%的稀硫酸、薄铁片、量筒、剪刀、秒表、天平、温度计、酒精灯等;
老师对实验的建议:①为减少反应放热对溶液温度的影响,每组实验铁片的质量取0.5克。
②铁片放人布袋内;
③实验至少设计3组;
④实验中采用水浴加热的方式控制反应的温度;
(1)、该装置中的铜丝可,上下拉动,其作用是。(2)、结合老师建议,补充完整实验①之后的其它步骤。①检查装置气密性;
……
 39. 人类文明进步与金属材料发展关系十分密切。(1)、炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如图 1:步骤2反应中体现出焦炭的性。(选填“氧化”或“还原”)
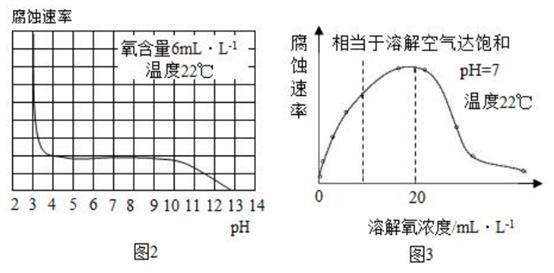
39. 人类文明进步与金属材料发展关系十分密切。(1)、炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如图 1:步骤2反应中体现出焦炭的性。(选填“氧化”或“还原”)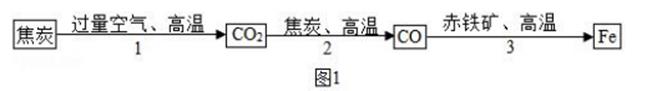 (2)、研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到图 2、图 3 资料。
(2)、研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到图 2、图 3 资料。①图2表示水样温度22℃、氧含量6mL/L时,钢铁腐蚀速率与水样pH的关系。当pH<4时,随pH值减小,钢铁腐蚀速率明显增大的原因是。
②图3表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超20mL/L时,钢铁腐蚀速率明显下降的原因可能是。
 40. 为了探究铁生锈的条件,某实验小组的同学用下列装置进行实验。
40. 为了探究铁生锈的条件,某实验小组的同学用下列装置进行实验。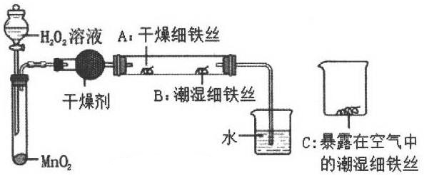 (1)、检查装置的气密性:连接好装置,关闭分液漏斗的活塞,微热试管,说明气密性良好的现象是;(2)、加入药品,4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,C处铁丝依然光亮。A、B处实验现象对比说明铁生锈主要与有关;B、C处实验现象对比说明铁生锈的快慢与有关;(3)、写出一种防止铁生锈的方法。
(1)、检查装置的气密性:连接好装置,关闭分液漏斗的活塞,微热试管,说明气密性良好的现象是;(2)、加入药品,4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,C处铁丝依然光亮。A、B处实验现象对比说明铁生锈主要与有关;B、C处实验现象对比说明铁生锈的快慢与有关;(3)、写出一种防止铁生锈的方法。四、解答题
-
41. 2020年11月10日,中国“奋斗者”号载人潜水器在“地球第四极”— —马里亚纳海沟成功坐底,坐底深度10909米,创造了中国载人深潜的新纪录。本次万米深潜任务成功的一大亮点是采用了许多自主研发的国产新材料
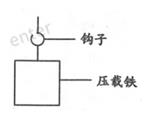 (1)、“奋斗者”号采用的钛合金材料强度高、韧性好、耐腐蚀,与下列哪种材料类型相同?
(1)、“奋斗者”号采用的钛合金材料强度高、韧性好、耐腐蚀,与下列哪种材料类型相同?①塑料 ②不锈钢 ③玻璃
(2)、“奋斗者”号下潜时,外部携带了4块压载铁,总质量将近2吨。压载铁被悬挂的模型如右图所示。试计算4块压载铁水下浸没时对“奋斗者”号的作用力约为多少?(压载铁的密度近似为8×103千克/米3 , 海水的密度近似为水的密度)(3)、完成水下作业之后,“奋斗者”号抛去压载铁上浮。为了使“奋斗者”号在深海有足够大的浮力返航,采用了一种新的固体浮力材料,由大量纳米级大小的空气玻璃微珠组成。为了满足设计需求,该材料需要具备怎样的性质?(答出一点即可)42. 为落实公交优先发展战略,嘉兴开展了有轨电车建设,如图为嘉兴有轨电车的效果图。其中嘉兴南站一安乐路的有轨电车将于今年6月底试运行,该线全长约20千米,单车座位约250人,全程运行平均速度可达24千米/小时。 (1)、为防止钢轨生锈,要在钢轨上喷涂防锈涂料。该防锈方法的原理是。(2)、有轨电车运行后,电车从嘉兴南站出发车行驶到安乐路站,全程约需要多少时间?(3)、已知某50座的燃油大客车每百公里耗油20L,燃烧1升汽油排放二氧化碳2.4千克。若有轨电车从嘉兴南站到安乐路站运行一趟所坐满的乘客全由该大客车来运输,使用有轨电车可减少二氧化碳排放多少千克?(假设有轨电车不排放二氧化碳)43. 科学课上老师演示了锌与稀硫酸反应的实验,同学们观察实验现象并对实验后的溶液进行了探究,请回答下列问题。(1)、实验中观察到产生气泡的速度先变快后变慢,可能的原因是。(2)、同学们先用pH试纸测反应后的溶液,发现pH试纸变红;再向该溶液中逐滴滴入氢氧化钡溶液,立即产生白色沉淀。某同学认为刚开始产生的沉淀不可能是氢氧化锌,其理由是。44. 某金属混合物的主要成分是锌、铁和铜,课外兴趣小组将500克稀硫酸溶液不断加到50克金属混合物中得到如下数据:
(1)、为防止钢轨生锈,要在钢轨上喷涂防锈涂料。该防锈方法的原理是。(2)、有轨电车运行后,电车从嘉兴南站出发车行驶到安乐路站,全程约需要多少时间?(3)、已知某50座的燃油大客车每百公里耗油20L,燃烧1升汽油排放二氧化碳2.4千克。若有轨电车从嘉兴南站到安乐路站运行一趟所坐满的乘客全由该大客车来运输,使用有轨电车可减少二氧化碳排放多少千克?(假设有轨电车不排放二氧化碳)43. 科学课上老师演示了锌与稀硫酸反应的实验,同学们观察实验现象并对实验后的溶液进行了探究,请回答下列问题。(1)、实验中观察到产生气泡的速度先变快后变慢,可能的原因是。(2)、同学们先用pH试纸测反应后的溶液,发现pH试纸变红;再向该溶液中逐滴滴入氢氧化钡溶液,立即产生白色沉淀。某同学认为刚开始产生的沉淀不可能是氢氧化锌,其理由是。44. 某金属混合物的主要成分是锌、铁和铜,课外兴趣小组将500克稀硫酸溶液不断加到50克金属混合物中得到如下数据:次数
第1次
第2次
第3次
第4次
第5次
加入稀硫酸溶液的质量/克
100
100
100
100
100
剩余固体的质量/克
37
24.9
a
3
3
(1)、表格中“a”的值为;(2)、其所用稀硫酸溶液的溶质质量分数为多少?(3)、第2次反应结束后,溶液中含有的溶质有。45. 黄铜(铜和锌的合金)具有较强的耐磨性能,在明代嘉靖年间便被用于铸钱,现代常用于制造阀门、水管、空调散热器等。现有黄铜样品 A,为测得各成分的含量,小科将其放入烧杯中,取 80 克稀硫酸分四次等质量加入,每次均充分反应,实验过程数据记录如下表:实验次数
1
2
3
4
加入稀硫酸质量/克
20
20
20
20
剩余固体质量/克
20.0
17.4
14.8
13.5
请分析计算:
(1)、样品 A 的质量是克。(2)、第 4 次实验结束后溶液的 pH7(填“>”、“=”或“<”)。(3)、稀硫酸的溶质质量分数是多少?(4)、实验完成后,烧杯中溶液的质量是多少?五、综合说理题
-
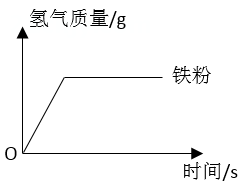
46. 在相同条件下,取相等质量的铁片、铁粉和锌粉,分别与足量的等质量分数的盐酸充分反应。根据实验测定:其中铁粉与盐酸反应产生氢气的质量随反应时间变化如图所示。请在原图中画出铁片、锌粉与盐酸反应产生氢气的质量随反应时间变化的大致曲线,并用科学原理加以解释。