备战2022 浙教版科学 中考高频考点 加强练 第74讲 碱的性质及其用途
试卷更新日期:2021-07-29 类型:一轮复习
一、单选题
-
1. 取稀盐酸与氢氧化钠反应后的溶液进行实验下列能说明稀盐酸、氢氧化钠恰好都完全反应的是( )A、加硝酸银溶液,有白色沉淀生成 B、加氢氧化镁固体,固体全部溶解 C、加酚酞试液,溶液显红色 D、测定溶液的pH,刚好显中性2. 稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,下列操作及实验现象(或结果),不能证明反应发生的是( )
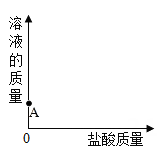
 A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH等于73. 一定温度下,向ag FeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如图所示。下列叙述错误的是( )
A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH等于73. 一定温度下,向ag FeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如图所示。下列叙述错误的是( ) A、P点对应的溶液中NaOH达到饱和状态 B、加入 ngNaOH时,NaOH固体和FeCl3溶液恰好完全反应 C、m>c-a D、生成Fe(OH)3的质量为(b-a)g4. 下列关于酸、碱的说法错误的是( )A、苛性钠、纯碱、火碱都是氢氧化钠 B、氢氧化钙可以用来改良酸性土壤 C、稀盐酸能够使紫色石蕊试液变红 D、生活中许多常见的物质(如柠檬、柑橘)中含有酸5. 蚂蚁等昆虫叮咬人时,会向人体注入一种物质R,使皮肤红肿。实验测定物质R呈酸性,由此推断,要消除红肿,可涂抹下列物质中的( )A、食醋 B、肥皂水 C、浓氢氧化钠溶液 D、稀盐酸6. 如图所示是硫酸和氢氧化钠溶液反应时pH的变化图象,下列说法正( )
A、P点对应的溶液中NaOH达到饱和状态 B、加入 ngNaOH时,NaOH固体和FeCl3溶液恰好完全反应 C、m>c-a D、生成Fe(OH)3的质量为(b-a)g4. 下列关于酸、碱的说法错误的是( )A、苛性钠、纯碱、火碱都是氢氧化钠 B、氢氧化钙可以用来改良酸性土壤 C、稀盐酸能够使紫色石蕊试液变红 D、生活中许多常见的物质(如柠檬、柑橘)中含有酸5. 蚂蚁等昆虫叮咬人时,会向人体注入一种物质R,使皮肤红肿。实验测定物质R呈酸性,由此推断,要消除红肿,可涂抹下列物质中的( )A、食醋 B、肥皂水 C、浓氢氧化钠溶液 D、稀盐酸6. 如图所示是硫酸和氢氧化钠溶液反应时pH的变化图象,下列说法正( ) A、图中a点所示溶液中,含有的溶质是硫酸钠和硫酸 B、图中b点时,硫酸和氢氧化钠恰好完全反应 C、图中c点所示溶液呈碱性 D、该实验是将氢氧化钠溶液滴到硫酸溶液中7. 下列选项中所列物质均不会和NaOH溶液反应的一组是( )A、HNO3、NO、SO2、HCl、KCl B、KNO3、NaCl、NH4Cl、NO2、SO2 C、KOH、BaCl2、KCl、NaNO3 D、K2CO3、K2SO4、CuCl2、NaNO38. 向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是( )
A、图中a点所示溶液中,含有的溶质是硫酸钠和硫酸 B、图中b点时,硫酸和氢氧化钠恰好完全反应 C、图中c点所示溶液呈碱性 D、该实验是将氢氧化钠溶液滴到硫酸溶液中7. 下列选项中所列物质均不会和NaOH溶液反应的一组是( )A、HNO3、NO、SO2、HCl、KCl B、KNO3、NaCl、NH4Cl、NO2、SO2 C、KOH、BaCl2、KCl、NaNO3 D、K2CO3、K2SO4、CuCl2、NaNO38. 向盛有稀盐酸的烧杯中逐滴加入NaOH溶液,测得烧杯中溶液的pH变化如图所示,下列说法正确的是( ) A、a点所示的溶液中含有的溶质是NaOH和NaCl B、a、b、c所示的溶液中都含有Na+、Cl﹣ C、c点表示NaOH和稀盐酸恰好完全反应 D、b点所示的溶液能使紫色石蕊溶液变红9. Al(OH)3是用途广泛的难溶性固体,可用NaOH溶液来制取,但又可溶于NaOH溶液: AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O,现向一定质量的AlCl3溶液中逐滴加入NaOH溶液,实验现象如图所示,对图象理解错误的是( )
A、a点所示的溶液中含有的溶质是NaOH和NaCl B、a、b、c所示的溶液中都含有Na+、Cl﹣ C、c点表示NaOH和稀盐酸恰好完全反应 D、b点所示的溶液能使紫色石蕊溶液变红9. Al(OH)3是用途广泛的难溶性固体,可用NaOH溶液来制取,但又可溶于NaOH溶液: AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2(偏铝酸钠)+2H2O,现向一定质量的AlCl3溶液中逐滴加入NaOH溶液,实验现象如图所示,对图象理解错误的是( )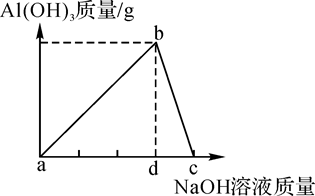 A、b点生成的Al(OH)3质量达到最大值 B、a、c点溶液中的溶质分别是AlCl3和NaAlO2 C、bc段(不含端点)的铝元素存在于Al(OH)3和NaAlO2中 D、ad段和dc段消耗的NaOH质量比为3:110. 氢氧化钴[Co(OH)2]能与酸性溶液反应,可作涂料和清漆的干燥剂。制备方法为:
A、b点生成的Al(OH)3质量达到最大值 B、a、c点溶液中的溶质分别是AlCl3和NaAlO2 C、bc段(不含端点)的铝元素存在于Al(OH)3和NaAlO2中 D、ad段和dc段消耗的NaOH质量比为3:110. 氢氧化钴[Co(OH)2]能与酸性溶液反应,可作涂料和清漆的干燥剂。制备方法为:①Co+2HCl═CoCl2+H2↑;②CoCl2+2NaOH═Co(OH)2↓+2NaCl下列判断正确的是( )
A、①为复分解反应 B、钴的金属活动性比铜弱 C、氢氧化钴可以干燥氯化氢气体 D、氢氧化钴是一种难溶性碱11. 向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示(其中 表示不同离子)。则下列说法正确的是( )
表示不同离子)。则下列说法正确的是( )
 A、
A、 表示氯离子
B、
表示氯离子
B、 表示钠离子
C、此反应的实质是
表示钠离子
C、此反应的实质是  和
和  结合生成水分子
D、
结合生成水分子
D、 可用适量硝酸银溶液和足量稀硝酸进行检测
12. 滴有酚酞的氢氧化钡溶液与下列各种物质恰好完全反应后,溶液仍显红色的是( )A、H2SO4 B、Mg(NO3)2 C、K2CO3 D、CO213. 氢氧化钾性质与氢氧化钠相似,下列有关氢氧化钾的说法正确的是 ( )A、氢氧化钾固体露置在空气中易变质 B、氢氧化钾溶液能使石蕊溶液变红 C、氢氧化钾溶液与碳酸铜反应生成蓝色沉淀 D、112 克氢氧化钾溶液与 98 克硫酸溶液恰好完全反应14. 下列用途中,不属于氢氧化钙的用途的是( )A、在农业上常用来改良酸性土壤 B、作建筑材料,用来抹墙 C、常用来检验铵盐的存在 D、广泛用于制肥皂、造纸等工业15. 下列有关氢氧化钠性质探究实验的叙述中,错误的是( )
可用适量硝酸银溶液和足量稀硝酸进行检测
12. 滴有酚酞的氢氧化钡溶液与下列各种物质恰好完全反应后,溶液仍显红色的是( )A、H2SO4 B、Mg(NO3)2 C、K2CO3 D、CO213. 氢氧化钾性质与氢氧化钠相似,下列有关氢氧化钾的说法正确的是 ( )A、氢氧化钾固体露置在空气中易变质 B、氢氧化钾溶液能使石蕊溶液变红 C、氢氧化钾溶液与碳酸铜反应生成蓝色沉淀 D、112 克氢氧化钾溶液与 98 克硫酸溶液恰好完全反应14. 下列用途中,不属于氢氧化钙的用途的是( )A、在农业上常用来改良酸性土壤 B、作建筑材料,用来抹墙 C、常用来检验铵盐的存在 D、广泛用于制肥皂、造纸等工业15. 下列有关氢氧化钠性质探究实验的叙述中,错误的是( ) A、甲:向接近沸腾的水中加入适量NaOH固体,液体迅速沸腾 B、乙:将少量头发加入到热的浓NaOH溶液中,头发逐渐溶解消失 C、丙:向久置于空气里的氢氧化钠溶液中滴加无色酚酞试液,检验其是否变质 D、丁:向盛满CO2气体的集气瓶中加入适量浓烧碱溶液,鸡蛋被“吞”入瓶中
A、甲:向接近沸腾的水中加入适量NaOH固体,液体迅速沸腾 B、乙:将少量头发加入到热的浓NaOH溶液中,头发逐渐溶解消失 C、丙:向久置于空气里的氢氧化钠溶液中滴加无色酚酞试液,检验其是否变质 D、丁:向盛满CO2气体的集气瓶中加入适量浓烧碱溶液,鸡蛋被“吞”入瓶中二、填空题
-
16. 物质结构决定性质,物质性质决定用途,反应本质决定变化现象。如图是小科构建的氢氧化钙部分知识网络,其中“一”表示相连物质能发生化学反应,X与图中所给物质的类别不同。请回答:
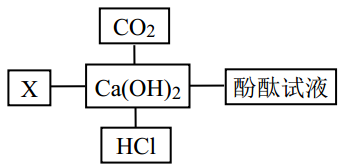 (1)、酚酞试液在Ca(OH)2溶液中显红色,能使酚酞试液变红的离子是(2)、列举熟石灰[Ca(OH)2]在工农业上的一种用途;(3)、X溶液能与Ca(OH)2溶液反应并产生蓝色絮状沉淀,写出产生该实验现象的一个化学方程式。17. 一瓶完全变质的NaOH溶液,在变质前后溶液中存在的主要离子种类如图所示,其中“
(1)、酚酞试液在Ca(OH)2溶液中显红色,能使酚酞试液变红的离子是(2)、列举熟石灰[Ca(OH)2]在工农业上的一种用途;(3)、X溶液能与Ca(OH)2溶液反应并产生蓝色絮状沉淀,写出产生该实验现象的一个化学方程式。17. 一瓶完全变质的NaOH溶液,在变质前后溶液中存在的主要离子种类如图所示,其中“ ”表示(填写离子的符号);检验此瓶试剂是否已完全变质的方法是:。
”表示(填写离子的符号);检验此瓶试剂是否已完全变质的方法是:。  18. 将氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,并根据观察到的现象绘制了如图所示的曲线,根据图示回答问题:
18. 将氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,并根据观察到的现象绘制了如图所示的曲线,根据图示回答问题: (1)、请写出AB段发生反应的化学方程式。(2)、C点处溶液的溶质是。19. 为探究一瓶久置的氢氧化钠固体样品是否全部变质,小科将少量样品配制成溶液,取少 量溶液分别装入两支试管中,进行了如甲、乙两图所示实验。(注:BaCl2 溶液呈中性)
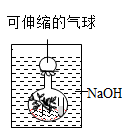
(1)、请写出AB段发生反应的化学方程式。(2)、C点处溶液的溶质是。19. 为探究一瓶久置的氢氧化钠固体样品是否全部变质,小科将少量样品配制成溶液,取少 量溶液分别装入两支试管中,进行了如甲、乙两图所示实验。(注:BaCl2 溶液呈中性) (1)、由甲图实验现象可以得出溶液呈性。(2)、分析乙图实验的现象,可以确定样品的变质情况为。(3)、图乙中,滴加足量的 BaCl2 溶液的目的是。20. 氢氧化钠溶液和二氧化碳反应没有明显现象,为验证 CO2与 NaOH能够发生反应,某同学按如图组装实验装置,并进行实验。
(1)、由甲图实验现象可以得出溶液呈性。(2)、分析乙图实验的现象,可以确定样品的变质情况为。(3)、图乙中,滴加足量的 BaCl2 溶液的目的是。20. 氢氧化钠溶液和二氧化碳反应没有明显现象,为验证 CO2与 NaOH能够发生反应,某同学按如图组装实验装置,并进行实验。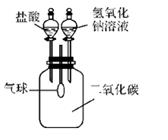 (1)、有时药品滴加顺序会影响实验现象。如果观察到的现象是“气球先膨胀,后变瘪”, 则加入试剂的顺序应该是 (填字母)。A、先加入盐酸,再加入氢氧化钠溶液 B、先加入氢氧化钠溶液,再加入盐酸(2)、请解释气球“先膨胀”的原因:。(3)、写出气球“后变瘪”的化学方程式:。
(1)、有时药品滴加顺序会影响实验现象。如果观察到的现象是“气球先膨胀,后变瘪”, 则加入试剂的顺序应该是 (填字母)。A、先加入盐酸,再加入氢氧化钠溶液 B、先加入氢氧化钠溶液,再加入盐酸(2)、请解释气球“先膨胀”的原因:。(3)、写出气球“后变瘪”的化学方程式:。三、实验探究题
-
21. 在研究碱的性质时,向充满CO2的矿泉水瓶里加入少量氢化钠溶液,拧紧瓶盖并振荡,瓶变瘪,小明认为还不能证明氢氧化钠与二氧化碳发生了反应,为解决小明的疑惑,小红提出了实验一并进行了实验。
实验
步骤与操作
实验现象
结论
实验一
1.取2个相同的塑料瓶,分别集满二氧化碳,编号A、B组.
两瓶内气体无色透明,瓶子形状正常。
氢氧化钠和二氧化碳发生了反应
2.分别向A、B两瓶中加入等量的氢氧化钠溶液和清水,立即拧紧瓶盖并振荡。
?
实验二方案
先向反应前氢氧化钠溶液中滴加酚酞,充分通入二氧化碳后观察洛液颜色变化,比较前后的颜色,得出结论
 (1)、小明认为反应未发生的假设依据是.(2)、将表中“?”处的内容补充完整.(3)、有人提出实验二的方案,你认为是否能得出与实验一相同的结论,并解释原因.22. 为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量的样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如甲、乙两图所示实验。(注:BaCl2溶液呈中性)
(1)、小明认为反应未发生的假设依据是.(2)、将表中“?”处的内容补充完整.(3)、有人提出实验二的方案,你认为是否能得出与实验一相同的结论,并解释原因.22. 为探究一瓶久置的氢氧化钠固体样品是否全部变质,小柯取少量的样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如甲、乙两图所示实验。(注:BaCl2溶液呈中性)
 (1)、小柯认为“甲图实验说明了氢氧化钠固体部分变质”。你认为小柯的观点是否正确,并说明理由:。(2)、分析乙图实验的现象,可以确定样品的变质情况为。(3)、进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在丙图中画出“生成CO2的质量随加入稀盐酸质量变化”的大致图像。
(1)、小柯认为“甲图实验说明了氢氧化钠固体部分变质”。你认为小柯的观点是否正确,并说明理由:。(2)、分析乙图实验的现象,可以确定样品的变质情况为。(3)、进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在丙图中画出“生成CO2的质量随加入稀盐酸质量变化”的大致图像。四、解答题
-
23. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。
 (1)、反应至A点时,溶液中的溶质有 , 此时所加NaOH溶液的质量为g。(2)、反应至B点时,锥形瓶内溶液的质量为多少g?(3)、反应至B点时,锥形瓶内溶液中NaCl的质量分数为多少?24. 实验员在检查药品时,发现有一瓶装有烧碱的试剂瓶的瓶塞没塞紧,实验兴趣小组想测定该瓶中氢氧化钠的质量分数。小科取一定量的烧碱样品加水稀释,倒入放在电子秤上的烧杯内,然后将100g稀盐酸分5次加入烧杯中,记录实验数据如下表。
(1)、反应至A点时,溶液中的溶质有 , 此时所加NaOH溶液的质量为g。(2)、反应至B点时,锥形瓶内溶液的质量为多少g?(3)、反应至B点时,锥形瓶内溶液中NaCl的质量分数为多少?24. 实验员在检查药品时,发现有一瓶装有烧碱的试剂瓶的瓶塞没塞紧,实验兴趣小组想测定该瓶中氢氧化钠的质量分数。小科取一定量的烧碱样品加水稀释,倒入放在电子秤上的烧杯内,然后将100g稀盐酸分5次加入烧杯中,记录实验数据如下表。实验序号
1
2
3
4
5
加入稀盐酸质量/g
20
20
20
20
20
充分反应后电子秤的读数/g
220
240
258.9
276.7
295.6
(1)、在加入盐酸的过程中能观察到的现象是。(2)、实验取用的稀盐酸的质量分数是多少?(3)、该瓶中氢氧化钠的质量分数是多少?(不考虑氢氧化钠吸水潮解,结果保留到 0.1%)25. 实验室有一瓶敞口放置一段时间的氢氧化钠固体,为测定这瓶样品中氢氧化钠的质量分数做如下实验:现取Wg样品(已充分干燥)放入盛有足量水的烧杯中(充分溶解),向烧杯中逐滴加入一定溶质质量分数的稀盐酸。实验数据如图所示:
试分析计算回答:
(1)、P点对应的溶液溶质是。(2)、Wg样品中氢氧化钠的质量分数是多少?(精确到0.1%)(3)、在往烧杯内逐滴加入稀盐酸的过程中,有关溶液的各个量随盐酸质量的变化图像如图所示,则正确的有。

五、综合说理题