天津市和平区2021年中考化学二模试卷
试卷更新日期:2021-07-28 类型:中考模拟
一、单选题
-
1. 下列变化中,发生了化学变化的是( )A、海水蒸发 B、矿石粉碎 C、路面结冰 D、钢铁锈蚀2. 我国空间站将于2022年前后建成,当前,空间站核心舱执行发射任务的长征五号运载火箭用液氧做助燃剂,这是由于()A、氧分子是不断运动的 B、氧分子之间有空隙 C、氧分子是由氧原子构成的 D、液氧中氧分子能保持氧气的化学性质3. 下列元素中,人体摄入量过低会引起骨质疏松的是( )
A、Na B、Zn C、Mg D、Ca4. 分类和归纳是行之有效、简单易行的科学方法,下列说法错误的是( )A、锂、汞都属于金属元素 B、锌、碘都属于人体必需微量元素 C、尿素、硝酸钾都属于复合肥 D、塑料、合成纤维都属于合成材料5. 下列说法正确的是( )A、一氧化碳在空气中燃烧发生蓝紫色火焰 B、硫燃烧后生成有刺激性气味的气体 C、木炭伸入盛有氧气的集气瓶中,发生白光 D、镁条在氧气中燃烧时,火星四射,生成黑色固体6. 分类是研究物质的常用方法,如图是纯净物、单质、化合物、氧化物之间关系的形象表示,下列物质属于Z范围的是( )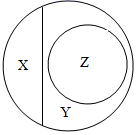 A、红磷 B、干冰 C、乙醇 D、铁锈7. 规范实验操作是实验成功的基础和关键。下列实验基本操作正确的是( )A、
A、红磷 B、干冰 C、乙醇 D、铁锈7. 规范实验操作是实验成功的基础和关键。下列实验基本操作正确的是( )A、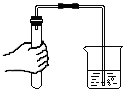 检查气密性
B、
检查气密性
B、 浓硫酸稀释
C、
浓硫酸稀释
C、 液体的倾倒
D、
液体的倾倒
D、 称量氢氧化钠
8. 身边的一些物质pH如下
称量氢氧化钠
8. 身边的一些物质pH如下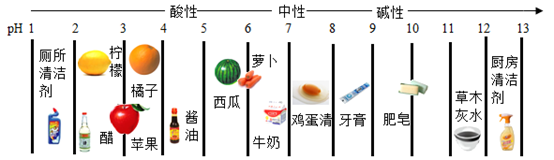
下列说法正确的是( )
A、pH试纸浸入溶液中测其酸碱度 B、厕所清洁剂不会腐蚀大理石地面 C、蚊虫叮咬后涂牙膏可减轻痛痒 D、橘子的酸性强于柠檬9. 关于下列符号或图示说法正确的是( )A、3H表示三个氢元素 B、2Na+表示两个钠离子 C、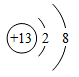 表示铝原子的结构示意图
D、
表示铝原子的结构示意图
D、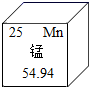 可知锰原子的相对原子质量为25
10. 在反应 中,28gA与一定质量的B恰好完全反应,生成88gC。若C、D的相对分子质量之比为22:9,则A与B的相对分子质量之比为( )A、7:8 B、8:7 C、7:24 D、24:711. 建立宏观和微观之间的联系是化学学科独特的思维方式。如图是几种化学反应的微观过程示意图,下列说法错误的是( )
可知锰原子的相对原子质量为25
10. 在反应 中,28gA与一定质量的B恰好完全反应,生成88gC。若C、D的相对分子质量之比为22:9,则A与B的相对分子质量之比为( )A、7:8 B、8:7 C、7:24 D、24:711. 建立宏观和微观之间的联系是化学学科独特的思维方式。如图是几种化学反应的微观过程示意图,下列说法错误的是( ) A、分子、原子、离子都是构成物质的微粒 B、构成物质的微粒的质量和体积都很小,总在不停地运动 C、氢气、氧气、石墨、金刚石都是单质,水、氢氧化钠、氯化氢、氯化钠都是化合物 D、化学变化前后,构成物质的微粒种类不变,只是微粒重新结合,因而,物质的种类和质量都不发生改变12. 将草酸(H2C2O4),沸点约150℃,分解温度约190℃)隔绝空气加热,得到的混合物经充分冷却后,残余气体M(CO、CO2中的一种或两种)。为探究M的成分,设计如图所示实验。下列说法错误的是()
A、分子、原子、离子都是构成物质的微粒 B、构成物质的微粒的质量和体积都很小,总在不停地运动 C、氢气、氧气、石墨、金刚石都是单质,水、氢氧化钠、氯化氢、氯化钠都是化合物 D、化学变化前后,构成物质的微粒种类不变,只是微粒重新结合,因而,物质的种类和质量都不发生改变12. 将草酸(H2C2O4),沸点约150℃,分解温度约190℃)隔绝空气加热,得到的混合物经充分冷却后,残余气体M(CO、CO2中的一种或两种)。为探究M的成分,设计如图所示实验。下列说法错误的是()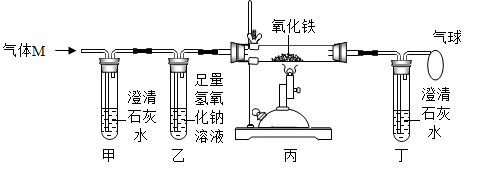 A、若甲试管内溶液变浑浊,则M中一定含有CO2 B、若丙中固体变黑、丁试管内溶液变浑浊,则M中一定含CO C、若装置甲、乙位置互换,则无法判断M中是否含有CO D、若加热所得混合物不经充分冷却,则M中可能混有草酸蒸气
A、若甲试管内溶液变浑浊,则M中一定含有CO2 B、若丙中固体变黑、丁试管内溶液变浑浊,则M中一定含CO C、若装置甲、乙位置互换,则无法判断M中是否含有CO D、若加热所得混合物不经充分冷却,则M中可能混有草酸蒸气二、多选题
-
13. 为了达到实验目的,下列方案或结论正确的是( )
选项
实验目的
实验方案或结论
A
除去铁粉中的三氧化二铁
取样,加入足量盐酸,过滤
B
鉴别空气、氧气、二氧化碳
分别伸入燃着的小木条
C
鉴别碳粉、铁粉和氧化铜粉末
取样后,分别加入稀盐酸
D
鉴别某溶液中是否含有SO
取少量溶液于管中,滴加BaCl2溶液,有白色沉淀生成,则该溶液中一定有SO
A、A B、B C、C D、D14. 氨是一种重要的化学物质,可用于制造硝酸和氮肥。工业合成氨的流程如图1所示。在铁触媒作用下,用体积比为1:3的氮气和氢气合成氨,当容器中氨的含量不再发生变化时(平衡时),测得氨的含量分别与温度和压强的关系如图2所示。下列说法错误的是( )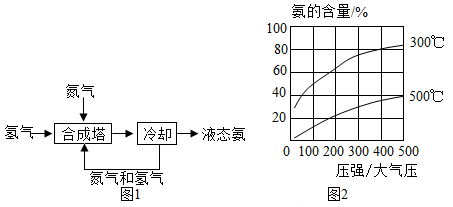 A、工业上可用分离液态空气方法获得合成氨的原料N2 B、从“合成塔”中出来的气体是纯净物。 C、合成氨反应时,温度越高、压强越大,平衡时氨的含量越高。 D、甲烷和H2O高温下反应得到CO和原料气H2 , 该反应的化学方程式为15. 有一包白色粉末,可能含有氢氧化钙、碳酸钙、氢氧化钠和碳酸钠中的一种或几种。某化学兴趣小组对这包白色粉末的成分展开如下探究:
A、工业上可用分离液态空气方法获得合成氨的原料N2 B、从“合成塔”中出来的气体是纯净物。 C、合成氨反应时,温度越高、压强越大,平衡时氨的含量越高。 D、甲烷和H2O高温下反应得到CO和原料气H2 , 该反应的化学方程式为15. 有一包白色粉末,可能含有氢氧化钙、碳酸钙、氢氧化钠和碳酸钠中的一种或几种。某化学兴趣小组对这包白色粉末的成分展开如下探究:(查阅资料)氯化钡溶液显中性。
步骤(1):取少量白色粉末于烧杯中,加足量水,搅拌、静置后烧杯底部有白色固体。
步骤(2):取少量步骤(1)所得上层清液于试管中,滴加过量氯化钡溶液,有白色沉淀产生,过滤,向滤液中滴加无色酚酞溶液,溶液变红色。
步骤(3):取该白色粉末10.6g,滴加足量的稀盐酸,充分反应后生成4.4g二氧化碳。
结合以上探究过程,下列推理正确的是()
A、由步骤(1)可知,白色粉末中一定含碳酸钠和氢氧化钙 B、步骤(2)结束后所得溶液中溶质除酚酞外,只有氯化钠和氢氧化钠 C、该白色粉末的组成可能是碳酸钠、氢氧化钙和碳酸钙 D、该白色粉末中一定含碳酸钙三、填空题
-
16. 化学就在我们身边,请从下列物质中选择相应的序号填空:
①二氧化碳 ②氧气 ③氮气 ④稀有气体 ⑤酒精 ⑥石墨
 (1)、实验室常用的燃料是。(2)、能产生温室效应的气体是。(3)、可以供呼吸的是。(4)、可用于制造硝酸和氮肥的是。(5)、可用于制作霓虹灯的是。(6)、可用作润滑剂。17. 在“宏观一微观一符号”之间建立联系,是化学特有的思维方式。(1)、如图是四种粒子结构示意图。
(1)、实验室常用的燃料是。(2)、能产生温室效应的气体是。(3)、可以供呼吸的是。(4)、可用于制造硝酸和氮肥的是。(5)、可用于制作霓虹灯的是。(6)、可用作润滑剂。17. 在“宏观一微观一符号”之间建立联系,是化学特有的思维方式。(1)、如图是四种粒子结构示意图。
①D中的x , C粒子的符号为。
②A、B、C、D中属于同种元素的粒子是(填序号)。
③A和B两种粒子的相同,所以它们具有相似的化学性质。
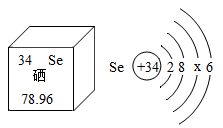
(2)、硒元素被誉为“抗癌大王”。硒元素的部分信息如图。下列说法正确的是(填字母序号)。a.硒属于非金属元素
b.一个硒原子中有34个质子
c.硒的原子结构示意图中x=18
d.硒元素的相对原子质量为78.96
18. 金属材料广泛应用于生产、生活中。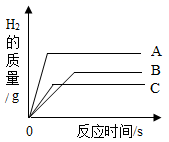 (1)、用铜作导线,利用了铜的延展性和性。(2)、镁是一种活泼的金属,请写出镁与稀盐酸反应的化学方程式。(3)、将等质量的A、B、C三种金属(生成物中金属元素均为+2价),分别放入质量分数相等且足量的稀盐酸中,产生H2的质量与反应时间的关系如图所示。A、B、C三种金属中,金属活动性由强到弱的顺序是 , 相对原子质量最大的是。(4)、向一定量的硝酸银和硝酸亚铁混合溶液中加入mg锌粉,充分反应后过滤,得到滤液和滤渣。下列分析正确的是(填字母序号)。
(1)、用铜作导线,利用了铜的延展性和性。(2)、镁是一种活泼的金属,请写出镁与稀盐酸反应的化学方程式。(3)、将等质量的A、B、C三种金属(生成物中金属元素均为+2价),分别放入质量分数相等且足量的稀盐酸中,产生H2的质量与反应时间的关系如图所示。A、B、C三种金属中,金属活动性由强到弱的顺序是 , 相对原子质量最大的是。(4)、向一定量的硝酸银和硝酸亚铁混合溶液中加入mg锌粉,充分反应后过滤,得到滤液和滤渣。下列分析正确的是(填字母序号)。a.若滤渣只含一种金属,则滤液中的溶质有三种
b.若滤液中含有两种金属离子,则滤渣中的固体有两种
c.若最终得到的滤渣质量仍为mg,则滤液中溶质最多有两种
d.若向滤渣中加入稀盐酸,有气泡产生,则滤液中的溶质最多有两种
(5)、高温条件下,一氧化碳可以把铁从赤铁矿石中还原出来。若反应前加入赤铁矿石的质量为20g,完全反应后称得固体残留物的质量为15.2g(假设赤铁矿石中的杂质不参与反应),则该赤铁矿石中氧化铁的质量分数为。19. 写出下列反应的化学方程式(1)、铝在空气中氧化。(2)、一氧化碳还原氧化铁。(3)、盐酸与氢氧化钠反应。20. 溶液与人类生产、生活密切相关。(1)、如表为硝酸钾和氯化钠的部分溶解度数据,某同学进行了如图所示的两个溶解实验。物质/溶解度/g/温度
10℃
20℃
30℃
40℃
50℃
60℃
70℃
80℃
NaCl
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
KNO3
20.9
31.6
45.8
63.9
85.5
110
138
169

①由表格数据可知,溶解度随温度升高变化显著的物质是(选填“NaCl”或“KNO3”)。
②上述溶液中属于饱和溶液的是(填A-F序号)。
③B、C、E、F溶液中溶质质量分数由大到小的关系是。
(2)、t℃时,根据某物质在不同质量的水中达到饱和状态时所溶解的质量绘制成图中的斜线。下列说法错误的是()
a. t℃时该物质的溶解度为50g
b.图中4个点表示的溶液中只有z是饱和溶液
c.点z向点w移动的一种方法是恒温蒸发一定量的水
d.将m点表示的溶液变为饱和溶液的一种方法是再加入20g溶质
(3)、机动车一般使用铅酸蓄电池。某铅酸蓄电池用的酸溶液是质量分数为28%的稀硫酸,若用1L溶质质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3的体积为L,配得的稀硫酸质量为kg。(计算结果保留位小数)21. A、B、C、E、F分别为单质、氧化物、酸、碱、盐五种物质类别中的一种常见物质,已知A是最常用的溶剂,E俗称纯碱。它们之间相互关系如图所示,图中“一”表示相连的物质能相互反应,“→”表示一种物质转化成另一种物质(部分反应物、生成物及反应条件已略去)。请回答下列问题: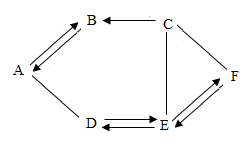 (1)、物质A是。(2)、写出下列反应的化学方程式:A→B:;E→F。(3)、图中反应涉及的基本反应类型最多有种。22. 有一固体混合物M,已知其中可能含有Ba(OH)2、Na2CO3、Na2SO4、NH4Cl、FeCl3五种物质中的两种或多种。按照下图所示进行实验,出现的现象如图中所述(假设过程中所有的可能发生的反应都恰好完全进行)。
(1)、物质A是。(2)、写出下列反应的化学方程式:A→B:;E→F。(3)、图中反应涉及的基本反应类型最多有种。22. 有一固体混合物M,已知其中可能含有Ba(OH)2、Na2CO3、Na2SO4、NH4Cl、FeCl3五种物质中的两种或多种。按照下图所示进行实验,出现的现象如图中所述(假设过程中所有的可能发生的反应都恰好完全进行)。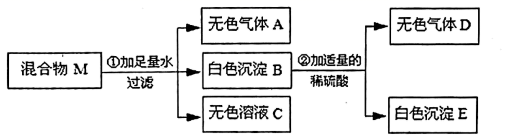
试根据实验过程和现象作出判断,回答下列问题:
(1)、无色气体A的化学式为;把气体D通入紫色石蕊溶液中,紫色石蕊溶液变为色。(2)、写出过程②发生的化学方程式。原混合物M中,不能确定的物质是(写化学式)。(3)、某小组同学为了进一步确定混合物M的组成,称取一定质量的混合物M按照上述流程进行实验,反应过程中生成3.4g无色气体A,19.7g白色沉淀B,4.4g无色气体D,则混合物M中氢氧化钡的质量分数 , 该混合物的组成成分为。23. 根据如图所示装置回答有关问题。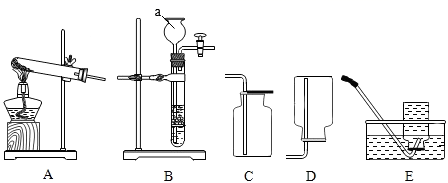 (1)、仪器a的名称是。(2)、实验室用氯酸钾和二氧化锰制取氧气的化学方程式;若收集一瓶氧气,供“铁丝在氧气中燃烧”实验使用,最好选择E,理由是。(3)、实验室用加热氯化铵和熟石灰的固体混合物制取氨气,方程式为。已知氨气极易溶于水且密度小于空气,所选的发生装置和收集裝置是。(4)、选用B制取二氧化碳时,将长颈漏斗末端伸到液面以下的原因是。24. 学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。(已知:20℃氯化钠的溶解度为36g,水的密度可近似看作lg/mL)(1)、实验一:溶液配制
(1)、仪器a的名称是。(2)、实验室用氯酸钾和二氧化锰制取氧气的化学方程式;若收集一瓶氧气,供“铁丝在氧气中燃烧”实验使用,最好选择E,理由是。(3)、实验室用加热氯化铵和熟石灰的固体混合物制取氨气,方程式为。已知氨气极易溶于水且密度小于空气,所选的发生装置和收集裝置是。(4)、选用B制取二氧化碳时,将长颈漏斗末端伸到液面以下的原因是。24. 学会物质的分离提纯和准确配制一定质量分数的溶液在实际应用中有重要意义。(已知:20℃氯化钠的溶解度为36g,水的密度可近似看作lg/mL)(1)、实验一:溶液配制某实验小组用6%的氯化钠溶液(密度约为1.04g/cm3)配制50g质量分数为3%的氯化钠溶液,步骤如下:①计算;②量取;③混匀;④装瓶贴标签。回答下列问题:
计算需要6%的氯化钠溶液的体积是mL(结果取整数);
(2)、实验中用到的仪器有25mL的量筒、细口瓶、烧杯、。(3)、下列实验操作会导致所配溶液中溶质的质量分数一定偏大的是。a.量取6%的氯化钠溶液时仰视读数
b.向烧杯内加入液体时有液体溅出
c.混匀过程中没有使用玻璃棒搅拌
d.配制好的溶液装入未干燥的细口瓶
(4)、实验二:粗盐提纯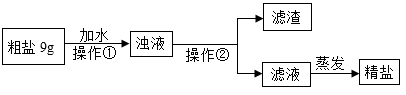
操作①中玻璃棒的作用是 , 操作②的名称为。
(5)、20℃时提纯9g粗盐,若已知粗盐中氯化钠含量约为80%,溶解时应选择的量筒量取所需要的水最为合适(提供的量筒规格有“10mL”“25mL”和“100mL”)。(6)、提纯后的精盐属于(填“纯净物”或“混合物”)。四、计算题
-
25. 在预防“新冠肺炎”期间,过氧乙酸是人们广泛使用的消毒剂之一。过氧乙酸的化学式为 C2H4O3 , 试计算:(1)、过氧乙酸的相对分子质量为。(2)、过氧乙酸中碳、氢、氧三种元素的质量比为。(填最简整数比)(3)、过氧乙酸中氧元素的质量分数为。(计算结果精确到 1%)26. 现有硫酸镁和硫酸钠的混合物12.8g,全部溶于50g水中,加入一定质量的氢氧化钠溶液,恰好完全反应后,过滤,得到5.8g沉淀,所得溶液中溶质的质量分数为15%(不考虑过滤过程中物质质量的损失)。计算:(1)、原混合物中硫酸钠的质量。(2)、所加氢氧化钠溶液中溶质的质量分数(计算结果精确到0.1%)