河北省保定市定州市2021年中考化学三模试卷
试卷更新日期:2021-07-28 类型:中考模拟
一、单选题
-
1. “一日之计在于晨”,新的一天从营养丰富的早餐开始。下列食物富含蛋白质的是( )A、玉米、红薯 B、鲜奶、豆浆 C、苹果、西红柿 D、牛油、奶油2. 空气是我们每天都呼吸的“生命气体”。下列说法错误的是( )A、空气中氮气的质量分数为 78% B、空气中氧气能供给呼吸和支持燃烧 C、空气中二氧化碳是造成温室效应的气体之一 D、空气中的稀有气体所占比例虽小,但用途广泛3. 下列实验操作正确的是( )A、熄灭酒精灯
 B、氧气的验满
B、氧气的验满  C、取固体药品
C、取固体药品  D、稀释浓硫酸
D、稀释浓硫酸  4. 某化学反应的微观示意图如下,下列说法正确的是( )
4. 某化学反应的微观示意图如下,下列说法正确的是( ) A、反应前后分子总数不变 B、物质甲是由一个氮分子和三个氢原子构成的 C、甲,乙两物质反应的质量比为17:40 D、氮元素的化合价在反应前后没有变化5. 下列化学符号所表示的含义正确的是( )A、He可表示氦气 B、N2表示2个氮原子 C、NaCl可表示1个氯化钠分子 D、Fe2+中的数字2表示一个铁离子带两个单位的正电荷6. 下列说法中正确的是( )A、水、氯酸钾、高锰酸钾都能生成氧气,因为这些物质中都有氧气 B、含相同质子数的粒子一定属于同种元素 C、铁在潮湿的空气中容易生锈,所以隔绝氧气和水一定能防止铁生锈 D、酸雨呈酸性,pH小于7,所以pH小于7的雨水一定是酸雨7. 下列四个图象不能正确反映对应变化关系的是( )A、
A、反应前后分子总数不变 B、物质甲是由一个氮分子和三个氢原子构成的 C、甲,乙两物质反应的质量比为17:40 D、氮元素的化合价在反应前后没有变化5. 下列化学符号所表示的含义正确的是( )A、He可表示氦气 B、N2表示2个氮原子 C、NaCl可表示1个氯化钠分子 D、Fe2+中的数字2表示一个铁离子带两个单位的正电荷6. 下列说法中正确的是( )A、水、氯酸钾、高锰酸钾都能生成氧气,因为这些物质中都有氧气 B、含相同质子数的粒子一定属于同种元素 C、铁在潮湿的空气中容易生锈,所以隔绝氧气和水一定能防止铁生锈 D、酸雨呈酸性,pH小于7,所以pH小于7的雨水一定是酸雨7. 下列四个图象不能正确反映对应变化关系的是( )A、 向一定量的氧化铜粉末中逐渐加入稀硫酸至过量
B、
向一定量的氧化铜粉末中逐渐加入稀硫酸至过量
B、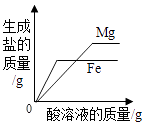 向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量
C、
向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量
C、 在饱和石灰水中加入少量生石灰
D、
在饱和石灰水中加入少量生石灰
D、 在密闭容器中用红磷测定空气中氧气的含量
8. 下列生产过程中,只发生了物理变化的是( )A、华北制药厂合成新药 B、西柏坡电厂火力发电 C、衡水酒厂酿造白酒 D、唐山盐场海水晒盐9. 2021年第29届世界水日主题为“珍惜水,爱护水”。下列做法符合这一主题的是( )A、大量开发利用地下水 B、用喷灌、滴灌方法给作物浇水 C、日本福岛核废水排海 D、工业废水直接灌溉农田节约用水10. 下列对生活常见现象的解释不合理的是( )A、红墨水在热水中比冷水中扩散得快—温度越高,分子运动越快 B、瘪的兵乓球放到热水中会鼓起来—分子间存在间隙 C、滹沱河岸边柳絮纷飞—分子在不停地运动 D、糖甜盐咸—不同的分子具有不同的性质11. 安全警钟长鸣。下列做法不符合安全要求的是( )A、家用电器着火,立即用水浇灭 B、发生一氧化碳中毒,立即转移到通风处 C、更换灯泡前应断开电源开关 D、加热试管里的液体时,试管口不能对着人12. 下列关于四种物质的说法正确的是( )A、铁是单质但不是晶体 B、空气既是混合物又善于导热 C、石墨是导体但不是金属 D、甲烷是可燃物但不是有机物13. 下列对生产生活实际问题的解释正确的是( )A、地漏中的反水弯管 利用了大气压原理 B、大坝的形状上窄下宽 液体压强随深度的增加而减小 C、胃酸过多时服用含碱性的物质 酸碱中和 D、丝绸摩擦过的玻璃棒吸引碎纸屑 分子间存在引力14. 下列实验方案能达到实验目的是( )A、
在密闭容器中用红磷测定空气中氧气的含量
8. 下列生产过程中,只发生了物理变化的是( )A、华北制药厂合成新药 B、西柏坡电厂火力发电 C、衡水酒厂酿造白酒 D、唐山盐场海水晒盐9. 2021年第29届世界水日主题为“珍惜水,爱护水”。下列做法符合这一主题的是( )A、大量开发利用地下水 B、用喷灌、滴灌方法给作物浇水 C、日本福岛核废水排海 D、工业废水直接灌溉农田节约用水10. 下列对生活常见现象的解释不合理的是( )A、红墨水在热水中比冷水中扩散得快—温度越高,分子运动越快 B、瘪的兵乓球放到热水中会鼓起来—分子间存在间隙 C、滹沱河岸边柳絮纷飞—分子在不停地运动 D、糖甜盐咸—不同的分子具有不同的性质11. 安全警钟长鸣。下列做法不符合安全要求的是( )A、家用电器着火,立即用水浇灭 B、发生一氧化碳中毒,立即转移到通风处 C、更换灯泡前应断开电源开关 D、加热试管里的液体时,试管口不能对着人12. 下列关于四种物质的说法正确的是( )A、铁是单质但不是晶体 B、空气既是混合物又善于导热 C、石墨是导体但不是金属 D、甲烷是可燃物但不是有机物13. 下列对生产生活实际问题的解释正确的是( )A、地漏中的反水弯管 利用了大气压原理 B、大坝的形状上窄下宽 液体压强随深度的增加而减小 C、胃酸过多时服用含碱性的物质 酸碱中和 D、丝绸摩擦过的玻璃棒吸引碎纸屑 分子间存在引力14. 下列实验方案能达到实验目的是( )A、 稀释浓硫酸
B、
稀释浓硫酸
B、 探究热量和电流的关系
C、
探究热量和电流的关系
C、 探究压力作用效果与受力面积的关系
D、
探究压力作用效果与受力面积的关系
D、 证明化学反应遵循质量守恒定律
证明化学反应遵循质量守恒定律
二、综合题
-
15. 利用如图装置测定空气中氧气的含量。
 (1)、实验中白磷取样需稍过量目的是。(2)、试管白磷燃烧停止并冷却至室温后,打开弹簧夹。最终量筒中液面降至约23mL刻度线,原因是。(3)、白磷燃烧的化学方程式为。16. 根据下图所示实验回答问题:
(1)、实验中白磷取样需稍过量目的是。(2)、试管白磷燃烧停止并冷却至室温后,打开弹簧夹。最终量筒中液面降至约23mL刻度线,原因是。(3)、白磷燃烧的化学方程式为。16. 根据下图所示实验回答问题: (1)、甲是探究氧气性质的实验。铁丝在氧气中燃烧实验,火柴梗的作用是 , 实验装置存在明显不足,改进措施是。(2)、乙是除粗盐中难溶性杂质的实验。操作①中玻璃棒的作用是 , 操作③中,当观察到时停止加热,该实验正确的操作顺序是。(填序号)。17. 理化知识在生产、生活中有广泛的应用。(1)、三星堆内精美的青铜器属于材料。(2)、利用反渗透膜从海水中分离出淡水的变化是(选填“化学 变化”或“物理变化")(3)、经过处理的核废水中仍然含有放射性金属元素锶,右图是锶原子结构示意图,在化学反应中容易(选填“失去"或“得到")电子。
(1)、甲是探究氧气性质的实验。铁丝在氧气中燃烧实验,火柴梗的作用是 , 实验装置存在明显不足,改进措施是。(2)、乙是除粗盐中难溶性杂质的实验。操作①中玻璃棒的作用是 , 操作③中,当观察到时停止加热,该实验正确的操作顺序是。(填序号)。17. 理化知识在生产、生活中有广泛的应用。(1)、三星堆内精美的青铜器属于材料。(2)、利用反渗透膜从海水中分离出淡水的变化是(选填“化学 变化”或“物理变化")(3)、经过处理的核废水中仍然含有放射性金属元素锶,右图是锶原子结构示意图,在化学反应中容易(选填“失去"或“得到")电子。 (4)、在点燃氢气、一氧化碳等可燃性气体前必须进行的操作是。(5)、金刚石和石墨的物理性质存在明显差异的原因是。18. A~E分别是初中化学常见不同类型物质,它们之间的相互转化关系如下图。其中A的浓溶液在实验室中常用作干燥剂,C、F常用于配制农药波尔多液。(部分反应物、生成物均已略去)。请回答下列问题:
(4)、在点燃氢气、一氧化碳等可燃性气体前必须进行的操作是。(5)、金刚石和石墨的物理性质存在明显差异的原因是。18. A~E分别是初中化学常见不同类型物质,它们之间的相互转化关系如下图。其中A的浓溶液在实验室中常用作干燥剂,C、F常用于配制农药波尔多液。(部分反应物、生成物均已略去)。请回答下列问题: (1)、A的化学式为。(2)、B与C反应的化学方程式为。(任写一个反应即可)(3)、E的一种用途是。(4)、D所属的物质类别为。19. 如图一、二所示,方便午餐“自热米饭”带有一个发热包,遇水后可升温至150℃,保温达3小时。小明对发热包感兴趣,进行了以下探究。
(1)、A的化学式为。(2)、B与C反应的化学方程式为。(任写一个反应即可)(3)、E的一种用途是。(4)、D所属的物质类别为。19. 如图一、二所示,方便午餐“自热米饭”带有一个发热包,遇水后可升温至150℃,保温达3小时。小明对发热包感兴趣,进行了以下探究。(查阅资料)发热包由生石灰、活性炭、铁粉、铝粉、碳酸钠、氯化钠中的若干种组成。

 (1)、(成分探究)打开一个未开启的发热包,把包内固体粉末分成两份。
(1)、(成分探究)打开一个未开启的发热包,把包内固体粉末分成两份。用磁铁靠近其中一份粉末,发现有黑色物质被磁铁吸引,证明粉末中含。用磁铁将该物质全部吸出后,剩余粉末为样品A。
(2)、将另一份粉末加水溶解,放热;过滤,取部分滤液滴入酚酞试液,滤液变色,发生反应的化学方程式是。(3)、除上述物质外,还可能存在活性炭、铝粉、碳酸钠、氯化钠,又做了如下研究:(实验验证)小明用样品A进行实验,流程如下。

小明对气体C进一步实验,把气体C , 证明样品A中不含有碳酸钠。
(4)、(实验结论)发热包中定含有的物质是。(5)、(原理探究)小明利用如图装置证明发热包放热主要来自于生石灰与水的反应。加水后发现A中温度迅速升高,B中有气泡。一会儿后发现 ,说明该反应很快结束,不能长时间保温。 (6)、(新猜想)应该还有其他放热反应存在,如。
(6)、(新猜想)应该还有其他放热反应存在,如。(验证新猜想)按资料介绍,把一定量的铁粉、活性炭和食盐放在锥形瓶中,加少量水浸湿粉末,不久发现粉末部分变红,锥形瓶外壁微烫并持续较长时间。该现象解释了发热包的保温机理。
(反思)这样的发热包打开前必须密封,否则很容易失效。生活中有很多科学知识,要善于观察,善于研究。
三、计算题
-
20. 为了测定某石灰石样品中碳酸钙的含量,四组同学均按下图所示用质量分数相同的盐酸与样品充分反应来进行实验(杂质不溶于水,且不与盐酸反应),测得数据如下表。请计算:
1组
2组
3组
4组
样品质量/g
10.0
10.0
10.0
10.0
盐酸的质量/g
20.0
30.0
45.0
50.0
剩余固体的质量/g
6.0
4.0
1.0
1.0
 (1)、10.0g样品中杂质的质量为g。(2)、计算所用盐酸的溶质质量分数。
(1)、10.0g样品中杂质的质量为g。(2)、计算所用盐酸的溶质质量分数。