北京市平谷区2021年中考化学二模试卷
试卷更新日期:2021-07-28 类型:中考模拟
一、单选题
-
1. 地壳中含量最多的金属元素是()
A、氧 B、硅 C、铝 D、铁2. 下列物质在氧气中燃烧,生成大量白烟的是( )A、铁丝 B、氢气 C、一氧化碳 D、红磷3. 下列人体所必须的元素中,青少年缺少会引起佝偻病的是( )A、锌 B、铁 C、钙 D、钠4. 氮元素与硫元素的本质区别是 ( )A、质子数不同 B、电子数不同 C、中子数不同 D、最外层电子数不同5. 高铁上装有烟雾传感器,主体是放有镅(Am)的电离室,这种镅原子的原子核内有95个质子和146个中子,该原子的核外电子数为( )A、95 B、146 C、241 D、516. 下列物质不是由分子构成的是( )A、水 B、氯化钠 C、二氧化碳 D、氧气7. 下列物质放入水中,能形成溶液的是( )A、食盐 B、牛奶 C、面粉 D、植物油8. 下列做法中,不符合“尊重自然、自觉践行绿色生活”倡议的是( )A、人走关灯、少开空调 B、使用一次性餐具 C、自带水杯出行 D、对垃圾进行分类9. 铜可用于制造传统的炭火锅,下列性质与此用途无关的是( ) A、熔点高 B、导热性好 C、延展性好 D、导电性好10. 下列实验操作正确的是( )A、
A、熔点高 B、导热性好 C、延展性好 D、导电性好10. 下列实验操作正确的是( )A、 稀释浓硫酸
B、
稀释浓硫酸
B、 倾倒液体
C、
倾倒液体
C、 称量氯化钠固体
D、
称量氯化钠固体
D、 过滤
11. 草木灰的有效成分是K2CO3 , 草木灰属于( )A、钾肥 B、磷肥 C、氮肥 D、复合肥12. 下列物质的用途中,利用了其物理性质的是( )A、氮气用作保护气 B、白磷用于制作烟幕弹 C、盐酸用于除铁锈 D、稀有气体用于电光源13. 硅在元素周期表中的信息如图所示,下列有关硅元素的说法错误的是( )
过滤
11. 草木灰的有效成分是K2CO3 , 草木灰属于( )A、钾肥 B、磷肥 C、氮肥 D、复合肥12. 下列物质的用途中,利用了其物理性质的是( )A、氮气用作保护气 B、白磷用于制作烟幕弹 C、盐酸用于除铁锈 D、稀有气体用于电光源13. 硅在元素周期表中的信息如图所示,下列有关硅元素的说法错误的是( ) A、元素符号是Si B、属于非金属元素 C、原子中的质子数是14 D、相对原子质量为28.09 g14. 测定空气中氧气含量的实验装置如图所示。下列说法错误的是( )
A、元素符号是Si B、属于非金属元素 C、原子中的质子数是14 D、相对原子质量为28.09 g14. 测定空气中氧气含量的实验装置如图所示。下列说法错误的是( ) A、氮气不溶于水是设计该实验的依据之一 B、要等到装置冷却后,再打开止水夹 C、实验中红磷的用量不会影响测定结果 D、集气瓶中少量的水起到降温和吸收有害物质的作用15. 将下列固体分别放入水中,溶液温度明显降低的是( )A、石灰石 B、硝酸铵 C、烧碱 D、食盐16. 下列物质中,不属于合金的是( )A、黄铜 B、不锈钢 C、合成橡胶 D、生铁17. 下列属于新能源的是( )A、核能 B、煤 C、天然气 D、石油18. 下列微粒中,能表示2个氢分子的是( )A、2H B、2H+ C、H2O D、2H219. 配制一定溶质质量分数的氯化钠溶液,操作顺序正确的是( )A、计算、称量、量取、溶解 B、溶解、量取、计算、称量 C、计算、溶解、称量、量取 D、称量、量取、溶解、计算20. 如图是电解水的装置图.下列说法正确的是( )
A、氮气不溶于水是设计该实验的依据之一 B、要等到装置冷却后,再打开止水夹 C、实验中红磷的用量不会影响测定结果 D、集气瓶中少量的水起到降温和吸收有害物质的作用15. 将下列固体分别放入水中,溶液温度明显降低的是( )A、石灰石 B、硝酸铵 C、烧碱 D、食盐16. 下列物质中,不属于合金的是( )A、黄铜 B、不锈钢 C、合成橡胶 D、生铁17. 下列属于新能源的是( )A、核能 B、煤 C、天然气 D、石油18. 下列微粒中,能表示2个氢分子的是( )A、2H B、2H+ C、H2O D、2H219. 配制一定溶质质量分数的氯化钠溶液,操作顺序正确的是( )A、计算、称量、量取、溶解 B、溶解、量取、计算、称量 C、计算、溶解、称量、量取 D、称量、量取、溶解、计算20. 如图是电解水的装置图.下列说法正确的是( ) A、该实验说明水中含有氢气和氧气 B、连接电源正极的管内产生的是氢气 C、该实验说明水是由氢元素、氧元素组成的 D、连接电源负极的管内产生的气体能使带火星的木条复燃21. 我国科学家率先用铝合金和石墨烯按一定比例混合制成“烯合金”,该材料有望生产出“一分钟充满电的电池”。下列关于“烯合金”的说法错误的是( )A、常温下稳定 B、是一种纯净物 C、具有导电性 D、含碳元素和铝元素22. 阿司匹林的化学式为C9H8O4.下列关于阿司匹林的说法错误的是( )A、阿司匹林由碳、氢、氧三种元素组成 B、1个阿司匹林分子由9个碳原子、8个氢原子、4个氧原子构成 C、阿司匹林中氢、氧元素的质量比为2:1 D、阿司匹林中氢、氧原子的个数比为2:123. 下列实验操作不能达到实验目的的是( )
A、该实验说明水中含有氢气和氧气 B、连接电源正极的管内产生的是氢气 C、该实验说明水是由氢元素、氧元素组成的 D、连接电源负极的管内产生的气体能使带火星的木条复燃21. 我国科学家率先用铝合金和石墨烯按一定比例混合制成“烯合金”,该材料有望生产出“一分钟充满电的电池”。下列关于“烯合金”的说法错误的是( )A、常温下稳定 B、是一种纯净物 C、具有导电性 D、含碳元素和铝元素22. 阿司匹林的化学式为C9H8O4.下列关于阿司匹林的说法错误的是( )A、阿司匹林由碳、氢、氧三种元素组成 B、1个阿司匹林分子由9个碳原子、8个氢原子、4个氧原子构成 C、阿司匹林中氢、氧元素的质量比为2:1 D、阿司匹林中氢、氧原子的个数比为2:123. 下列实验操作不能达到实验目的的是( )实验目的
实验操作
A
除去碳粉中的铁粉
磁铁吸引
B
检验某固体为碳酸盐
取样,滴加稀盐酸,观察是否有气泡产生
C
干燥氧气
将气体通入浓硫酸
D
鉴别水和双氧水
取样,分别加入二氧化锰,观察是否有气泡产生
A、A B、B C、C D、D24. 甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是( ) A、依据溶解度曲线可判断,甲的溶解度比乙的大 B、将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大 C、t1℃时,甲和乙的饱和溶液各50g,其溶质的质量一定相等 D、将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温或加水的方法25. 向含有酚酞的氢氧化钠溶液中加入一定量稀盐酸,溶液变为无色。下列说法错误的是( )A、该实验可以证明氢氧化钠能与盐酸反应 B、该反应的化学方程式为: C、实验过程中,溶液的pH逐渐增大 D、反应后所得无色溶液的溶质中一定有NaCl,可能有HCl
A、依据溶解度曲线可判断,甲的溶解度比乙的大 B、将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大 C、t1℃时,甲和乙的饱和溶液各50g,其溶质的质量一定相等 D、将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温或加水的方法25. 向含有酚酞的氢氧化钠溶液中加入一定量稀盐酸,溶液变为无色。下列说法错误的是( )A、该实验可以证明氢氧化钠能与盐酸反应 B、该反应的化学方程式为: C、实验过程中,溶液的pH逐渐增大 D、反应后所得无色溶液的溶质中一定有NaCl,可能有HCl二、填空题
-
26. 补齐物质及其用途的连线。
物质 用途
生石灰 纺织、造纸
纯碱
 食品干燥剂
食品干燥剂干冰 人工降雨
27. 人体不同器官内体液有不同的酸碱度。(1)、以下是人体内部分体液的pH值体液
细胞外液
唾液
胃液
胰液
尿液
血液
pH值
6.8—7.0
6.5-7.5
0.9—1.5
8.0-8.4
4.8—8.4
7.35—7.45
其中酸性最强的是(填写体液名称)。
(2)、呼吸性酸中毒是指体内堆积过多的二氧化碳,使血液中碳酸(H2CO3)的浓度增大,这是因为(写出主要反应的化学方程式)。(3)、常见的抗酸药有NaHCO3、Al(OH)3和MgO等,胃溃疡患者不宜选择使胃内气体增多的抗酸药,以上不适合胃溃疡患者使用的是。28. 苹果中多酚氧化酶的相对活性会影响苹果的褐变。 (1)、科研人员研究温度对多酚氧化酶相对活性的影响,结果如图所示,由此得出的结论是。(2)、研究发现柠檬酸(C₆H₈O₇)能较好地抑制苹果褐变,柠檬酸中H元素的质量分数的计算式为。29. 某工厂将矿物燃料燃烧产生的废气中的SO2收集起来,既可以生产稀硫酸,又能制备氢气。其反应过程如下图所示:
(1)、科研人员研究温度对多酚氧化酶相对活性的影响,结果如图所示,由此得出的结论是。(2)、研究发现柠檬酸(C₆H₈O₇)能较好地抑制苹果褐变,柠檬酸中H元素的质量分数的计算式为。29. 某工厂将矿物燃料燃烧产生的废气中的SO2收集起来,既可以生产稀硫酸,又能制备氢气。其反应过程如下图所示: (1)、写出反应器中发生化学反应的方程式。(2)、反应器中S元素的化合价变化为+4→。(3)、膜反应器中发生的是分解反应,则X的化学式是。30. 如图所示,进行CO2性质实验。
(1)、写出反应器中发生化学反应的方程式。(2)、反应器中S元素的化合价变化为+4→。(3)、膜反应器中发生的是分解反应,则X的化学式是。30. 如图所示,进行CO2性质实验。 (1)、该实验观察到的现象是(2)、由该实验能得到的结论有(填序号)
(1)、该实验观察到的现象是(2)、由该实验能得到的结论有(填序号)A CO2密度比空气大 B CO2不能燃烧 C CO2不支持燃烧
31. 用下图所示装置去除粗盐中的泥沙 (1)、实验的主要步骤是:③→→(填序号)。(2)、溶解时,用玻璃棒搅拌的目的是。32. 为探究铁、铜、银三种金属的活动性顺序,设计了如图所示方案。
(1)、实验的主要步骤是:③→→(填序号)。(2)、溶解时,用玻璃棒搅拌的目的是。32. 为探究铁、铜、银三种金属的活动性顺序,设计了如图所示方案。 (1)、证明铁的活动性比铜强的现象是。(2)、若要比较Ag和Cu的活动性顺序,可将稀盐酸替换为
(1)、证明铁的活动性比铜强的现象是。(2)、若要比较Ag和Cu的活动性顺序,可将稀盐酸替换为A 稀硫酸 B 硝酸银溶液 C 硫酸亚铁溶液
33. 用如图装置研究分子的性质。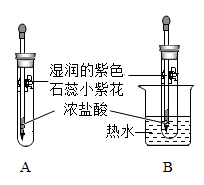 (1)、同时挤出实验A、B中的浓盐酸,观察到的现象是。(2)、该实验说明分子的性质是:温度越高,。
(1)、同时挤出实验A、B中的浓盐酸,观察到的现象是。(2)、该实验说明分子的性质是:温度越高,。三、综合题
-
34. 阅读下面科普短文。
随着环境意识的提高,人们对室内空气质量越来越关心。下表列举了室内空气的主要污染物及来源。
污染源
污染物
建筑材料
NH3、甲醛(CH2O)、苯(C6H6)、甲苯(C7H8)、石棉纤维等
家具
甲醛(CH2O)、甲苯(C7H8)等
办公用品
O3、电磁辐射等
烹饪
CO、NO2、SO3、PM10等
室内微生物
结核杆菌、霉菌等
从上表看出室内污染物种类繁多,其中室内甲醛污染已被列入对公众健康影响最大的环境因素之一、室内空气中的甲醛主要来自于人造板材料制作的家具、地板以及胶黏剂等。这些材料用的越多,甲醛在室内空气中的浓度越高。甲醛的释放期非常长,人们打开人造板家具柜门时,闻到的刺激性气味主要是甲醛的气味。
改善室内空气质量的方法有很多。
通常情况下,开窗通风是改善室内空气质量最有效的方法。
运用功能性装饰材料也可以改善室内空气质量。研究表明硅藻泥也可以净化空气。硅藻泥的主要成分是硅藻土,是由水生浮游类生物沉积而成。电子显微镜显示,硅藻土粒子表面具有无数微小的孔穴,功能与活性炭相似。正是这种多孔的结构,使硅藻泥成为具有净化空气功能的内墙装饰材料。
“光触媒技术”是20世纪70年代发展起来的一门新兴技术。“光触媒”是一种纳米
级材料,具有强烈的催化分解功能。图一就是“光触媒”技术应用于分解甲醛、氨气、甲苯等有害物质的原理图。

空气净化器是净化室内空气的重要设备。图二是某品牌空气净化器的净化效果图,其中a、b、c是甲醛随开机时间浓度变化的三条曲线。
为满足人们对健康住宅的需求,提高人们的生活质量,使生活由舒适型向健康型方向发展,人们正在不断优化新的技术。
依据短文内容,回答下列问题:
(1)、CO、NO2、SO3都属于(填“单质”或“氧化物”)。(2)、甲醛的污染源是。(填出一种即可)(3)、“光触媒技术”可将甲醛等污染物转化为水和二氧化碳,依据图一写出该反应的条件:。(4)、依据图二提出一条使用空气净化器的合理化建议:。(5)、下列说法正确的是(填序号)。A 甲醛是有刺激性气味的气体
B 硅藻泥通过化学变化净化了空气
C 吸收、转化、降低室内污染物的浓度都可以改善室内空气质量
35. 40%的甲醛(HCHO)溶液被称为福尔马林,用于生物标本保存。工业上可用甲醇(CH3OH)氧化得到,其生产过程如下图所示:
回答下列问题:
(1)、甲醛(HCHO)属于(填“有机物”或“无机物”)。(2)、碱洗池内除去CO2的反应方程式为。(3)、蒸馏室中发生的变化属于(填“物理变化”、“化学变化”)。36. 请从A或B两题中任选一个作答,若两题均作答,按A计分。
A
B
⑴实验室用高锰酸钾制取氧气的化学方程式是。
⑵选用的发生装置和收集装置分别是。
⑶检验集气瓶内为氧气的操作是。
⑴实验室制取二氧化碳的化学方程式是。
⑵选用的发生装置和收集装置分别是。
⑶检验集气瓶内若为二氧化碳的操作是。
37. 用如图装置进行“铁丝在氧气中燃烧”的实验。 (1)、该反应的化学方程式是。(2)、实验现象是:剧烈燃烧,火星四射,放出热量,生成。38. 烧杯A中盛有一定量的碳酸钠溶液,进行如图所示的实验。
(1)、该反应的化学方程式是。(2)、实验现象是:剧烈燃烧,火星四射,放出热量,生成。38. 烧杯A中盛有一定量的碳酸钠溶液,进行如图所示的实验。 (1)、碳酸钠溶液显碱性,得出此结论的依据是。(2)、步骤②中发生反应的化学方程式为。(3)、步骤③观察到的现象是烧杯中产生气泡,红色褪去,。39. 某兴趣小组同学利用下图装置探究可燃物燃烧的条件。
(1)、碳酸钠溶液显碱性,得出此结论的依据是。(2)、步骤②中发生反应的化学方程式为。(3)、步骤③观察到的现象是烧杯中产生气泡,红色褪去,。39. 某兴趣小组同学利用下图装置探究可燃物燃烧的条件。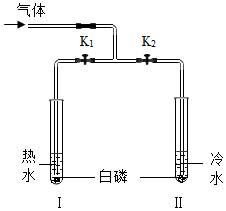
实验过程:①打开K1、K2 , 通入N2一段时间后,Ⅰ、Ⅱ试管中均无明显现象。
②改通入氧气,Ⅰ中白磷燃烧,Ⅱ中无明显现象。
(1)、白磷燃烧的化学方程式为(2)、实验①中,Ⅰ试管中白磷不燃烧的原因是。(3)、能说明可燃物燃烧需要温度达到着火点的现象是。40. 高锰酸钾在生产、生活中有广泛的应用。实验小组同学查阅资料得知,草酸(H2C2O4)可使滴有硫酸的高锰酸钾溶液褪色,但不同条件下褪色时间不同,即反应的速率不同。小组同学进行了如下探究。(提出问题)影响该反应反应速率的因素有哪些?
(作出猜想)影响该反应反应速率的因素有温度、催化剂、硫酸的浓度等。
(查阅资料)
硫酸锰(MnSO4)可作该反应的催化剂。
(进行实验)
取A、B、C、D4支试管,每支试管中分别加入4mL0.08%的KMnO4溶液、0.4mL的硫酸、1mL0.09%的H2C2O4溶液。

(实验记录)
序号
所滴硫酸浓度
温度
催化剂
高锰酸钾完全褪色时间
A
98%
室温
无
72s
B
65%
室温
无
129s
C
65%
50℃
无
16s
D
65%
室温
MnSO4
112s
(1)、(解释与结论)草酸使高锰酸钾溶液褪色反应的化学方程式如下,请在横线上补全方程式。2KMnO4+5H2C2O4+3H2SO4=K2SO4 +2MnSO4+10CO2↑+8
(2)、4支试管中作为对照实验的是(填序号,下同)。(3)、对比实验A和B可得出的结论是。(4)、设计实验B和C的目的是。(5)、探究催化剂对该反应反应速率影响的实验是。(6)、(反思与交流)影响该反应反应速率的因素除温度、催化剂、硫酸的浓度外,还可能有。
四、计算题
-
41. 甲酸(HCOOH)具有清洁制氢的巨大潜力,其分解前后分子种类变化的微观示意图如下:

求:若要制得2g氢气,需要甲酸的质量为多少g?