北京市房山区燕山地区2021年中考化学二模试卷
试卷更新日期:2021-07-28 类型:中考模拟
一、单选题
-
1. 下列元素中,属于金属元素的是( )A、氖 B、氧 C、锌 D、磷2. 为防止骨质疏松,应补充的元素是( )A、铁 B、钙 C、锌 D、钠3. 下列燃料,不属于化石燃料的是( )A、天然气 B、煤 C、酒精 D、石油4. 下列物质放入水中,能形成溶液的是( )A、食盐 B、面粉 C、牛奶 D、花生油5. 下图所示实验操作正确的是( )A、
 点燃酒精灯
B、
点燃酒精灯
B、 滴加液体
C、
滴加液体
C、 移开蒸发皿
D、
移开蒸发皿
D、 读取液体体积
6. 下列做法不会增加空气中PM2.5的是( )A、焚烧秸秆 B、植树造林 C、燃放鞭炮 D、排放烟尘7. 一种氮原子的原子核内含有7个质子和8个中子,则该氮原子的核外电子数为( )A、15 B、8 C、7 D、18. 春暖花开的季节,处处鸟语花香。能闻到花香的主要原因是( )A、分子之间有间隔 B、分子的质量很小 C、分子是不断运动的 D、分子的体积很小9. 氢氧化钠是重要的化工原料,其俗称是( )A、纯碱 B、烧碱 C、小苏打 D、熟石灰10. 下列属于厨余垃圾的是( )A、旧报刊 B、一次性餐具 C、水果皮 D、废旧电池11. 配制50g溶质的质量分数为6%的氯化钠溶液,不需要的仪器是( )A、蒸发皿 B、玻璃棒 C、烧杯 D、量筒12. 下列微粒中,能表示1个氧分子的是( )A、2O B、O2- C、O2 D、2O213. 下列物质在氧气中燃烧,火星四射、生成黑色固体的是( )A、木炭 B、铁丝 C、蜡烛 D、红磷14. 下列金属制品中,利用金属导热性的是()A、金戒指
读取液体体积
6. 下列做法不会增加空气中PM2.5的是( )A、焚烧秸秆 B、植树造林 C、燃放鞭炮 D、排放烟尘7. 一种氮原子的原子核内含有7个质子和8个中子,则该氮原子的核外电子数为( )A、15 B、8 C、7 D、18. 春暖花开的季节,处处鸟语花香。能闻到花香的主要原因是( )A、分子之间有间隔 B、分子的质量很小 C、分子是不断运动的 D、分子的体积很小9. 氢氧化钠是重要的化工原料,其俗称是( )A、纯碱 B、烧碱 C、小苏打 D、熟石灰10. 下列属于厨余垃圾的是( )A、旧报刊 B、一次性餐具 C、水果皮 D、废旧电池11. 配制50g溶质的质量分数为6%的氯化钠溶液,不需要的仪器是( )A、蒸发皿 B、玻璃棒 C、烧杯 D、量筒12. 下列微粒中,能表示1个氧分子的是( )A、2O B、O2- C、O2 D、2O213. 下列物质在氧气中燃烧,火星四射、生成黑色固体的是( )A、木炭 B、铁丝 C、蜡烛 D、红磷14. 下列金属制品中,利用金属导热性的是()A、金戒指 B、铝蒸锅
B、铝蒸锅  C、铁锤
C、铁锤  D、铜导线
D、铜导线  15. 下列物质露置于空气中,质量会减小的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠 D、氯化钠16. 下列制作蛋糕的原料中,富含蛋白质的是()A、面粉 B、白糖 C、鸡蛋 D、橄榄油17. 水晶的主要成分是二氧化硅(SiO2),SiO2中硅元素的化合价为( )A、﹣4 B、﹣2 C、﹢2 D、﹢418. 用灯帽盖灭酒精灯的灭火原理是( )A、清除可燃物 B、降低酒精的着火点 C、隔绝空气 D、降低温度至酒精的着火点以下19. 下列物质的用途中,利用其化学性质的是( )A、液氮用作冷冻剂 B、干冰用于人工降雨 C、氧气用于气焊 D、浓硫酸用作干燥剂20. 下列物质中,属于有机物的是( )A、CO B、CO2 C、CH4 D、Ca CO321. 下列属于复分解反应的是( )A、CaO + H2O=Ca(OH)2 B、Mg + H2SO4=MgSO4 + H2↑ C、H2CO3=H2O + CO2↑ D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO422. 下列肥料属于氮肥的是( )A、CO(NH2)2 B、Ca(H2PO4)2 C、KCl D、K2CO323. 能鉴别稀硫酸、烧碱溶液、氯化钠溶液的试剂是( )A、酚酞 B、石蕊 C、澄清石灰水 D、稀盐酸24. 下图表示气体分子的示意图,图中
15. 下列物质露置于空气中,质量会减小的是( )A、浓硫酸 B、浓盐酸 C、氢氧化钠 D、氯化钠16. 下列制作蛋糕的原料中,富含蛋白质的是()A、面粉 B、白糖 C、鸡蛋 D、橄榄油17. 水晶的主要成分是二氧化硅(SiO2),SiO2中硅元素的化合价为( )A、﹣4 B、﹣2 C、﹢2 D、﹢418. 用灯帽盖灭酒精灯的灭火原理是( )A、清除可燃物 B、降低酒精的着火点 C、隔绝空气 D、降低温度至酒精的着火点以下19. 下列物质的用途中,利用其化学性质的是( )A、液氮用作冷冻剂 B、干冰用于人工降雨 C、氧气用于气焊 D、浓硫酸用作干燥剂20. 下列物质中,属于有机物的是( )A、CO B、CO2 C、CH4 D、Ca CO321. 下列属于复分解反应的是( )A、CaO + H2O=Ca(OH)2 B、Mg + H2SO4=MgSO4 + H2↑ C、H2CO3=H2O + CO2↑ D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO422. 下列肥料属于氮肥的是( )A、CO(NH2)2 B、Ca(H2PO4)2 C、KCl D、K2CO323. 能鉴别稀硫酸、烧碱溶液、氯化钠溶液的试剂是( )A、酚酞 B、石蕊 C、澄清石灰水 D、稀盐酸24. 下图表示气体分子的示意图,图中 和
和  分别表示两种不同的原子,其中表示化合物的是( ) A、
分别表示两种不同的原子,其中表示化合物的是( ) A、 B、
B、 C、
C、 D、
D、 25. 已知KNO3的溶解度如下表所示
25. 已知KNO3的溶解度如下表所示温度/℃
10
20
30
40
50
60
70
溶解度/g
20.9
31.6
45.8
63.9
85.5
110
138
下列说法错误的是( )
A、KNO3的溶解度随温度的升高而增大 B、20℃时,向100g水中加入35g KNO3 , 充分搅拌,所得溶液质量为135g C、通过升高温度,能将恰好饱和的KNO3溶液转化为不饱和溶液 D、30℃时,饱和KNO3溶液中溶质的质量分数为 ×100%二、填空题
-
26.(1)、生活中处处离不开水。日常生活中可以用区分硬水和软水。(2)、自来水厂净水过程中用到活性炭,其作用是。(3)、鸡蛋是有生命的,也能呼出二氧化碳。鲜鸡蛋在石灰水中洗一下,能封闭鸡蛋壳上的气孔,防止细菌的侵入, 延长鸡蛋的保鲜期,其化学原理是 (用化学方程式表示)。27. 家用清洁产品中蕴含着丰富的化学知识。根据下表完成下面小题。
清洁产品
除垢净
去污粉
管道通
主要成分
盐酸
碳酸钠
氢氧化钠、铝粉
(1)、去污粉与除垢净不能混合使用,其原因是(用化学方程式表示)。(2)、管道通使用时不能接触皮肤,原因是。(3)、管道通使用时利用Al与NaOH溶液反应放出大量的热,以加快NaOH与淤积物的作用,该反应的化学方程式为 2Al + 2NaOH + 2H2O =2NaAlO2 + 3H2↑。该反应的涉及的物质中属于非金属单质的是。28. 汽车尾气排放的CO严重污染气并对人类健康产生威胁,科学家研究CO在低温条件下的催化氧化取得了较大进展。CO在CuO·CeO2催化剂表面反应的示意图如图所示。 (1)、在反应前后,CuO·CeO2的质量和化学性质(填“有”或“没有”)变化。(2)、在低温条件下,CO催化氧化的化学方程式为。29. 探究NaOH溶液与稀盐酸反应。反应过程中温度和pH的变化。测定结果如图所示。
(1)、在反应前后,CuO·CeO2的质量和化学性质(填“有”或“没有”)变化。(2)、在低温条件下,CO催化氧化的化学方程式为。29. 探究NaOH溶液与稀盐酸反应。反应过程中温度和pH的变化。测定结果如图所示。
①该反应过程属于(填“放热”或“吸热”),化学方程式为。
②分析坐标,推测操作方案是。(填序号)
a.向一定量的氢氧化钠溶液中滴加稀盐酸
b.向一定量的稀盐酸中滴加氢氧化钠溶液
30. “去除粗盐中难溶性杂质”的实验操作如下图所示。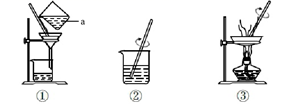 (1)、a仪器的名称是。(2)、正确的操作顺序是(填序号)。(3)、三次用到玻璃棒,其中起“加速溶解”作用的是(填序号)。
(1)、a仪器的名称是。(2)、正确的操作顺序是(填序号)。(3)、三次用到玻璃棒,其中起“加速溶解”作用的是(填序号)。三、综合题
-
31. 阅读下面科普短文。
味精,是增鲜调味品之一,为白色柱状结晶体,常温下不易溶于水,在 70 'C-90 'C时溶解性最好,鲜味最佳。其主要成分为谷氨酸钠(C5H8NO4Na)和食盐。味精被摄入人体中,谷氨酸钠与胃酸(盐酸)作用的生成物(谷氨酸C5H9NO4)很快被消化吸收为蛋白质,谷氨酸还参与脑内蛋白质和糖的代谢,有益于改善和维持脑功能,谷氨酸还对营养不良、小儿大脑发育不全、神经衰弱、癫痫病等有一定的辅助治疗作用。
味精使用时应掌握好用量,人对味精的味觉感为0.033%。以1500倍左右为适宜,如投放量过多,会使菜中产生似咸非咸, 似涩非涩的怪味,造成相反的效果。
味精的鲜味受什么因素影响呢?经实验测定发现,.味精当加热超过120度时,失去鲜味,产生极少量的焦谷氨酸钠,目前没有任何证据表明焦谷氨酸钠对人体有害。下表是焦谷氨酸钠含量与加热温度、加热时间的关系。
加热时间
(小时)
焦谷氨酸钠含量(%)
100℃
107℃
115℃
0.5
0.3
0.4
0.7
1.0
0.6
0.9
1.4
2.0
1.1
1.9
2.8
4.0
2.1
3.6
5.7
实验表明,味精的鲜味与水溶液的酸碱度有关。当pH值在5.5-8.0时,鲜味最强;当pH值小于4.0时鲜味较弱;当pH值大于8.0时由于形成二钠盐而鲜味消失。实验研究还表明,味精对婴幼儿,特别是几周以内的婴儿生长发育有严重影响。它能使婴幼儿血中的锌转变为谷氨酸锌随尿排出,造成体内缺锌。因此产后3个月内乳母和婴幼儿的菜肴不要加入味精。适量食用味精对身体并没有危害。主要是味精中含有钠,人体不能摄入过多的钠,所以味精吃多了的危害和盐吃多了的危害是差不多的。
依据文章内容,回答下列问题
(1)、味精属于 填“混合物”或“纯净物” )。(2)、补全谷氨酸钠与胃酸(盐酸)反应的化学方程式:C5H8NO4Na +HCl = + C5H9NO4(3)、味精的物理性质是。(4)、影响饭菜中焦谷氨酸钠含量的因素有。(5)、下列关于味精的说法中,合理的是。a.拌凉菜使用晶体味精,应先用少量温水溶解,再浇到凉菜上
b.烹饪时加入味精的最佳时间是即将出锅时
c.婴幼儿的食品中不应该加入味精
d.对所有菜肴,使用味精可以使味道更鲜美
e.放入味精的量越多,味道越鲜美
32. 以空气等为原料合成尿素[CO(NH2)2]的转化过程如下: (1)、①属于变化(填“物理”或“化学”)。(2)、在高温、高压和催化剂的作用下,反应②的化学方程式为。(3)、CO(NH2)2中氮元素、氢元素的质量比是。33. 回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如下。
(1)、①属于变化(填“物理”或“化学”)。(2)、在高温、高压和催化剂的作用下,反应②的化学方程式为。(3)、CO(NH2)2中氮元素、氢元素的质量比是。33. 回收利用是保护金属资源的一条有效途径。某工业废料含氧化铜和氧化铁,经过处理后可得到铜和硫酸亚铁溶液,主要流程如下。
已知: CuO + H2SO4 =CuSO4 + H2O;Fe + Fe2(SO4) 3=3FeSO4
(1)、过程II充分反应后,还应有的实验操作是。(2)、溶液B的pH7(填“大于”或“小于”)。(3)、C物质的化学名称是。34. 在实验室中制取CO2 , 并验证其性质。 (1)、实验室制取CO2反应的化学方程式为。(2)、如图装置中,制备、收集CO2的装置分别是(填序号)。(3)、⑤的实验目的是。35. 实验室装置:
(1)、实验室制取CO2反应的化学方程式为。(2)、如图装置中,制备、收集CO2的装置分别是(填序号)。(3)、⑤的实验目的是。35. 实验室装置: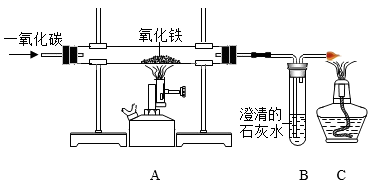 (1)、A处的化学反应方程式是。(2)、证明玻璃管中的化学反应有二氧化碳生成的现象是。(3)、C装置存在的作用是。36. 根据下列实验回答问题。
(1)、A处的化学反应方程式是。(2)、证明玻璃管中的化学反应有二氧化碳生成的现象是。(3)、C装置存在的作用是。36. 根据下列实验回答问题。 (1)、A实验,蜡烛燃烧2分钟后,天平的指针会向(填“左”或“右”)偏转;(2)、B实验,能使带火星的木条复燃的是(填序号)中气体;(3)、C实验,将H2O2溶液推入瓶中,写出集气瓶中发生的化学反应方程式:。37. 钢铁的腐蚀是重要的研究课题。
(1)、A实验,蜡烛燃烧2分钟后,天平的指针会向(填“左”或“右”)偏转;(2)、B实验,能使带火星的木条复燃的是(填序号)中气体;(3)、C实验,将H2O2溶液推入瓶中,写出集气瓶中发生的化学反应方程式:。37. 钢铁的腐蚀是重要的研究课题。基础实验:用图1所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,试管C和试管D中铁钉明显锈蚀。试管D中铁钉严重锈蚀。

 (1)、B中用煮沸蒸馏水的目的是。(2)、对比分析试管C和试管的现象,可推出铁锈蚀必须与氧气接触。(3)、向试管D中(含有生锈铁钉)加入过量的稀盐酸,浸泡一段时间。写出有关的化学方程式。(4)、图2表示水样温度22℃、氧含量6m L﹒L-1时,钢铁腐蚀速率与水样pH的关系。当pH﹤4时,钢铁腐蚀速率明显增大的原因是。(5)、图3表示水样温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系是。(6)、生活中常用在金属表面涂油的方式“防生锈”,其原因是。(7)、拓展实验:研究水样中溶解氧浓度与钢铁腐蚀速率的关系(见图)。
(1)、B中用煮沸蒸馏水的目的是。(2)、对比分析试管C和试管的现象,可推出铁锈蚀必须与氧气接触。(3)、向试管D中(含有生锈铁钉)加入过量的稀盐酸,浸泡一段时间。写出有关的化学方程式。(4)、图2表示水样温度22℃、氧含量6m L﹒L-1时,钢铁腐蚀速率与水样pH的关系。当pH﹤4时,钢铁腐蚀速率明显增大的原因是。(5)、图3表示水样温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系是。(6)、生活中常用在金属表面涂油的方式“防生锈”,其原因是。(7)、拓展实验:研究水样中溶解氧浓度与钢铁腐蚀速率的关系(见图)。
由试管A、B、C中的现象可知,铁的锈蚀是铁跟(填化学式)等物质作用的过程。
(8)、试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是。推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。先进行如下图所示的三个实验(持续10h,已知氢气不影响该反应)。序号
实验Ⅰ
实验Ⅱ
实验Ⅲ
实验内容


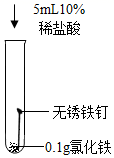
现象
溶液颜色始终呈黄色
产生红褐色沉淀
溶液逐渐由黄色变浅绿色
①设计实验I的目的是。
②综合分析上述三个实验,试管D中溶液由黄色变为浅绿色的原因是。
四、计算题
-
38. 液氢和液氧是火箭发射的常用推进剂。已知卫星要被送达预定轨道,火箭至少要充分燃烧200kg的液氢才能产生足够能量。请依据相关反应的化学方程式计算,为满足这些液氢完全燃烧,至少应在火箭发动机中装入多少kg液氧?