北京市朝阳区2021年中考化学二模试卷
试卷更新日期:2021-07-28 类型:中考模拟
一、单选题
-
1. 空气中体积分数约为21%的气体是()A、氧气 B、氮气 C、二氧化碳 D、水蒸气2. 下列金属活动性最强的是( )A、Ag B、Al C、Cu D、Mg3. 下列物质通常不会损害人体健康的是( )A、一氧化碳 B、黄曲霉素 C、甲醛 D、水4. 下列物质属于纯净物的是( )A、雪碧 B、牛奶 C、干冰 D、食醋5. 奶制品、豆类、虾皮等食物中含钙丰富,这里的“钙”是指( )A、钙元素 B、钙原子 C、钙离子 D、钙单质6. 下列实验操作中,错误的是( )A、
 加热液体
B、
加热液体
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 蒸发食盐水
D、
蒸发食盐水
D、 检查装置气密性
7. 小明的午餐是:米饭、红烧肉、豆浆,从营养均衡角度分析,这份午餐缺少的营养素是( )A、维生素 B、糖类 C、油脂 D、蛋白质8. 下列物质在氧气中燃烧,能生成大量白烟的是( )A、红磷 B、铁丝 C、木炭 D、氢气9. 下列做法不利于保护环境的是( )A、垃圾分类处理 B、乘坐公共交通工具 C、污水处理达标后排放 D、使用一次性塑料餐盒10. 下列符号中,表示2个氯原子的是( )
检查装置气密性
7. 小明的午餐是:米饭、红烧肉、豆浆,从营养均衡角度分析,这份午餐缺少的营养素是( )A、维生素 B、糖类 C、油脂 D、蛋白质8. 下列物质在氧气中燃烧,能生成大量白烟的是( )A、红磷 B、铁丝 C、木炭 D、氢气9. 下列做法不利于保护环境的是( )A、垃圾分类处理 B、乘坐公共交通工具 C、污水处理达标后排放 D、使用一次性塑料餐盒10. 下列符号中,表示2个氯原子的是( )
A、Cl2 B、2Cl2 C、2Cl D、2Cl-11. 下列化肥中,属于钾肥的是( )A、K2SO4 B、NH4NO3 C、CO(NH2)2 D、Ca(H2PO4)212. 下列图标中,表示“禁止烟火”的是( )A、 B、
B、 C、
C、 D、
D、 13. 下列化学反应中,属于置换反应的是( )A、4P+5O2 2P2O5 B、Fe + 2HCl=FeCl2+ H2↑ C、3CO + Fe2O3 2Fe+3CO2 D、CaCO3+2HCl=CaCl2+H2O+CO2↑14. 下列物质中含氧分子的是( )A、H2CO3 B、MnO2 C、SO2 D、O215. 水是生命之源。如图为电解水的实验装置,下列说法正确的是( )
13. 下列化学反应中,属于置换反应的是( )A、4P+5O2 2P2O5 B、Fe + 2HCl=FeCl2+ H2↑ C、3CO + Fe2O3 2Fe+3CO2 D、CaCO3+2HCl=CaCl2+H2O+CO2↑14. 下列物质中含氧分子的是( )A、H2CO3 B、MnO2 C、SO2 D、O215. 水是生命之源。如图为电解水的实验装置,下列说法正确的是( ) A、该实验可用于研究水的组成 B、正极所连的电极上产生的是氢气 C、b中产生的气体可支持燃烧 D、实验过程中漏斗内液面高度不变16. 下列灭火方法错误的是( )A、电器起火—用水浇灭 B、森林起火—砍伐树木形成隔离带 C、油锅起火—用锅盖盖灭 D、图书起火—用二氧化碳灭火器灭火17. 下列物质长时间暴露在空气中,质量会减少的是( )A、木炭 B、烧碱 C、石灰石 D、浓盐酸18. 配制50 g溶质的质量分数为 6%的氯化钠溶液,不需要的仪器是( )A、蒸发皿 B、玻璃棒 C、烧杯 D、量筒19. 建造北京大兴国际机场使用了大量钒钢,下图是钒在元素周期表中的信息及原子结构示意图,由此获得的信息错误的是( )
A、该实验可用于研究水的组成 B、正极所连的电极上产生的是氢气 C、b中产生的气体可支持燃烧 D、实验过程中漏斗内液面高度不变16. 下列灭火方法错误的是( )A、电器起火—用水浇灭 B、森林起火—砍伐树木形成隔离带 C、油锅起火—用锅盖盖灭 D、图书起火—用二氧化碳灭火器灭火17. 下列物质长时间暴露在空气中,质量会减少的是( )A、木炭 B、烧碱 C、石灰石 D、浓盐酸18. 配制50 g溶质的质量分数为 6%的氯化钠溶液,不需要的仪器是( )A、蒸发皿 B、玻璃棒 C、烧杯 D、量筒19. 建造北京大兴国际机场使用了大量钒钢,下图是钒在元素周期表中的信息及原子结构示意图,由此获得的信息错误的是( ) A、图中x=23 B、钒属于金属元素 C、钒的中子数为50.94 D、钒原子核外有4个电子层20. 下列物质的用途中,利用其化学性质的是( )A、铁用于制作铁锅 B、稀硫酸用于除铁锈 C、食盐用作调味品 D、稀有气体用于制造电光源21. 下列实验方法一定能达到实验目的的是( )A、鉴别硬水和软水——观察透明度 B、硬水软化成软水——用活性炭吸附 C、鉴别氧气和二氧化碳——伸入燃着的木条 D、除去硫酸铜溶液中的硫酸——加入铜粉22. 下列实验设计不能达到实验目的的是( )
A、图中x=23 B、钒属于金属元素 C、钒的中子数为50.94 D、钒原子核外有4个电子层20. 下列物质的用途中,利用其化学性质的是( )A、铁用于制作铁锅 B、稀硫酸用于除铁锈 C、食盐用作调味品 D、稀有气体用于制造电光源21. 下列实验方法一定能达到实验目的的是( )A、鉴别硬水和软水——观察透明度 B、硬水软化成软水——用活性炭吸附 C、鉴别氧气和二氧化碳——伸入燃着的木条 D、除去硫酸铜溶液中的硫酸——加入铜粉22. 下列实验设计不能达到实验目的的是( )选项
A
B
C
D
实验设计




实验目的
探究温度对分子运动速率的影响
验证CO2密度大于空气、不燃烧不支持燃烧
比较高锰酸钾在水和汽油中的溶解性
验证水是否是铁生锈的因素
A、A B、B C、C D、D23. 高铁酸钾(K2FeO4)是一种新型高效水处理剂。下列有关说法正确的是( )A、高铁酸钾属于混合物 B、高铁酸钾由钾、铁、氧3种元素组成 C、高铁酸钾中氧元素的质量分数最大 D、高铁酸钾中钾元素与铁元素的质量比为2:124. 硝酸钾的溶解度曲线如图所示,a、b、c三点对应的溶液分别是用100g水配制的硝酸钾溶液。下列说法正确的是( )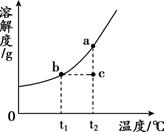 A、溶质的质量分数:a>b>c B、由b→c需加入一定量的水 C、由c→a需加入适量硝酸钾 D、a、b、c三点对应的溶液均为饱和溶液25. 中国科学家以CO2和H2为原料制备丁烷(C4H10),反应的微观示意图如下、下列说法错误的是( )
A、溶质的质量分数:a>b>c B、由b→c需加入一定量的水 C、由c→a需加入适量硝酸钾 D、a、b、c三点对应的溶液均为饱和溶液25. 中国科学家以CO2和H2为原料制备丁烷(C4H10),反应的微观示意图如下、下列说法错误的是( )
 A、丁烷属于有机化合物 B、该反应前后分子和原子的数目均改变 C、催化剂的质量和化学性质在反应前后均不变 D、反应的化学方程式为4CO2 +13 H2 8H2O + C4H10
A、丁烷属于有机化合物 B、该反应前后分子和原子的数目均改变 C、催化剂的质量和化学性质在反应前后均不变 D、反应的化学方程式为4CO2 +13 H2 8H2O + C4H10二、填空题
-
26. 人们的生产生活离不开能源。(1)、目前使用的燃料大多来自化石燃料,如煤、、天然气等。天然气的主要成分CH4完全燃烧的化学方程式为。(2)、氢气是理想能源,水分解可获得氢气和氧气。科学家研究了一种新型催化剂,实现了在光照下分解水,反应的化学方程式为。(3)、长征运载火箭使用了液氢和液氧作为推进剂,从微观的角度分析,氢气变为液氢时,变化的是。27. 如图为汽车安全气囊构造图,请回答下列问题。
 (1)、电子点火器中用铜作导线,利用了铜的延展性和性。(2)、安全气囊内的叠氮化钠(NaN3)受热分解产生一种气体单质,该气体是(填化学式)。28. 生活处处有化学。(1)、炉具清洁剂能使无色酚酞溶液变红,则该清洁剂的pH(填“大于7”“等于7”或“小于7”)。(2)、药品“氢氧化铝[Al(OH)3]”片剂能与胃酸(主要成分为盐酸)发生中和反应,治疗胃酸过多症,该反应的化学方程式为。(3)、餐具消毒需用到有效氯质量分数为0.04%的消毒液,现将1kg有效氯质量分数为6%的消毒液加水稀释,可得到kg的该餐具消毒液。(4)、氧化钙能与水反应,此反应可用于______(填字母序号)。A、吸收水分 B、制熟石灰 C、加热食物29. 用下图所示的装置进行实验,研究物质的化学性质。
(1)、电子点火器中用铜作导线,利用了铜的延展性和性。(2)、安全气囊内的叠氮化钠(NaN3)受热分解产生一种气体单质,该气体是(填化学式)。28. 生活处处有化学。(1)、炉具清洁剂能使无色酚酞溶液变红,则该清洁剂的pH(填“大于7”“等于7”或“小于7”)。(2)、药品“氢氧化铝[Al(OH)3]”片剂能与胃酸(主要成分为盐酸)发生中和反应,治疗胃酸过多症,该反应的化学方程式为。(3)、餐具消毒需用到有效氯质量分数为0.04%的消毒液,现将1kg有效氯质量分数为6%的消毒液加水稀释,可得到kg的该餐具消毒液。(4)、氧化钙能与水反应,此反应可用于______(填字母序号)。A、吸收水分 B、制熟石灰 C、加热食物29. 用下图所示的装置进行实验,研究物质的化学性质。 (1)、若向试管①②中分别滴加碳酸钠溶液,实验目的是。(2)、若用试管③验证Zn、Cu的金属活动性强弱,应进行的操作是。(3)、若向试管②中依次加入紫色石蕊溶液、氢氧化钠溶液,实验过程中观察到溶液由红色变为紫色,用化学方程式解释其原因:。30. 用如图所示的装置进行实验,研究可燃物燃烧的条件。
(1)、若向试管①②中分别滴加碳酸钠溶液,实验目的是。(2)、若用试管③验证Zn、Cu的金属活动性强弱,应进行的操作是。(3)、若向试管②中依次加入紫色石蕊溶液、氢氧化钠溶液,实验过程中观察到溶液由红色变为紫色,用化学方程式解释其原因:。30. 用如图所示的装置进行实验,研究可燃物燃烧的条件。已知:白磷的着火点为40℃,红磷的着火点为240℃。
 (1)、当H2O2溶液与MnO2接触时,发生反应的化学方程式为。(2)、向Y型管中挤入H2O2溶液后,烧杯中导管口有气泡冒出,刚开始白磷不燃烧,一段时间后白磷燃烧,此现象证明可燃物燃烧的条件是;证明可燃物燃烧的另一个条件,依据的现象是。
(1)、当H2O2溶液与MnO2接触时,发生反应的化学方程式为。(2)、向Y型管中挤入H2O2溶液后,烧杯中导管口有气泡冒出,刚开始白磷不燃烧,一段时间后白磷燃烧,此现象证明可燃物燃烧的条件是;证明可燃物燃烧的另一个条件,依据的现象是。三、综合题
-
31. 阅读下面科普短文。
酿造酱油是将大豆中的蛋白质经发酵分解成有鲜味的氨基酸而制成的调味品,生抽和老抽均属于酿造酱油。生抽颜色浅,味道鲜咸,可替代食盐使用,适合凉拌和炒菜。老抽颜色深,味道鲜美微甜,适合给卤味腊味菜肴上色。
酱油中氨基酸酞氮含量越高,酱油品质越好。为探究温度、放置时间及氧气量对酱油品质的影响,实验小组取等量同种酱油,分别装入多个500 mL的透明玻璃瓶和透明保鲜瓶(保鲜瓶挤出盛放的物质后,空气不会进入),密封后置于不同温度的恒温箱中进行实验,检测L*值,L*值越大,酱油品质越好。
实验1
实验2
实验操作
每隔15天,从不同恒温箱中取未开封的玻璃瓶中的酱油,检测L*值
将28 ℃恒温箱中的两瓶酱油,每隔15天各倒出100mL酱油,检测L*值
检测结果


高温会破坏酱油中的氨基酸,使酱油中的糖分焦化变酸。夏天,酱油容易长出一层白膜,这是由于产膜性酵母菌污染酱油后引起酱油发霉的现象,食用后对人体有害。
依据文章内容回答下列问题。
(1)、酿造酱油的过程属于(填“物理变化”或“化学变化”)。(2)、辨别生抽与老抽的方法(写一条即可)。(3)、酱油在夏天会长出白膜的原因是。(4)、分析实验2的检测结果,得出的结论是。(5)、下列说法正确的是______。A、酱油最好密封低温保存 B、氨基酸酞氮含量越高,酱油品质越好 C、烹制菜肴时,高温会使酱油中的糖分焦化32. 从钴酸锂废极片(主要成分LiCoO2)中回收得到Co2O3和Li2CO3的一种工艺流程如下。
 (1)、在实验室中完成操作1、2时,用到的玻璃仪器是(填一种即可)。(2)、CoC2O4在空气中焙烧生成Co2O3和一种气体,推测该气体是CO2 , 从元素守恒的角度说明理由:。(3)、操作4中,洗涤固体Li2CO3时,用热水比用冷水洗涤损耗更少,说明Li2CO3的溶解度随温度升高而。33. 工业上生产硫酸的主要流程如下。
(1)、在实验室中完成操作1、2时,用到的玻璃仪器是(填一种即可)。(2)、CoC2O4在空气中焙烧生成Co2O3和一种气体,推测该气体是CO2 , 从元素守恒的角度说明理由:。(3)、操作4中,洗涤固体Li2CO3时,用热水比用冷水洗涤损耗更少,说明Li2CO3的溶解度随温度升高而。33. 工业上生产硫酸的主要流程如下。 (1)、设备1中采用喷淋法加入液态硫的目的是。(2)、设备2中发生化合反应,反应的化学方程式为。(3)、上述流程中的物质,属于氧化物的除H2O外,还有。(4)、上述流程中的含硫物质,硫元素的化合价有种。34. 根据下图实验回答问题。
(1)、设备1中采用喷淋法加入液态硫的目的是。(2)、设备2中发生化合反应,反应的化学方程式为。(3)、上述流程中的物质,属于氧化物的除H2O外,还有。(4)、上述流程中的含硫物质,硫元素的化合价有种。34. 根据下图实验回答问题。 (1)、实验室用高锰酸钾制氧气,应选择的发生装置是(填序号,下同)。(2)、装置C中发生反应的化学方程式为。(3)、若用装置D验证只有水或只有二氧化碳不能使石蕊试纸变红,则X可能是下列物质中或。
(1)、实验室用高锰酸钾制氧气,应选择的发生装置是(填序号,下同)。(2)、装置C中发生反应的化学方程式为。(3)、若用装置D验证只有水或只有二氧化碳不能使石蕊试纸变红,则X可能是下列物质中或。A.稀硫酸 B.浓硫酸 C.NaOH溶液 D.NaCl溶液
35. 用甲、乙两组实验证明二氧化碳能与氢氧化钠反应。已知:通常状况下,1体积水约能溶解1体积二氧化碳。
 (1)、甲实验,证明二氧化碳能与氢氧化钠反应的现象是 , 该反应的化学方程式为。(2)、乙实验,测得瓶内气压变化如图所示。
(1)、甲实验,证明二氧化碳能与氢氧化钠反应的现象是 , 该反应的化学方程式为。(2)、乙实验,测得瓶内气压变化如图所示。①首先注入瓶中的药品是(填“H2O”或“NaOH溶液”)。
②对比坐标图中的两段曲线,可证明二氧化碳能与氢氧化钠反应。
36. 向饱和碳酸钠溶液中通入CO2会析出碳酸氢钠晶体而使溶液变浑浊,发生的反应为Na2CO3+CO2+H2O=2NaHCO3。某同学发现不同条件下出现浑浊的时间不同。(提出问题)影响碳酸氢钠晶体产生速率的因素有哪些?
(猜想与假设)影响碳酸氢钠晶体产生速率的因素有:温度、试管内径、CO2流速、饱和碳酸钠溶液的体积。
(进行实验)实验装置如下图所示。每次实验时均在试管里加入1mL饱和碳酸钠溶液并测定相同浑浊程度所需时间,记录如下:
实验序号
温度(℃)
试管内径(mm)
CO2流速(个/秒)
时间(秒)
①
25
10
5~8
317
②
32
10
5~8
230
③
40
10
5~8
228
④
25
14
5~8
396
⑤
25
25
5~8
525
⑥
25
10
10~13
302
⑦
x
10
2~5
340

(解释与结论)
(1)、补全锥形瓶中发生反应的化学方程式:□NaHCO3+□H2SO4=□Na2SO4+ □H2O+□CO2↑。(2)、实验①④⑤研究的影响因素是。(3)、得出“二氧化碳流速越快,碳酸氢钠晶体产生速率越快”的结论,依据的3个实验是⑦和(填实验序号),⑦中x为。(4)、结合实验①②③,可得出的结论是。(5)、若要研究饱和碳酸钠溶液的体积对碳酸氢钠晶体产生速率是否有影响,需要控制的变量有。四、计算题
-
37. “蛟龙号”是我国研制的深海载人潜水器。潜水器的供氧装置中发生的反应为2Na2O2+2CO2=2Na2CO3+O2。计算:用这种方法制取16g氧气,需要过氧化钠的质量。