北京市昌平区2021年中考化学二模试卷
试卷更新日期:2021-07-28 类型:中考模拟
一、单选题
-
1. 空气成分中,体积分数最大的是()A、氧气 B、氮气 C、稀有气体 D、二氧化碳
-
2. 下列属于纯净物的是( )A、五氧化二磷 B、大理石 C、加碘食盐 D、食醋
-
3. 下列富含维生素的物质是( )A、鸡蛋 B、大米 C、西瓜 D、花生油
-
4. 地壳中含量最多的元素是( )A、硅 B、氧 C、铁 D、铝
-
5. 下列物质的主要成分属于氧化物的是( )A、
 钻石(C)
B、
钻石(C)
B、 水晶(SiO2)
C、
水晶(SiO2)
C、 食盐(NaCl)
D、
食盐(NaCl)
D、 钟乳石(CaCO3)
钟乳石(CaCO3)
-
6. 下列不属于化石燃料的是A、煤 B、石油 C、酒精 D、天然气
-
7. 下列不属于铁丝在氧气中燃烧现象的是( )A、放出热量 B、产生大量白烟 C、火星四射 D、生成黑色固体
-
8. 一些物质的pH范围如下,其中呈酸性的是( )A、番茄汁(4.0 ~ 4.4) B、鸡蛋清(7.6 ~ 8.0) C、肥皂水(8.3 ~ 9.1) D、草木灰水(10.3 ~ 11.1)
-
9. 下列物质中,属于溶液的是( )A、牛奶 B、豆浆 C、冰水 D、糖水
-
10. 下列物质的用途中,利用其化学性质的是( )A、干冰用作制冷剂 B、铜用于制作铜火锅 C、氧气用于焊接金属 D、金刚石用于切割玻璃
-
11. 下列物品所使用的主要材料为金属材料的是( )A、
 陶瓷花瓶
B、
陶瓷花瓶
B、 纯棉帽子
C、
纯棉帽子
C、 黄金首饰
D、
黄金首饰
D、 塑料油瓶
塑料油瓶
-
12. 水果散发出诱人的香味,你能闻到香味的原因是( )A、分子的体积很小 B、分子在不断运动 C、分子之间有间隔 D、分子的质量很小
-
13. 下列符号能表示2个氯分子的是( )A、Cl2 B、2Cl2 C、2Cl D、2Cl-
-
14. 下列金属中金属活动性最弱的是( )A、Cu B、Zn C、Al D、Mg
-
15. 下列仪器不能加热的是( )A、烧杯 B、试管 C、量筒 D、燃烧匙
-
16. 下列实验操作中,正确的是( )A、
 加热液体
B、
加热液体
B、 过滤
C、
过滤
C、 稀释浓硫酸
D、
稀释浓硫酸
D、 称量固体氯化钠
称量固体氯化钠
-
17. 生活中除去脏物的办法很多,下列现象属于乳化现象的是( )A、用汽油洗去手上的油污 B、用醋洗去水壶上的水垢 C、用洗洁精洗去餐具上的油污 D、用水洗去盘子上的水果渣
-
18. 镍在元素周期表中的信息如图所示,下列有关镍元素的说法错误的是( )
 A、原子序数是28 B、属于金属元素 C、元素符号是Ni D、一个原子的实际质量是58.69 g
A、原子序数是28 B、属于金属元素 C、元素符号是Ni D、一个原子的实际质量是58.69 g -
19. 下列物质常用治疗胃酸过多的是( )A、小苏打 B、烧碱 C、食盐 D、纯碱
-
20. 下列物质溶于水时,溶液温度明显降低的是( )A、氯化钠 B、硝酸铵 C、浓硫酸 D、氢氧化钠
-
21. 如图所示的一组实验可用于研究燃烧条件。下列说法中,正确的是( )
 A、此组实验烧杯中的热水只起提高温度的作用 B、图1中水下白磷未燃烧是由于没有与氧气接触 C、图1实验不能比较白磷和红磷的着火点高低 D、若将图2中白磷换成红磷,也能观察到燃烧现象
A、此组实验烧杯中的热水只起提高温度的作用 B、图1中水下白磷未燃烧是由于没有与氧气接触 C、图1实验不能比较白磷和红磷的着火点高低 D、若将图2中白磷换成红磷,也能观察到燃烧现象 -
22. 如图所示,在白色点滴板1~6的孔穴中,分别滴加2滴无色酚酞溶液。下列说法错误的是( )
 A、空穴3起空白对照作用 B、因为空穴 2和5中是酸溶液,所以都为无色 C、孔穴6中溶液变为红色,说明碳酸钾溶液显碱性 D、再向孔穴1中滴加足量盐酸,溶液的颜色变为蓝色
A、空穴3起空白对照作用 B、因为空穴 2和5中是酸溶液,所以都为无色 C、孔穴6中溶液变为红色,说明碳酸钾溶液显碱性 D、再向孔穴1中滴加足量盐酸,溶液的颜色变为蓝色 -
23. 下列实验操作能达到实验目的的是( )
选项
实验目的
实验操作
A
鉴别硬水和软水
加入活性炭
B
比较Fe、Cu、Ag的金属活动性
把铁丝、银丝分别浸入CuSO4溶液
C
除去铁制品上的铁锈
将铁制品长时间浸泡在过量的稀硫酸中
D
验证NaCl溶液中混有盐酸
取少量溶液,滴加NaOH溶液
A、A B、B C、C D、D
二、选择题组
-
24. 依据实验和溶解度曲线完成下面小题。
a、b两种固体的溶解度曲线如图所示。t1℃时,将40g固体加入到盛有100g水的烧杯中,充分搅拌后,现象如图①;升温到t2℃时,现象如图②;再加5g固体,现象如图③。
 (1)、上述溶液饱和的是( )A、① B、② C、①③ D、①②③(2)、下列说法错误的是( )A、①中加入的固体是a B、②中蒸发水后可析出固体 C、③中溶质与溶剂的质量比为2:5 D、②③中溶液的溶质质量分数不相等
(1)、上述溶液饱和的是( )A、① B、② C、①③ D、①②③(2)、下列说法错误的是( )A、①中加入的固体是a B、②中蒸发水后可析出固体 C、③中溶质与溶剂的质量比为2:5 D、②③中溶液的溶质质量分数不相等
三、填空题
-
25. 1918年,弗里茨·哈伯因发明工业合成氨技术获得诺贝尔化学奖。(1)、氮气和氢气在高温、高压、催化剂条件下合成氨气(NH3),写出该反应的化学方程式。(2)、合成氨的工业化生产提供的化肥加速了世界农业的发展。以下属于氮肥的是(填序号)。
A尿素CO(NH2)2 B氯化铵NH4Cl C硫酸钾K2SO4
(3)、液氨气化吸热,可用作制冷剂,该过程发生的是(填“物理”或“化学”)变化。 -
26. 1945年,弗莱明、弗洛里和钱恩因“发现青霉素及其临床效用”而共同荣获了诺贝尔生理学或医学奖。青霉素(C16H18N2O4S)是常用的抗菌药品。(1)、青霉素的相对分子质量的计算式为。(2)、青霉素使用前必须先做皮内试验,注射液或皮试液要现用现配,说明青霉素可能具有的化学性质是(写出一条即可)。
-
27. 2005年,巴里·马歇尔与罗宾·沃伦发现了幽门螺杆菌,获得诺贝尔生理学或医学奖。(1)、碳14呼气试验是临床用于检测幽门螺杆菌感染的一种方法,完成下列填空。
原子种类
质子数
中子数
相对原子质量
Cl4
6
14
Cl2
6
6
12
(2)、碳12和碳14都称为碳元素的依据是。 -
28. 2015年,屠呦呦因发现治疗疟疾的新药物——青蒿素(C15H22O5),与另外两位科学家获2015年度诺贝尔生理学或医学奖。(1)、从物质分类角度看,青蒿素属于(填“无机”或“有机”) 化合物。(2)、有关青蒿素的说法正确的是(填序号)。
A.青蒿素由42个原子构成 B.青蒿素由碳、氢、氧三种元素组成
C.一个青蒿素分子中有11个氢分子 D.青蒿素中碳元素质量分数最大
-
29. 2019年,约翰·古迪纳夫、斯坦利·威廷汉、吉野彰三位科学家因在锂离子电池方面的研究贡献,获得诺贝尔化学奖。(1)、手机电池基本都是锂离子电池,使用过程中是将化学能转化为能。(2)、电池正极材料含有LiCoO2 , 锂元素(Li)的化合价为+1,则钴元素(Co)的化合价为。
-
30. 炼铁的主要原料是赤铁矿石(主要成分为Fe2O3)、焦炭、空气等,转化过程如图:
 (1)、②中发生反应的微观示意图如图,请在方框内补全相应微粒的图示。
(1)、②中发生反应的微观示意图如图,请在方框内补全相应微粒的图示。 (2)、③中发生反应的化学方程式为。
(2)、③中发生反应的化学方程式为。 -
31. 根据如图回答问题请从A或B两题中任选1个作答,若两题均作答,按A计分。图中装置的夹持仪器已略去。
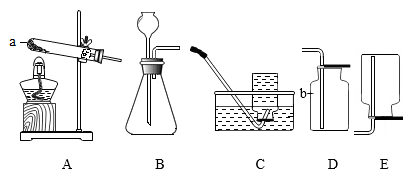
A.O2的实验室制取与性质
B.CO2的实验室制取与性质
⑴仪器a的名称是。
⑵用高锰酸钾制取氧气时,所选用的发生装置是(填序号,下同),收集装置是C或。
⑶用B装置制取氧气,反应的化学方程式为。
⑴仪器b的名称是。
⑵实验室制取二氧化碳时,所选用的发生装置是(填序号,下同),收集装置是。
⑶实验室制取二氧化碳时,反应的化学方程式为。
-
32. 电解水实验如图所示。
 (1)、该实验证明了水是由组成的。(2)、该反应的化学方程式为。
(1)、该实验证明了水是由组成的。(2)、该反应的化学方程式为。 -
33. 去除粗盐中的泥沙。(1)、实验的主要步骤依次是溶解、过滤、。(2)、制作过滤器的过程如图所示,其符合题意操作顺序为(填序号)。

-
34. 如图所示(夹持仪器略去,K1、K2均关闭),打开K1 , 待液体全部流下,立即关闭K1 , 观察到产生大量气泡,且烧杯中A溶液变浑浊。充分反应后,打开K1和K2 , 使液体全部流入锥形瓶,瓶中产生白色沉淀。
 (1)、A物质是。(2)、用化学方程式表示锥形瓶中产生白色沉淀的原因。(3)、反应后锥形瓶中的溶液中一定含有的溶质有。
(1)、A物质是。(2)、用化学方程式表示锥形瓶中产生白色沉淀的原因。(3)、反应后锥形瓶中的溶液中一定含有的溶质有。
四、综合题
-
35. 阅读下面科普短文。
蛋壳的主要成分是碳酸钙,是一种天然的钙源。把蛋壳中的无机钙加工成有机钙(如乳酸钙等),实现了资源的利用和可持续发展。乳酸钙作为钙的强化剂,吸收效果比无机钙好,可广泛用于到食品、化妆品、医药等领域。以废弃蛋壳为原料,通过高温煅烧法制备乳酸钙的原理是:高温煅烧蛋壳后,得到CaO灰分,然后向CaO灰分中加水,得到石灰乳,再将石灰乳与乳酸在一定条件下反应生成乳酸钙。为了获得最佳工艺参数,进行实验:每次准确称取4gCaO灰分,加入50mL水制成石灰乳,分别探究乳酸用量、反应温度、反应时间等变量因素对乳酸钙产率的影响。结果如图所示:


依据文章内容回答下列问题。
(1)、乳酸钙能应用于食品、化妆品、医药等领域的主要原因是。(2)、高温煅烧蛋壳,发生反应的化学方程式为: ,属于基本反应类型中的反应。(3)、向CaO中加水得到石灰乳(主要成分是熟石灰),发生反应的化学方程式为。(4)、要检验鸡蛋壳中含有碳酸钙,需要的试剂是。(5)、废弃蛋壳高温煅烧法制备乳酸钙的最佳工艺条件是。 -
36. 天然碱中主要含有可溶性的Na2CO3、NaHCO3、NaCl、Na2SO4和难溶性物质。下面是以天然碱为原料生产纯碱的主要工艺流程:
 (1)、粉碎天然碱的目的是。(2)、煅烧塔中,NaHCO3分解生成纯碱的化学方程式为。(3)、过滤器的作用是。(4)、残卤液中的溶质除Na2CO3外,一定还含有。
(1)、粉碎天然碱的目的是。(2)、煅烧塔中,NaHCO3分解生成纯碱的化学方程式为。(3)、过滤器的作用是。(4)、残卤液中的溶质除Na2CO3外,一定还含有。 -
37. 用如图所示装置测定空气中氧气的含量。管中预先装入适量的水,测得水面高度为a,加热粗铜丝,一段时间后白磷燃烧。燃烧停止,完全冷却后,测得水面高度为b。(已知除去胶塞部分管的长度为c)
 (1)、白磷燃烧的化学反应方程式为。(2)、水面高度由a上升到b的原因是。(3)、由该实验测得空气中氧气的含量为(用含a、b、c的代数式表示)
(1)、白磷燃烧的化学反应方程式为。(2)、水面高度由a上升到b的原因是。(3)、由该实验测得空气中氧气的含量为(用含a、b、c的代数式表示) -
38. 生活中钢铁腐蚀的基本原理是形成铁-碳原电池,这一原理在人类日常生活中有广泛的应用,比如,铁系脱氧剂和自热暖贴。以生活中糕点中的脱氧剂质量配方(铁粉:活性炭:氯化钠=1:0.15:0.2)为参照,保持铁粉质量固定为5g,在密闭的实验环境中,使用氧气传感器测定铁-碳原电池反应中氧气含量的变化,探究铁-碳原电池反应速率的影响因素。
实验1:探究不同种类的炭粉对反应速率的影响
实验编号
铁粉/g
炭粉/g
氯化钠/g
1-1
5
0.75(活性炭粉)
1
1-2
5
0.75(石墨粉)
1

实验2:探究不同用量的活性炭粉对反应速率的影响
实验编号
铁粉/g
活性炭粉/g
氯化钠/g
2-1
5
0
1
2-2
5
0.75
1
2-3
5
1.5
a

实验3:探究不同用量的氯化钠对反应速率的影响
实验编号
铁粉/g
活性炭粉/g
氯化钠/g
3-1
5
0.75
0
3-2
5
0.75
1
3-3
5
0.75
2
 (1)、(解释与结论)
(1)、(解释与结论)钢铁腐蚀是铁、水和共同作用。
(2)、实验1中使用活性炭粉比石墨粉吸氧效果更好,推测其原因是。(3)、实验2-3中 a = g。(4)、实验3的结论是。(5)、(反思与评价)以下说法正确的是。(填序号)
A铁在氯化钠溶液中比在水中腐蚀速率更快
B在铁—碳原电池中,加入活性炭粉是加快反应速率的关键因素之一
C在铁—碳原电池中,活性炭粉和氯化钠的质量越多越好
D这个实验目的之一可以配制出效果更好的脱氧剂
(6)、放置一段时间的脱氧剂,检验其是否完全失效的方法是。
五、计算题
-
39. 利用化学反应 可实现氢气的存储,计算46 g金属钠最多可吸收氢气的质量。(要求写出计算过程)。
