备战2022 浙教版科学 中考高频考点 加强练 第57讲 溶解度
试卷更新日期:2021-07-28 类型:一轮复习
一、单选题
-
1. 已知(1)20℃时,溶解度在10克以上的物质称为易溶物质,溶解度在1~10克的物质为可溶物质,溶解度在0.01~1克为微溶物质,溶解度小于0.01克的物质为难溶物质。(2)20℃时几种物质的溶解度如下:
物质名称
氯化钠
氢氧化钙
氯酸钾
硝酸钾
溶解度(克)
36.0
0.165
7.4
31.6
下列说法正确的是( )
A、20℃时氢氧化钙是难溶物质 B、20℃时可以配制出20%的硝酸钾溶液 C、20℃时氯酸钾是易溶物质 D、20℃时硝酸钾的溶解度比氯化钠大2. 如图是A、B、C三种物质的溶解度曲线,下列叙述不正确的是( ) A、当温度为t3℃时,物质溶解度关系是A>B>C B、将A,B,C的饱和溶液从t3℃降到t2℃,溶液中均有固体析出 C、若要将N点A溶液变为M点A溶液,可恒温下加入A物质 D、t1℃时65gC的饱和溶液中含有C物质15g3. 有M、N两种物质,20℃时20克水最多溶解5克M,60℃时100克水里最多溶解10克N。则M、N的溶解度大小是( )A、M>N B、M<N C、M=N D、无法比较4. 在温度不变的条件下,将质量相等的质量分数分别为a%与b%(a≠b)两杯的氢氧化钠溶液混合,下列说法中正确的是( )A、混合前后质量没有改变,符合质量守恒定律 B、混合液中溶质的溶解度变大 C、混合后的溶液是氢氧化钠的饱和溶液 D、混合后所得溶液的质量分数为(a%+b%)/25. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )
A、当温度为t3℃时,物质溶解度关系是A>B>C B、将A,B,C的饱和溶液从t3℃降到t2℃,溶液中均有固体析出 C、若要将N点A溶液变为M点A溶液,可恒温下加入A物质 D、t1℃时65gC的饱和溶液中含有C物质15g3. 有M、N两种物质,20℃时20克水最多溶解5克M,60℃时100克水里最多溶解10克N。则M、N的溶解度大小是( )A、M>N B、M<N C、M=N D、无法比较4. 在温度不变的条件下,将质量相等的质量分数分别为a%与b%(a≠b)两杯的氢氧化钠溶液混合,下列说法中正确的是( )A、混合前后质量没有改变,符合质量守恒定律 B、混合液中溶质的溶解度变大 C、混合后的溶液是氢氧化钠的饱和溶液 D、混合后所得溶液的质量分数为(a%+b%)/25. 如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )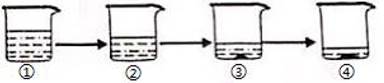 A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,氯化钠的质量分数不断减小 D、在②→④过程中,氯化钠的质量分数先不变后增大6. 如图是A、B两物质的溶解度曲线,下列信息中正确的是( )
A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,氯化钠的质量分数不断减小 D、在②→④过程中,氯化钠的质量分数先不变后增大6. 如图是A、B两物质的溶解度曲线,下列信息中正确的是( ) A、图中阴影部分表明A,B两溶液都是饱和溶液 B、t1℃时,A,B两饱和溶液的溶质质量分数相等 C、t2℃时,B物质的溶解度大于A物质的溶解度 D、t2℃时,等质量的A,B两饱和溶液降温到t1℃时析出溶质的质量相等7. t℃时,在两只各盛有50g水的烧杯中,分别加入30g氯化钠和30g蔗糖固体,搅拌使其充分溶解,结果如图所示。下列说法正确的是( )
A、图中阴影部分表明A,B两溶液都是饱和溶液 B、t1℃时,A,B两饱和溶液的溶质质量分数相等 C、t2℃时,B物质的溶解度大于A物质的溶解度 D、t2℃时,等质量的A,B两饱和溶液降温到t1℃时析出溶质的质量相等7. t℃时,在两只各盛有50g水的烧杯中,分别加入30g氯化钠和30g蔗糖固体,搅拌使其充分溶解,结果如图所示。下列说法正确的是( ) A、两烧杯中的溶液质量相等 B、不断搅拌能增大氯化钠的溶解度 C、蔗糖溶液中溶质的质量分数是60% D、氯化钠溶液一定是该温度下的饱和溶液8. 如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( D )
A、两烧杯中的溶液质量相等 B、不断搅拌能增大氯化钠的溶解度 C、蔗糖溶液中溶质的质量分数是60% D、氯化钠溶液一定是该温度下的饱和溶液8. 如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( D ) A、甲的溶解度大于乙的溶解度 B、降温可使接近饱和的丙溶液变为饱和溶液 C、将t2 ℃甲、乙、丙的饱和溶液降温至t1 ℃,所得溶液的溶质质量分数:乙>甲=丙 D、P点表示t1 ℃时甲、丙两种物质的溶解度都是25g9. 下列各种措施中会影响硝酸钾在水里溶解度大小的是( )A、加水 B、搅拌 C、加硝酸钾 D、升温10. 在保持温度不变的情况下,向如图所示的烧杯中再加入一定质量的水,看到有部分高锰酸钾溶解。则所得溶液与原溶液相比( )
A、甲的溶解度大于乙的溶解度 B、降温可使接近饱和的丙溶液变为饱和溶液 C、将t2 ℃甲、乙、丙的饱和溶液降温至t1 ℃,所得溶液的溶质质量分数:乙>甲=丙 D、P点表示t1 ℃时甲、丙两种物质的溶解度都是25g9. 下列各种措施中会影响硝酸钾在水里溶解度大小的是( )A、加水 B、搅拌 C、加硝酸钾 D、升温10. 在保持温度不变的情况下,向如图所示的烧杯中再加入一定质量的水,看到有部分高锰酸钾溶解。则所得溶液与原溶液相比( ) A、溶质溶解度不变,溶液颜色不变 B、溶质溶解度不变,溶液颜色变深 C、溶剂的质量增加,溶液颜色变浅 D、溶质的质量增加,溶液颜色变深11. 下表是固体甲和乙在不同温度时的溶解度,下列说法中正确的是( )
A、溶质溶解度不变,溶液颜色不变 B、溶质溶解度不变,溶液颜色变深 C、溶剂的质量增加,溶液颜色变浅 D、溶质的质量增加,溶液颜色变深11. 下表是固体甲和乙在不同温度时的溶解度,下列说法中正确的是( )温度/℃
0
20
40
100
甲溶解度/克
0.173
0.165
0.121
0.076
乙溶解度/克
13.3
31.6
63.9
246
A、20℃时,物质的溶解能力大小关系:甲大于乙 B、20℃时,100 克乙物质加入 100 克水中,所得溶液的质量是 200 克 C、100℃时乙物质的饱和溶液冷却到室温会析出晶体后,溶液仍是饱和的 D、20℃时甲物质的饱和溶液升高温度会变为不饱和溶液12. 甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是( )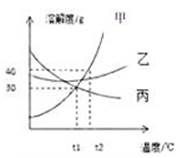 A、t1℃时,相同质量的甲、丙溶液中溶质质量一定相同 B、若甲物质中含有少量乙,可用降温结晶的方法提纯甲 C、将100g甲的饱和溶液从t2℃降温到t1℃,可析岀10g甲物质 D、将甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,所得溶液的溶质质量分数由大到小的顺序为乙>甲=丙13. 如表是不同温度时硝酸钾的溶解度,有关说法正确的是( )
A、t1℃时,相同质量的甲、丙溶液中溶质质量一定相同 B、若甲物质中含有少量乙,可用降温结晶的方法提纯甲 C、将100g甲的饱和溶液从t2℃降温到t1℃,可析岀10g甲物质 D、将甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,所得溶液的溶质质量分数由大到小的顺序为乙>甲=丙13. 如表是不同温度时硝酸钾的溶解度,有关说法正确的是( )温度/℃
20
40
60
80
100
溶解度/克
31.6
63.9
110
169
246
A、40℃时,100克水中溶解的硝酸钾越多溶解度就越大 B、20℃时,100克硝酸钾饱和溶液中含有硝酸钾31.6克 C、100℃的水能溶解的硝酸钾比80℃的水能溶解的硝酸钾多 D、20℃的硝酸钾饱和溶液一定比60℃的硝酸钾饱和溶液的溶质质量分数小14. 某温度时,将100克A物质的溶液分成两等份,将其中一份溶液蒸发掉5克水后,降至原温度,溶液刚好达到饱和:温度不变,在另一份溶液中加入1.2克A物质(该物质不含结晶水),完全溶解并达到饱和,则A物质在该温度下的溶解度为( )A、1.2 B、2.4克 C、24 D、24克15. 如图是甲、乙两种物质的溶解度曲线,下列说法正确的是( ) A、甲物质的溶解度大于乙物质的溶解度 B、t1℃时,100g水最多溶解甲物质的质量和最多溶解乙物质的质量相等 C、t2℃时,甲物质溶液中溶质质量分数比乙物质溶液中溶质质量分数大 D、将t2℃时甲、乙两种物质的饱和溶液降温至t1℃,均无晶体析出
A、甲物质的溶解度大于乙物质的溶解度 B、t1℃时,100g水最多溶解甲物质的质量和最多溶解乙物质的质量相等 C、t2℃时,甲物质溶液中溶质质量分数比乙物质溶液中溶质质量分数大 D、将t2℃时甲、乙两种物质的饱和溶液降温至t1℃,均无晶体析出二、填空题
-
16. 物质的溶解度不同,用途也不同。请据表回答:
表一 物质的溶解度(20℃)
物质
NaOH
Ca(OH)2
CaCO3
CaSO3
溶解度(克)
109
0.165
0.0014
0.0043
表二物质在水中的溶解性等级
200C时的溶解度(克)
>10
1-10
0.01-1
<0.01
等级
易溶
可溶
微溶
难溶
(1)、实验中一般用氢氧化钠溶液吸收二氧化碳而不用澄清石灰水来吸收二氧化碳主要原因是氢氧化钙于水,吸收效果不好。(2)、实验中一般用澄清石灰水检验二氧化碳,但是根据上表可知能使澄清石灰水变浑浊的不一定是二氧化碳,也可能是二氧化硫,请用化学方程式说明 。(3)、20℃时,饱和氢氧化钠溶液的溶质质量分数为。(精确到0.1%)17. 下列数据是硝酸钾固体在不同温度时的溶解度。温度 ℃
O
20
40
60
80
溶解度 g
13.3
31.6
63.9
110
169
(1)、20℃时,向50g水中加入20g硝酸钾,充分溶解后得到的是(填“饱和”或“不饱和”)溶液。(2)、如图所示,小烧杯中盛放的是上述(1)中所得的硝酸钾溶液。若将少量的下列物质分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中没有固体析出的是 (填字母)。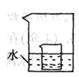 A、冰 B、硝酸铵 C、干冰 D、氢氧化钠18. 20℃时,硝酸钾的溶解度为31.6g∕100g水的意义是.19. 下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答
A、冰 B、硝酸铵 C、干冰 D、氢氧化钠18. 20℃时,硝酸钾的溶解度为31.6g∕100g水的意义是.19. 下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答温度/℃
20
30
40
50
60
溶解度/g
氯化钠
36.0
36.3
36.6
37.0
37.3
硝酸钾
31.6
45.8
63.9
85.5
110
(1)、60℃时,氯化钠的溶解度为g。(2)、欲从海水中获得氯化钠晶体,应采取方法。(3)、请写出一种将硝酸钾的不饱和溶液转化成饱和溶液的方法。(4)、40℃时,100g硝酸钾饱和溶液的溶质质量分数。20. 图表法是一种常用的数据处理方法,结合所给图表回答下列问题。氢氧化钠、碳酸钠分别在水、酒精中的溶解度
物质名称
氢氧化钠
碳酸钠
20℃
40℃
20℃
40℃
水
109g
129g
21.8g
49g
酒精
17.3g
40g
不溶
不溶
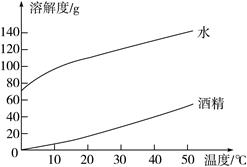 (1)、上述图像表示(选填“氢氧化钠”或“碳酸钠”)的溶解度曲线。(2)、20℃时,氢氧化钠的溶解度(选填“大于”或“小于”)碳酸钠。(3)、40℃时,若将50g氢氧化钠分别投入100g水和100g酒精中,能在(选填“水”或“酒精”)中形成饱和溶液。21. A、B、C三种固体物质的溶解度曲线如图所示。据图回答问题:
(1)、上述图像表示(选填“氢氧化钠”或“碳酸钠”)的溶解度曲线。(2)、20℃时,氢氧化钠的溶解度(选填“大于”或“小于”)碳酸钠。(3)、40℃时,若将50g氢氧化钠分别投入100g水和100g酒精中,能在(选填“水”或“酒精”)中形成饱和溶液。21. A、B、C三种固体物质的溶解度曲线如图所示。据图回答问题: (1)、温度为℃时,A与C物质的溶解度相等。(2)、t2℃时,把A,B物质各30g分别加到50g水中,不能形成饱和溶液的是(填字母)。(3)、t2℃时,将等质量A、B、C三种物质的饱和溶液降温至t1℃,所得的三种溶液中,溶剂质量的大小关系是(用字母和“>”“<”或“=”表示)。22. 表中数据是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答:
(1)、温度为℃时,A与C物质的溶解度相等。(2)、t2℃时,把A,B物质各30g分别加到50g水中,不能形成饱和溶液的是(填字母)。(3)、t2℃时,将等质量A、B、C三种物质的饱和溶液降温至t1℃,所得的三种溶液中,溶剂质量的大小关系是(用字母和“>”“<”或“=”表示)。22. 表中数据是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答:温度(℃)
20
30
40
50
60
溶解度(g)
氯化钠
36.0
36.3
36.6
37.0
37.3
硝酸钾
31.6
45.8
63.9
85.5
110
(1)、60℃时,氯化钠的溶解度为g。(2)、30℃时,在100g水中加入50g硝酸钾,充分搅拌后得到的溶液质量为g。(3)、由表中数据分析可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度x,则x的取值范围是。23. 在某温度下,分別向盛有等质量蒸馏水的两烧杯中逐渐加入固体溶质甲和乙,图中X表示所加固体的质量,Y表示溶液中溶质的质量与水的质量比。a点对应的甲物质的溶液为(选填“的和”或“不饱和”)溶液:该温度时乙物质的溶解度为 g。 24. 同学们都知道“木糖醇口香糖”吧?经研究表明木糖醇的甜度高,溶解性好,防龋齿,是一种理想的蔗糖替代品,适合糖尿病患者食用.木糖醇和蔗糖的溶解度曲线如图,据图回答:
24. 同学们都知道“木糖醇口香糖”吧?经研究表明木糖醇的甜度高,溶解性好,防龋齿,是一种理想的蔗糖替代品,适合糖尿病患者食用.木糖醇和蔗糖的溶解度曲线如图,据图回答: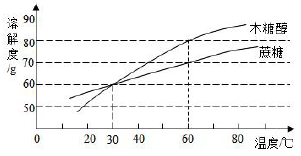 (1)、10℃时,木糖醇的溶解度蔗糖的溶解度。(选填“大于”、“小于”或“等于”)(2)、60℃时,向100克水中加入100克木糖醇,充分溶解后,所得的溶液是溶液(选填“饱和”或“不饱和”),该溶液的溶质质量分数为。要得到木糖醇的晶体可用的蒸发溶剂的方法,还可用。25. 如图是甲、乙、丙三种固体物质的溶解度曲线,据图回答下列问题:
(1)、10℃时,木糖醇的溶解度蔗糖的溶解度。(选填“大于”、“小于”或“等于”)(2)、60℃时,向100克水中加入100克木糖醇,充分溶解后,所得的溶液是溶液(选填“饱和”或“不饱和”),该溶液的溶质质量分数为。要得到木糖醇的晶体可用的蒸发溶剂的方法,还可用。25. 如图是甲、乙、丙三种固体物质的溶解度曲线,据图回答下列问题: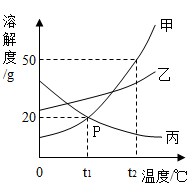 (1)、P点的含义是 。(2)、t2℃时,把50g甲加入到200g水中充分搅拌,静置,形成的是溶液(填“饱和”或“不饱和")。(3)、稍微加热丙的饱和溶液即出现浑浊现象,其原因是。(4)、除去甲中混有的少量乙,步骤是:加水溶解、加热浓缩、、过滤、洗涤、干燥。(5)、将t2℃时等质量的甲、乙两物质的饱和溶液分别降温至t1℃,对所得溶液的叙述正确的是 (填字母序号)。A、溶剂质量,甲>乙 B、析出晶体质量:甲 C、溶质质量分数:甲<乙 D、溶液质量:甲>乙
(1)、P点的含义是 。(2)、t2℃时,把50g甲加入到200g水中充分搅拌,静置,形成的是溶液(填“饱和”或“不饱和")。(3)、稍微加热丙的饱和溶液即出现浑浊现象,其原因是。(4)、除去甲中混有的少量乙,步骤是:加水溶解、加热浓缩、、过滤、洗涤、干燥。(5)、将t2℃时等质量的甲、乙两物质的饱和溶液分别降温至t1℃,对所得溶液的叙述正确的是 (填字母序号)。A、溶剂质量,甲>乙 B、析出晶体质量:甲 C、溶质质量分数:甲<乙 D、溶液质量:甲>乙三、实验探究题
-
26. 在实验探究过程中,如果有多种因素同时影响某一实验结果,当我们要探究其中的一种因素时,就要保持其他因素不变,以探究此种因素对实验结果的影响。
[实验探究]:哪些因素影响固体物质在水中的溶解度?
因素1:溶质的种类
在实验中要改变的因素是:溶质的种类
要保持不变的因素是:温度
操作步骤:在常温下,用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入 氯化钠、硝酸钾、氢氧化钙各2g,振荡,观察各物质的溶解情况。
实验现象:试管①中有少量氯化钠未溶,试管②中硝酸钾全部溶解,试管③中有多量氢氧化钙 未溶。实验结论:
因素2:温度(以硝酸钾为例) 在实验中要改变的因素是: , 要保持不变的因素是:溶质的种类(硝酸钾)
操作步骤:用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入5g硝酸钾晶体,将试管①保持在常温下,将试管②加热并保持在40℃,将试管③加热并保持在60℃,振荡,观察各试管中硝酸钾的溶解情况。
实验现象:试管①中有多量硝酸钾未溶,试管②中有少量硝酸钾未溶,试管③中硝酸钾全部溶解。
实验结论:在不同温度下,固体物质(硝酸钾)在水里的溶解度(填“相等”或“不相等”)。
四、解答题
-
27. 工业上常用碳酸镁矿石(主要成分是难溶于水的碳酸镁,杂质不溶于水也不与酸反应)与稀硫酸反应来制备硫酸镁。硫酸在不同温度时的溶解度如表所示。制备流程如图。

温度(℃)
60
80
90
100
硫酸镁
溶解度(克)
54.6
55.8
52.9
50.4
(1)、用150千克溶质质量分数为98%的浓硫酸配制9.8%的稀硫酸,需要水千克。(2)、小明模拟工业制备硫酸镁晶体,将碳酸镁矿石和稀硫酸充分反应后过滤,发现滤液中含有硫酸。为了测定所得滤液中硫酸镁和硫酸的质量比,他取少量滤液倒入烧杯,将溶质质量分数为10%的氢氧化钠溶液逐渐加入。除要知道实验前氢氧化钠溶液质量外,实验中还要通过测量获取哪两个数据,才可计算硫酸镁与硫酸的质量比?。(硫酸镁与氢氧化钠反应的化学方程式:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4)
(3)、小明将除去杂质后的滤液加热至90℃,得到硫酸镁浓溶液,继续加热,观察到晶体快速析出。其原因可能是。28. 现有硝酸钾(KNO3)和氯化钠(NaCl)两种物质的溶解度数据如下表:温度/℃
0
10
20
30
40
50
60
70
溶解度/g
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
37.8
KNO3
13.3
20.9
31.6
45.8
45.8
85.5
110
138
(1)、60℃时,一定质量的硝酸钾饱和溶液中,溶质和溶液的质量比为 ;(2)、要让100克20%的氯化钠溶液形成20℃时的饱和溶液,需要加多少质量的氯化钠?请列式计算;(3)、硝酸钾溶液中混有少量的氯化钠,用方法可提纯硝酸;(4)、有硝酸钾和氯化钠的饱和溶液各一杯,它们的温度、溶质质量分数都相同,则由表可知这两杯溶液的温度的最小范围是。29. 如图是A、B、C三种固体物质的溶解度曲线,根据该图回答下列问题: (1)、在t1℃时,在三只烧杯中各装入50g水,分别充分溶解A,B,C三种物质,其中溶解最多的物质是;(2)、t2℃,将A,B,C三种物质的饱和溶液各500g分别蒸发掉100g水,析出晶体的质量由小到大的顺序是;(3)、t2℃时,将A、B、C三种物质的饱和溶液降温到t1℃,所得溶液的溶质的质量分数由大到小的顺序为;(4)、若要除去固体A中少量的B物质,应采用的方法是。30. 图为甲、乙(均不含结晶水)两种固体物质在水中的溶解度曲线。
(1)、在t1℃时,在三只烧杯中各装入50g水,分别充分溶解A,B,C三种物质,其中溶解最多的物质是;(2)、t2℃,将A,B,C三种物质的饱和溶液各500g分别蒸发掉100g水,析出晶体的质量由小到大的顺序是;(3)、t2℃时,将A、B、C三种物质的饱和溶液降温到t1℃,所得溶液的溶质的质量分数由大到小的顺序为;(4)、若要除去固体A中少量的B物质,应采用的方法是。30. 图为甲、乙(均不含结晶水)两种固体物质在水中的溶解度曲线。 (1)、t1℃时,甲的溶解度乙的溶解度(填“大于”或“小于”或“等于”)。(2)、t2℃时,100g水中溶解g乙物质恰好达到饱和。(3)、某同学在t1℃时开始如下实验,得到相应的溶液A、B、C。在溶液A、B、C中,属于饱和溶液的是;在溶液C中再加入25g甲后,充分搅拌,恢复到t2℃,所得溶液的质量为。
(1)、t1℃时,甲的溶解度乙的溶解度(填“大于”或“小于”或“等于”)。(2)、t2℃时,100g水中溶解g乙物质恰好达到饱和。(3)、某同学在t1℃时开始如下实验,得到相应的溶液A、B、C。在溶液A、B、C中,属于饱和溶液的是;在溶液C中再加入25g甲后,充分搅拌,恢复到t2℃,所得溶液的质量为。五、综合说理题
-
31. 打开汽水瓶盖,会有气泡冒出.你喝汽水,过一段时间后会打嗝.利用气体溶解度解释原因.
-