江苏省徐州市2021年中考化学试卷
试卷更新日期:2021-07-21 类型:中考真卷
一、单选题
-
1. 下列说法与“珍爱地球,人与自然和谐共生”的理念不相符的是( )A、要积极开发利用氢能、太阳能等新能源 B、对生活垃圾要分类,以便回收再利用 C、工业废水、生活污水排入水体不会引起污染 D、固定利用CO2有利于实现“碳中和”2. 学习化学要科学使用化学符号。下列叙述正确的是( )A、氯化镁(MgCl2)中含有1个C元素 B、微粒H、H+的质子数相同但电子数不同 C、空气、地壳中含量最多的元素都是N D、铝表面致密氧化膜的化学式是3O2Al3. 学习化学要符合题意认识物质的组成结构和变化。下列说法正确的是( )
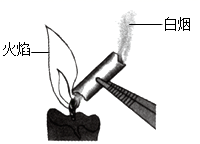 A、钢铁制品锈蚀、CO2制汽水的过程都没有包含化学变化 B、陶瓷、有机玻璃都是用途非常广泛的无机非金属材料 C、金刚石和石墨这两种物质中碳原子的排列方式是不同的 D、如图所示,从蜡烛火焰中引出的“白烟”属于纯净物4. 已知H2S是一种生命体系信号分子,它在O2中燃烧的化学方程式是2H2S+3O2 2X+2H2O。下列说法正确的是( )A、该反应过程中放出热量 B、H2S中硫元素的化合价是-1 C、该反应体现O2的可燃性 D、大量X进入空气不会引起酸雨5. 学习化学需要进行化学实验。下列实验操作或分析正确的是( )
A、钢铁制品锈蚀、CO2制汽水的过程都没有包含化学变化 B、陶瓷、有机玻璃都是用途非常广泛的无机非金属材料 C、金刚石和石墨这两种物质中碳原子的排列方式是不同的 D、如图所示,从蜡烛火焰中引出的“白烟”属于纯净物4. 已知H2S是一种生命体系信号分子,它在O2中燃烧的化学方程式是2H2S+3O2 2X+2H2O。下列说法正确的是( )A、该反应过程中放出热量 B、H2S中硫元素的化合价是-1 C、该反应体现O2的可燃性 D、大量X进入空气不会引起酸雨5. 学习化学需要进行化学实验。下列实验操作或分析正确的是( ) A、用量筒量取一定量水时,可按如图所示方法进行 B、CO还原Fe2O3实验停止加热后,立即取出固体检验 C、测定食醋的pH时,不能使用预先用水湿润的pH试纸 D、若少量浓硫酸沾到皮肤上,可立即涂NaHCO3的浓溶液6. 下列关于有机物的叙述正确的是( )A、丙烷(C3H8)中碳元素、氧元素的质量比为3:8 B、每个聚乙烯[化学式可表示为(C2H4)n]分子中含有2个碳原子、4个氢原子 C、因为淀粉和纤维素的化学式都是(C6H10O5)n , 所以它们是同一种物质 D、甲醛(CH2O)、乙酸(C2H4O2)、葡萄糖(C6H12O6)中氢元素的质量分数相同7. 下列实验方案能达到实验目的的是( )A、验证可燃物燃烧需要氧气:按图所示装置进行实验
A、用量筒量取一定量水时,可按如图所示方法进行 B、CO还原Fe2O3实验停止加热后,立即取出固体检验 C、测定食醋的pH时,不能使用预先用水湿润的pH试纸 D、若少量浓硫酸沾到皮肤上,可立即涂NaHCO3的浓溶液6. 下列关于有机物的叙述正确的是( )A、丙烷(C3H8)中碳元素、氧元素的质量比为3:8 B、每个聚乙烯[化学式可表示为(C2H4)n]分子中含有2个碳原子、4个氢原子 C、因为淀粉和纤维素的化学式都是(C6H10O5)n , 所以它们是同一种物质 D、甲醛(CH2O)、乙酸(C2H4O2)、葡萄糖(C6H12O6)中氢元素的质量分数相同7. 下列实验方案能达到实验目的的是( )A、验证可燃物燃烧需要氧气:按图所示装置进行实验 B、区别氯化钙溶液和蒸馏水:取等量试样放入两支试管中,分别滴入等量肥皂水,振荡,观察现象
C、配制100g5%的碳酸钙溶液:称取5.0g碳酸钙,放入95mL水中,充分搅拌
D、验证酒精中含有氢元素:在95%的酒精燃烧的火焰上罩一个干燥的小烧杯,观察现象
8. 硝酸钾、食盐的溶解度曲线如图所示,下列说法正确的是( )
B、区别氯化钙溶液和蒸馏水:取等量试样放入两支试管中,分别滴入等量肥皂水,振荡,观察现象
C、配制100g5%的碳酸钙溶液:称取5.0g碳酸钙,放入95mL水中,充分搅拌
D、验证酒精中含有氢元素:在95%的酒精燃烧的火焰上罩一个干燥的小烧杯,观察现象
8. 硝酸钾、食盐的溶解度曲线如图所示,下列说法正确的是( ) A、用实验方法可以测定不同温度时硝酸钾的溶解度 B、硝酸钾的溶解度大于食盐的溶解度 C、将t1℃的硝酸钾溶液、食盐溶液分别升温至t2℃,所得两溶液的溶质质量分数一定相等 D、t2℃时,将硝酸钾、食盐的饱和溶液(两溶液的质量相等)分别降温到t1℃,得到的两种溶液中溶质的质量相等9. 下列有关化学事实的说法正确的是( )A、河水的净化和粗盐的提纯都要进行过滤、吸附和消毒 B、浓硫酸和浓盐酸露置在空气中一段时间,两种溶液质量都会增大 C、碳铵与草木灰(含K2CO3)混用,可供给作物更多的营养元素并增强肥效 D、生石灰常用作干燥剂,熟石灰可配制农药波尔多液10. A、B、C三种初中化学常见物质中都含有同一种金属元素,它们之间的一步反应转化关系如图所示(部分反应物、生成物未标出)。其中,A是氯化钠,在工业上通过电解氯化钠的饱和溶液来生产B和氯气(Cl2)等;C俗称纯碱,C的溶液与石灰水反应可制取B。下列说法正确的是( )
A、用实验方法可以测定不同温度时硝酸钾的溶解度 B、硝酸钾的溶解度大于食盐的溶解度 C、将t1℃的硝酸钾溶液、食盐溶液分别升温至t2℃,所得两溶液的溶质质量分数一定相等 D、t2℃时,将硝酸钾、食盐的饱和溶液(两溶液的质量相等)分别降温到t1℃,得到的两种溶液中溶质的质量相等9. 下列有关化学事实的说法正确的是( )A、河水的净化和粗盐的提纯都要进行过滤、吸附和消毒 B、浓硫酸和浓盐酸露置在空气中一段时间,两种溶液质量都会增大 C、碳铵与草木灰(含K2CO3)混用,可供给作物更多的营养元素并增强肥效 D、生石灰常用作干燥剂,熟石灰可配制农药波尔多液10. A、B、C三种初中化学常见物质中都含有同一种金属元素,它们之间的一步反应转化关系如图所示(部分反应物、生成物未标出)。其中,A是氯化钠,在工业上通过电解氯化钠的饱和溶液来生产B和氯气(Cl2)等;C俗称纯碱,C的溶液与石灰水反应可制取B。下列说法正确的是( )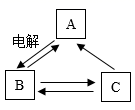 A、在海水里含量最多的物质是A B、物质B的固体必须密封保存 C、用石蕊试液或稀硝酸均不能将A,C的溶液区分开来 D、图示中物质之间的转化反应都属于复分解反应
A、在海水里含量最多的物质是A B、物质B的固体必须密封保存 C、用石蕊试液或稀硝酸均不能将A,C的溶液区分开来 D、图示中物质之间的转化反应都属于复分解反应二、填空题
-
11. 从下列选项中,选择一种适当的物质填空(填序号):
①空气②维生素D③甲烷④木炭⑤镁粉⑥塑料⑦加碘食盐
(1)、化石燃料天然气的主要成分是;(2)、工业上高炉炼铁的原料之一是;(3)、可用于制作烟花和照明弹的金属是;(4)、可能造成环境"白色污染”的有机物是;(5)、能为人体健康提供必需微量元素的物质是。12. 生产生活中,一种或几种物质分散到水等物质里的现象十分常见。(1)、碘酒是固体碘单质分散于酒精中形成的溶液,是一种常用消毒剂,合格的碘酒是澄清透明的。一瓶合格的碘酒密封放置一段时间后,(填“会”或“不会")出现浑浊现象。(2)、通常状况下下列物质分散于水或空气中所形成的三种体系为:①蛋白质溶液②高锰酸钾溶液③含有直径为2-10μm颗粒物的空气,在这些体系中,物质被分散成的粒子或颗粒最小的是(填序号)。(3)、某同学欲探究物质在水中溶解时会发生的某种变化,设计了如下实验方案:实验步骤及操作
结论
1.取一只烧杯,注入约50mL水。

2.向烧杯中加入约5g硝酸铵固体搅拌至固体完全溶解,用温度计测量溶液的温度。
硝酸铵溶于水时吸收热量,使溶液温度降低。
①该实验的目的是,探究物质在溶解过程中
②该实验方案的不合理之处是
三、综合题
-
13. 已知:向饱和食盐水中通入氨气得到饱和氨盐水,饱和氨盐水能与CO2发生反应:NaCl+NH3+CO2+H2O=NaHCO3↓+-NH4Cl。某学习小组以饱和食盐水等为原料制备纯碱的主要流程如下:
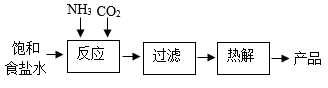 (1)、常温时。饱和氨盐水的pH(填“=”或“>”)7.反应时,溶液中生成的NH4Cl中含有原子团的名称是(2)、过滤时,若经两次过滤滤液仍浑浊其原因可能是(任写一条)(3)、热解时,NaHCO3分解得到Na2CO3、CO2和H2O,该反应的化学方程式为14. 请根据下列实验装置图回答问题。
(1)、常温时。饱和氨盐水的pH(填“=”或“>”)7.反应时,溶液中生成的NH4Cl中含有原子团的名称是(2)、过滤时,若经两次过滤滤液仍浑浊其原因可能是(任写一条)(3)、热解时,NaHCO3分解得到Na2CO3、CO2和H2O,该反应的化学方程式为14. 请根据下列实验装置图回答问题。 (1)、写出标号仪器的名称:①是②是。能用装置E收集的气体应具有的性质是(2)、实验室用过氧化氢溶液和MnO2混合制O2时MnO2的作用是。收集较纯净的氧气,装置可用(填字母)。用锌与稀硫酸反应制取氢气的化学方程式为。(3)、实验室可用铜片与浓硝酸在常温下反应制取少量二氧化氮(NO2)。通常状况下,二氧化氮是红棕色气体,溶于水时与水反应生成硝酸和一氧化氮(NO)。
(1)、写出标号仪器的名称:①是②是。能用装置E收集的气体应具有的性质是(2)、实验室用过氧化氢溶液和MnO2混合制O2时MnO2的作用是。收集较纯净的氧气,装置可用(填字母)。用锌与稀硫酸反应制取氢气的化学方程式为。(3)、实验室可用铜片与浓硝酸在常温下反应制取少量二氧化氮(NO2)。通常状况下,二氧化氮是红棕色气体,溶于水时与水反应生成硝酸和一氧化氮(NO)。①制取NO2的发生装置可用(填字母)。
②收集NO2不用装置F的原因是(用化学方程式表示)。
15. 铜及其化合物在生产生活中有重要应用。某同学对铜及某些含铜物质进行探究。(1)、[温故如新]在①CuO②Cu(OH)2③CuCl2④Cu2(OH)2CO3[也可表示为CuCO3·Cu(OH)2]这4种物质中,属于碱的有(填序号):除①CuO外,其余3种物质在常温下易溶于水有(填序号)。
(2)、考古出土的春秋末期制造的青铜剑,历经2500余年,其表面且有一层薄锈,但仍寒光逼人,剑刃锋利。由此可知,青铜具有的特性有(任写一条)。铜器表面的薄锈是铜与空气中的氧气、水、等物质发生反应所形成。(3)、[提出问题]除H2、CO能还原CuO外,是否还有其他气体能够还原CuO得到金属铜?怎样从含CuCl2、FeCl3的某工业废液中回收金属铜和FeCl2溶液?
[查阅资料]
a、通常状况下,氨气极易溶于水形成溶液;加热时,氨气能与CuO反应生成氮气和金属铜等,可用如图所示装置验证。
b、在溶液中能发生反应2FeCl3+Fe=3FeCl2
[进行实验1]
按图示连接装置,检查气密性后,加(通)入相关药品,后续操作均按规范要求进行,完成实验。

①将CuO粉末装入玻璃管A中的具体操作方法是。
②实验时,在试管B中能够观察到的现象是有液体出现,该液体是(填“纯净物”或“混合物”)。
③从环保角度看该装置的不足之处是
(4)、[进行实验2]取适量含CuCl2、FeCl3的某工业废液样品,向其中加入过量铁粉并充分反应后,过滤,将滤渣和足量(填“稀盐酸”或“稀硫酸")充分反应,再(填操作名称)、洗涤、干燥即可回收得到金属铜;所得滤液中含有需要回收的FeCl2。
(5)、[拓展延伸]已知:加热时,葡萄糖溶液与氢氧化铜悬浊液能发生反应。实验室可用CuSO4溶液等物质检验葡萄糖的存在,具体实验过程为:在试管中加入2mL10%NaOH溶液,滴加5%CuSO4溶液5滴(每滴溶液按0.04mL计算。两种溶液的密度均按1g/mL计算),混合均匀,充分反应,得混合物A.再向上述试管中加入几滴10%葡萄糖溶液,并在酒精灯上加热至沸腾,片刻后生成红色沉淀B.检验完成。则混合物A显(填“中性”或“碱性”);红色沉淀B是[填“CuO”或“Cu2O”"或“Cu(OH)2”]。
四、计算题
-
16. 某同学用溶质质量分数为15%的稀盐酸和大理石反应来制取二氧化碳气体:(1)、用20.3g溶质质量分数为37%的浓盐酸能配制上述稀盐酸g(结果精确到1g)。(2)、若需收集10瓶(每瓶以125mL计算)二氧化碳气体,同至少需要多少克上述稀盐酸与足量的大理石反应才能制得(实验条件下二氧化碳的密度为2g/L)?(写出计算过程,结果精确到0.01g)