江苏省宿迁市2020-2021学年高二下学期化学期末考试试卷
试卷更新日期:2021-07-09 类型:期末考试
一、单项选择题:共13题,每题3分,共39分。每题只有一个选项最符合题意。
-
1. “液态阳光”是二氧化碳和水通过人工光合得到的“绿色”甲醇,有关“液态阳光”说法错误的是( )A、“液态阳光”行动有利于可持续发展 B、水煤气合成的甲醇也是“液态阳光” C、“液态阳光”行动有利于减少 排放 D、“液态阳光”有利于缓解化石燃料消耗2. 酸、碱、盐与生产生活密切相关,下列酸、碱、盐性质与用途对应关系正确的是( )A、NaOH易潮解,可与铝粉混用进行疏通管道 B、 水溶液呈酸性,可用于吸附水中杂质 C、 溶液呈碱性,可用于去油污 D、HClO呈弱酸性,可用于环境消毒3. 港珠澳大桥设计使用寿命120年,需对桥体钢构件采取防腐措施。下列说法错误的是( )A、采用外加电流保护钢构件时,需在钢构件上焊接锌块 B、防腐主要避免发生的反应是: C、钢构件表面喷涂环氧树脂涂层是为了隔绝空气、海水等 D、钢构件可多采用不锈钢材料以减缓腐蚀速率4. “蓝天保卫战”需要持续进行大气治理,有效处理 、 等大气污染物。化学研究为生产、生活处理废气,防止大气污染做出重要贡献。
已知反应: ,运用该反应处理废气时有关说法正确的是( )
A、增大压强有利于反应自发进行 B、该反应不能完全消除废气 C、降低反应温度可提高去除效率 D、升高反应温度可提高废气转化率5. “蓝天保卫战”需要持续进行大气治理,有效处理 、 等大气污染物。化学研究为生产、生活处理废气,防止大气污染做出重要贡献。标准状况下, 。下列有关说法错误的是( )
A、该反应的 B、该反应的 C、若 ,则该反应到达平衡状态 D、反应过程中及时分离 ,有利于废气的转化6. “蓝天保卫战”需要持续进行大气治理,有效处理 、 等大气污染物。化学研究为生产、生活处理废气,防止大气污染做出重要贡献。将 转化为 的工艺流程如下,下列说法正确的是( )
 A、通入空气的目的是将 完全吹出 B、反应时应将 粉碎 C、固体产物A是 D、“高温”时只发生 分解反应7. 下列实验与平衡移动原理无关的是( )
A、通入空气的目的是将 完全吹出 B、反应时应将 粉碎 C、固体产物A是 D、“高温”时只发生 分解反应7. 下列实验与平衡移动原理无关的是( )A
比较 在不同温度水浴中的颜色

B
配制 溶液

C
探究石灰石与稀盐酸在密闭环境下的反应

D
淀粉在不同条件下水解
 A、A B、B C、C D、D8. 醋酸钙[ ]常用作食品稳定剂和抑霉剂。设 为阿伏加德罗常数值。
A、A B、B C、C D、D8. 醋酸钙[ ]常用作食品稳定剂和抑霉剂。设 为阿伏加德罗常数值。关于常温下 的 溶液,下列说法正确的是( )
A、每升溶液中 的数目为0.2 B、稀释溶液,则溶液的pH增大 C、 D、9. 用海水晒盐后苦卤可生产金属Mg,过程如下:苦卤水
下列说法正确的是( )
A、电解熔融 在阴极可得Mg B、将 溶液蒸干可得无水 C、反应 的 D、常温下, 溶于盐酸所得 溶液中10. 我国科学家发明了高温电解甲烷生产 的方法,原理如图所示。下列说法正确的是( )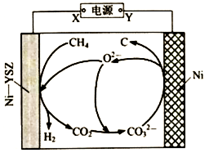 A、X为电源的负极 B、Ni电极上发生的电极反应方程式为 C、电解一段时间后熔融碳酸盐中 的物质的量增多 D、该条件下,每产生1mol ,则生成12gC11. 室温下 沉淀溶解平衡曲线如图,下列结论正确的是( )
A、X为电源的负极 B、Ni电极上发生的电极反应方程式为 C、电解一段时间后熔融碳酸盐中 的物质的量增多 D、该条件下,每产生1mol ,则生成12gC11. 室温下 沉淀溶解平衡曲线如图,下列结论正确的是( ) A、b点无 沉淀生成 B、蒸发可使溶液由a点到c点 C、曲线上任意点的Ksp相同 D、向a点加入 固体,溶液可达b点12. 电解质溶液的电导率越大,导电能力越强。用 NaOH溶液滴定10.00mL浓度均为 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如右图所示。下列说法不正确的是( )
A、b点无 沉淀生成 B、蒸发可使溶液由a点到c点 C、曲线上任意点的Ksp相同 D、向a点加入 固体,溶液可达b点12. 电解质溶液的电导率越大,导电能力越强。用 NaOH溶液滴定10.00mL浓度均为 的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如右图所示。下列说法不正确的是( ) A、曲线①代表滴定 溶液的曲线 B、A点溶液中: C、在相同温度下,A,B,C三点溶液中水电离的 :B<A=C D、B点溶液中:13. 一定条件下,两体积均为1L的恒容密闭容器中发生反应: ,容器中各物质起始量如下表:
A、曲线①代表滴定 溶液的曲线 B、A点溶液中: C、在相同温度下,A,B,C三点溶液中水电离的 :B<A=C D、B点溶液中:13. 一定条件下,两体积均为1L的恒容密闭容器中发生反应: ,容器中各物质起始量如下表:容器
温度
CO
平衡转化率
Ⅰ
mol
2mol
0mol
50%
Ⅱ
0.5mol
1mol
0mol
50%
下列说法正确的是( )
A、 B、容器Ⅰ中5min后达到平衡,则该段时间 C、若温度升高,该反应平衡平衡常数K变为1,则 D、T时,若起始时向容器中充入CO、 、 各1mol,则二、非选择题:共4题,共61分
-
14. 氯化亚铜(CuCl)广泛应用于化工、印染等行业,CuCl难溶于醇和水,在 浓度较大体系中发生 变化,在潮湿空气中易水解氧化。用硫化铜矿生产CuCl工艺流程如下。
 (1)、“溶解”过程中温度需控制在60~70℃的原因是 , “溶解”时 转化成 的反应离子方程式为。(2)、“反应”中 的沉淀率与 投料关系如右图所示,图中A、C两点 的大小关系是:A点C点(填“>”“=”或“<”);B点到C点 沉淀率下降的原因是。
(1)、“溶解”过程中温度需控制在60~70℃的原因是 , “溶解”时 转化成 的反应离子方程式为。(2)、“反应”中 的沉淀率与 投料关系如右图所示,图中A、C两点 的大小关系是:A点C点(填“>”“=”或“<”);B点到C点 沉淀率下降的原因是。 (3)、干燥CuCl固体需在真空中进行,原因是。15. 电化学在工业生产中具有重要作用。(1)、工业上通过电解饱和食盐水制备氯气,阳极反应历程如下:
(3)、干燥CuCl固体需在真空中进行,原因是。15. 电化学在工业生产中具有重要作用。(1)、工业上通过电解饱和食盐水制备氯气,阳极反应历程如下:
阳极反应历程可描述为: , 阳极电极反应式是。
(2)、深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如下图所示,此过程中腐蚀电池的负极是 , 正极反应式是。 (3)、工业膜电解法制得的焦亚硫酸钠( )会含有杂质(杂质不与高锰酸钾反应),取某 产品10.0g配成100mL溶液,取10.00mL加入过量20.00mL 酸性高锰酸钾溶液,充分反应后,用 的 标准液滴定至终点,消耗 溶液20.00mL。
(3)、工业膜电解法制得的焦亚硫酸钠( )会含有杂质(杂质不与高锰酸钾反应),取某 产品10.0g配成100mL溶液,取10.00mL加入过量20.00mL 酸性高锰酸钾溶液,充分反应后,用 的 标准液滴定至终点,消耗 溶液20.00mL。已知:
①判断滴定终点的依据为 ▲ 。
②计算 样品的纯度,写出计算过程。
16. 是一种廉价的碳资源,其综合利用对于“碳中和”具有重要意义。(1)、 催化重整反应为化学键键能数据如下:
化学键
键能/
413
745
436
1075
该催化重整反应的
(2)、对于反应 ,测得不同温度下 生成量随时间变化关系如图。曲线Ⅰ、Ⅱ对应的平衡常数大小关系为 (填“>”、“=”或“<”)。 (3)、 催化 和CH4可生成乙酸。在不同温度下催化效率与乙酸生成速率关系如图。250℃~300℃时,升高温度反应速率降低的原因是。
(3)、 催化 和CH4可生成乙酸。在不同温度下催化效率与乙酸生成速率关系如图。250℃~300℃时,升高温度反应速率降低的原因是。 (4)、最新报道中国科学家首次用 高效合成乙酸,其反应路径如图所示,该反应路径中第1步反应方程式为 , 总反应化学方程式为。
(4)、最新报道中国科学家首次用 高效合成乙酸,其反应路径如图所示,该反应路径中第1步反应方程式为 , 总反应化学方程式为。 17. 大气、水体常见污染元素主要有氮、硫。含氮废气、废液处理是化学学科重要研究课题。(1)、在含 、 废水中加入镁矿工业废水(含 ),以除去N、P,其反应离子方程为 ,该方法除N、P需要控制污水的pH在适当范围,原因是。(2)、用NaClO可以将氨氮( 、 )氧化为N2脱离溶液,NaClO去除 反应的化学方程式。(3)、目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。
17. 大气、水体常见污染元素主要有氮、硫。含氮废气、废液处理是化学学科重要研究课题。(1)、在含 、 废水中加入镁矿工业废水(含 ),以除去N、P,其反应离子方程为 ,该方法除N、P需要控制污水的pH在适当范围,原因是。(2)、用NaClO可以将氨氮( 、 )氧化为N2脱离溶液,NaClO去除 反应的化学方程式。(3)、目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)方法,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图1所示。

图1 图2
为达到最佳的脱硝效果,应采取的反应条件为(填温度和负载率数值)。
(4)、 与 混合浆液可用于脱除 ,反应过程为:Ⅰ.
Ⅱ.
浆液中 质量一定时, 的质量与 的去除率变化趋势如图2所示。a点后 去除率降低的原因是。