浙江省温州新力量联盟2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-07-09 类型:期中考试
一、单选题
-
1. 溴单质的分子式是( )A、 B、 C、 D、2. 分类是科学研究的重要方法,下列物质属于碱的是( )A、 B、 C、 D、3. 下列仪器名称为“蒸馏烧瓶”的是( )A、
 B、
B、 C、
C、 D、
D、 4. 下列能使湿润的红色石蕊试纸变蓝的气体是( )A、 B、 C、 D、5. 下列物质属于弱电解质的是( )A、氨水 B、醋酸铵 C、氮气 D、冰醋酸6. 下列反应属于氧化还原反应的是( )A、 B、 C、 D、7. 反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,还原剂是( )A、MnO2 B、HCl C、MnCl2 D、Cl28. 化学与科学、技术、社会、环境密切相关.下列有关说法错误的是( )A、绿色化学是指利用绿色植物的光合作用减轻温室效应 B、焰火中呈现的绚丽色彩,是由金属元素的焰色反应形成的 C、工业上用 溶液来腐蚀铜膜,制作印刷电路板 D、装运乙醇的包装箱上应贴上易燃液体危险品标志9. 下列化学用语书写错误的是( )A、 的分子结构模型为:
4. 下列能使湿润的红色石蕊试纸变蓝的气体是( )A、 B、 C、 D、5. 下列物质属于弱电解质的是( )A、氨水 B、醋酸铵 C、氮气 D、冰醋酸6. 下列反应属于氧化还原反应的是( )A、 B、 C、 D、7. 反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,还原剂是( )A、MnO2 B、HCl C、MnCl2 D、Cl28. 化学与科学、技术、社会、环境密切相关.下列有关说法错误的是( )A、绿色化学是指利用绿色植物的光合作用减轻温室效应 B、焰火中呈现的绚丽色彩,是由金属元素的焰色反应形成的 C、工业上用 溶液来腐蚀铜膜,制作印刷电路板 D、装运乙醇的包装箱上应贴上易燃液体危险品标志9. 下列化学用语书写错误的是( )A、 的分子结构模型为: B、碳酸钾电离方程式:
C、用电子式表示 的形成过程:
B、碳酸钾电离方程式:
C、用电子式表示 的形成过程:  →Na+
→Na+  D、 还原 反应中电子的转移:
D、 还原 反应中电子的转移:  Cu+H2O
10. 下列说法正确的是( )A、 和 互为同系物 B、 、 、 互为同位素 C、 与 互为同素异形体 D、 有三种同分异构体,沸点相同,化学性质也相同11. 《厉害了,我的国》展示了中国探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等取得的举世瞩目的成就。它们与化学有着密切联系。下列说法正确的是( )A、制造手机芯片的关键材料是二氧化硅 B、“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐 C、我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅 D、C919大型客机使用了大量先进复合材料、铝锂合金等,铝锂合金可减轻机身自重12. 已知: 是原子序数依次增大的短周期主族元素, 三种元素原子的最外层电子数之和为 的原子序数相差 元素的最高价氧化物对应的水化物难溶于水。下列叙述正确的是( )A、简单气态氢化物的稳定性: B、简单离子半径: C、W的含氧酸的酸性一定比Z的强 D、X的氢化物都很稳定,受热不易分解13. 下列离子方程式的书写正确的是( )A、氯气与水的反应: B、用氯化铁溶液腐蚀铜线路板: C、用稀盐酸与碳酸钙反应制取 : D、碳酸氢钠溶液与氢氧化钠溶液反应:14. 下列说法错误的是( )A、煤的气化、液化和干馏都是物理变化 B、向鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 C、沥青来自于石油经减压蒸馏后的剩余物质 D、在催化剂作用下利用太阳能光解水可以制取氢气15. 下列有关离子检验的实验操作和现象均正确的是( )
Cu+H2O
10. 下列说法正确的是( )A、 和 互为同系物 B、 、 、 互为同位素 C、 与 互为同素异形体 D、 有三种同分异构体,沸点相同,化学性质也相同11. 《厉害了,我的国》展示了中国探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等取得的举世瞩目的成就。它们与化学有着密切联系。下列说法正确的是( )A、制造手机芯片的关键材料是二氧化硅 B、“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐 C、我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅 D、C919大型客机使用了大量先进复合材料、铝锂合金等,铝锂合金可减轻机身自重12. 已知: 是原子序数依次增大的短周期主族元素, 三种元素原子的最外层电子数之和为 的原子序数相差 元素的最高价氧化物对应的水化物难溶于水。下列叙述正确的是( )A、简单气态氢化物的稳定性: B、简单离子半径: C、W的含氧酸的酸性一定比Z的强 D、X的氢化物都很稳定,受热不易分解13. 下列离子方程式的书写正确的是( )A、氯气与水的反应: B、用氯化铁溶液腐蚀铜线路板: C、用稀盐酸与碳酸钙反应制取 : D、碳酸氢钠溶液与氢氧化钠溶液反应:14. 下列说法错误的是( )A、煤的气化、液化和干馏都是物理变化 B、向鸡蛋清的溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性 C、沥青来自于石油经减压蒸馏后的剩余物质 D、在催化剂作用下利用太阳能光解水可以制取氢气15. 下列有关离子检验的实验操作和现象均正确的是( )选项
离子
实验操作
实验现象
A
CO
先滴加足量盐酸,将生成的气体通入澄清石灰水
出现白色沉淀即可证明
B
Cl-
滴加稀盐酸,再滴加硝酸银溶液
出现白色沉淀即可证明
C
Fe3+
滴加硫氰化钾溶液
溶液中出现红色沉淀即可证明
D
Na+
用洁净的铂丝蘸取待测液在酒精灯外焰灼烧
可看到黄色的火焰即可证明
A、A B、B C、C D、D16. 2020年,突如其来的新型冠状肺炎肆虐全球。下列说法中错误的是( )A、含有病毒的飞沫分散在空气中形成气溶胶,公共场所戴口罩能减少新冠状肺炎的感染风险 B、向厨房、餐厅喷洒大量75%的酒精以对空气中可能潜在的covid-19病毒进行消杀 C、N95口罩过滤层的熔喷布是以聚丙烯为原料制备,聚丙烯是石油化工的产品之一 D、研究表明,铜制品可能对新冠病毒有抑制作用。铜作为人体必需的微量金属,摄入过量也会有危害17. 化学反应常常伴随能量的变化,图是 与 反应的能量变化示意图,下列说法正确的是( ) A、氯化氢分子的电子式: B、该反应既是氧化还原反应又是放热反应 C、形成 键要吸收 的能量 D、反应物断键时吸收的能量大于产物形成化学键时释放的能量18. 银锌电池广泛用作各种电子仪器的电源,其电极分别为 和 ,电解质溶液为 溶液,总反应式为: .下列说法错误的是( )A、电池工作时, 是正极 B、负极的电极反应是 C、电池工作时,电子从锌极经过 溶液流向 D、工作时,负极区溶液碱性减弱,正极区溶液碱性增强19. 下列说法正确的是( )A、石英、金刚石、冰都是通过共价键形成的原子晶体 B、干冰气化时吸收的热量用于克服分子内碳、氧原子间的作用力 C、氯化氢和氯化钠溶于水都能电离出 ,所以氯化氢和氯化钠均是离子化合物 D、 和 分子中氧原子的最外电子层都具有8电子的稳定结构20. 下图是钠的“价—类”二维图,下列有关说法错误的是( )
A、氯化氢分子的电子式: B、该反应既是氧化还原反应又是放热反应 C、形成 键要吸收 的能量 D、反应物断键时吸收的能量大于产物形成化学键时释放的能量18. 银锌电池广泛用作各种电子仪器的电源,其电极分别为 和 ,电解质溶液为 溶液,总反应式为: .下列说法错误的是( )A、电池工作时, 是正极 B、负极的电极反应是 C、电池工作时,电子从锌极经过 溶液流向 D、工作时,负极区溶液碱性减弱,正极区溶液碱性增强19. 下列说法正确的是( )A、石英、金刚石、冰都是通过共价键形成的原子晶体 B、干冰气化时吸收的热量用于克服分子内碳、氧原子间的作用力 C、氯化氢和氯化钠溶于水都能电离出 ,所以氯化氢和氯化钠均是离子化合物 D、 和 分子中氧原子的最外电子层都具有8电子的稳定结构20. 下图是钠的“价—类”二维图,下列有关说法错误的是( ) A、实验室取用金属钠,需要用到小刀、镊子、滤纸、玻璃片 B、Na2O与盐酸反应生成氯化钠和水,所以Na2O是碱性氧化物 C、A物质的摩尔质量为40g·mol-1 D、NaHCO3的电离方程式:NaHCO3=Na+ + H+ + CO21. 120℃以上时,由两种气态烃组成的混和烃的总物质的量与该混和烃充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示;以下对混和烃组成的判断中正确的是( )
A、实验室取用金属钠,需要用到小刀、镊子、滤纸、玻璃片 B、Na2O与盐酸反应生成氯化钠和水,所以Na2O是碱性氧化物 C、A物质的摩尔质量为40g·mol-1 D、NaHCO3的电离方程式:NaHCO3=Na+ + H+ + CO21. 120℃以上时,由两种气态烃组成的混和烃的总物质的量与该混和烃充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示;以下对混和烃组成的判断中正确的是( ) A、一定有乙烯 B、一定有甲烷 C、一定有丙烷 D、一定有乙烷22. 用 表示阿伏加德罗常数,下列叙述正确的是( )A、 所含分子数为 B、 与足量铁反应转移电子数为 C、常温常压下, 中所含原子数为 D、 溶液中, 的数目为23. 把 和 混合盛入容积为 的密闭容器里,发生如下反应 ,经 反应达平衡,在此 内C的平均反应速率为 ,同时生成 ,下列叙述中错误的是( )A、 B、 内B的反应速率 C、当混合气体的平均相对分子质量不再改变时,该反应已达到平衡状态 D、当 时,标志着该反应达到平衡状态24. 用如图所示装置进行Fe与水蒸气反应的实验(部分夹持装置已略去),下列有关说法错误的是( )
A、一定有乙烯 B、一定有甲烷 C、一定有丙烷 D、一定有乙烷22. 用 表示阿伏加德罗常数,下列叙述正确的是( )A、 所含分子数为 B、 与足量铁反应转移电子数为 C、常温常压下, 中所含原子数为 D、 溶液中, 的数目为23. 把 和 混合盛入容积为 的密闭容器里,发生如下反应 ,经 反应达平衡,在此 内C的平均反应速率为 ,同时生成 ,下列叙述中错误的是( )A、 B、 内B的反应速率 C、当混合气体的平均相对分子质量不再改变时,该反应已达到平衡状态 D、当 时,标志着该反应达到平衡状态24. 用如图所示装置进行Fe与水蒸气反应的实验(部分夹持装置已略去),下列有关说法错误的是( ) A、装置A的作用是为实验提供持续不断的水蒸气 B、装置B中发生反应的化学方程式是 C、装置C中加入的固体干燥剂可能是碱石灰 D、点燃装置处的气体前必须检验气体的纯度25. 某固体混合物X可能含有 、 、 、 、 、 中的几种,为确定其组成,某同学进行了如图实验
A、装置A的作用是为实验提供持续不断的水蒸气 B、装置B中发生反应的化学方程式是 C、装置C中加入的固体干燥剂可能是碱石灰 D、点燃装置处的气体前必须检验气体的纯度25. 某固体混合物X可能含有 、 、 、 、 、 中的几种,为确定其组成,某同学进行了如图实验 根据实验现象,下列推断正确的是( )A、固体混合物X中一定含有 和 ,一定不含 B、固体混合物X中, 、 至少含有一种 C、在无色溶液B中通入 气体,可能有白色沉淀生成 D、在无色溶液B中滴加 溶液,未检测到使湿润红色石蕊试纸变蓝的气体,则该固体混合物X中不存在
根据实验现象,下列推断正确的是( )A、固体混合物X中一定含有 和 ,一定不含 B、固体混合物X中, 、 至少含有一种 C、在无色溶液B中通入 气体,可能有白色沉淀生成 D、在无色溶液B中滴加 溶液,未检测到使湿润红色石蕊试纸变蓝的气体,则该固体混合物X中不存在二、填空题
-
26.(1)、①写出石英的化学式;②写出丙烷的结构简式:。(2)、写出乙酸和乙醇酯化反应的化学方程式。27. 在 密闭容器中,800℃时,反应 体系中, 随时间的变化如表所示.
时间/s
0
1
2
3
4
5
0.020
0.010
0.008
0.007
0.007
0.007
(1)、图中,A点处 (填“大于”小于”或“等于”)。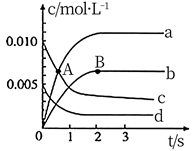 (2)、图中表示 变化的曲线是。用 表示从 内该反应的平均速率 。(3)、下列能使该反应的反应速率增大的是。
(2)、图中表示 变化的曲线是。用 表示从 内该反应的平均速率 。(3)、下列能使该反应的反应速率增大的是。a.及时分离出 气体 b.适当升高温度
c.适当扩大容器的容积 d.选择高效的催化剂
三、综合题
-
28. 已知:A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B的最高价氧化物对应水化物的化学式为 ;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物 ;C、E同主族。(1)、B的原子结构示意图为。(2)、E元素形成的最高价氧化物对应水化物的化学式为。(3)、元素C、D、E的原子半径大小关系是(用元素符号表示)。(4)、C、D可形成化合物 , 中含有的化学键是。29. 某兴趣小组对化合物X(由3种元素组成)开展探究实验。

其中:A和B均为纯净物;B可使品红溶液褪色。
请回答:
(1)、白色沉淀C的化学式是。(2)、组成X的3种元素是 (填元素符号),X 的化学式是。(3)、步骤I中发生反应的离子方程式是。30. 用铁、铝的混合物进行如图实验: (1)、操作X的名称是。(2)、①加入足量 溶液时发生反应的化学方程式为。(3)、检验溶液E中阳离子所需试剂为 , 现象为。(4)、写出③加入氯水的离子方程式。
(1)、操作X的名称是。(2)、①加入足量 溶液时发生反应的化学方程式为。(3)、检验溶液E中阳离子所需试剂为 , 现象为。(4)、写出③加入氯水的离子方程式。
