浙江省北斗联盟2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-07-09 类型:期中考试
一、单选题
-
1. 下列化合物中,属于氧化物的是( )A、NaNO3 B、Fe2O3 C、NaOH D、H2SO42. 图中仪器中,不能加热的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列化合物中的化学键中,只有共价键的是( )A、NH4Cl B、HCl C、NaCl D、Na2SO44. 下列盐酸参与的反应中,HCl被氧化的是( )A、CuO+2HCl=CuCl2+H2O B、Zn+2HCl=ZnCl2+H2↑ C、Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O D、CaCO3+2HCl=CaCl2+CO2↑+H2O5. 下列物质对应的组成错误的是( )A、纯碱:Na2CO3 B、重晶石:BaCO3 C、黄铁矿:FeS2 D、石英砂:SiO26. 化学科学需要借助化学专用语言来描述,下列有关化学用语表示正确的是( )A、F-的结构示意图:
3. 下列化合物中的化学键中,只有共价键的是( )A、NH4Cl B、HCl C、NaCl D、Na2SO44. 下列盐酸参与的反应中,HCl被氧化的是( )A、CuO+2HCl=CuCl2+H2O B、Zn+2HCl=ZnCl2+H2↑ C、Ca(ClO)2+4HCl=CaCl2+2Cl2↑+2H2O D、CaCO3+2HCl=CaCl2+CO2↑+H2O5. 下列物质对应的组成错误的是( )A、纯碱:Na2CO3 B、重晶石:BaCO3 C、黄铁矿:FeS2 D、石英砂:SiO26. 化学科学需要借助化学专用语言来描述,下列有关化学用语表示正确的是( )A、F-的结构示意图: B、中子数为10的氧原子为
C、HCl的电子式:H+
B、中子数为10的氧原子为
C、HCl的电子式:H+  D、NaHCO3的电离方程式:NaHCO3=Na++H++
7. 下列说法错误的是( )A、CH4与CH3CH2CH3互为同系物 B、金刚石和石墨互为同素异形体 C、正丁烷与异丁烷互为同分异构体 D、 H2和 H2互为同位素8. 下列说法错误的是( )A、利用丁达尔效应鉴别氢氧化铁胶体和氯化镁溶液 B、在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质 C、硫黄在过量空气中燃烧生成SO3 D、工业上可用氨水消除燃煤烟气中的二氧化硫9. 下列各组中的两种物质作用时,反应条件、反应物的用量比或浓度改变,生成的化合物不会改变的是( )A、钠与氧气 B、过氧化钠与水反应 C、铜与硝酸 D、氢氧化钠与二氧化硫10. 下列物质间的转化不能通过一步反应实现的是( )A、Cl2→HClO→HCl B、Na2O2→Na2CO3→NaOH C、NH3→NO→NO2 D、Al→Al2O3→Al(OH)311. 下列说法错误的是( )A、浓硝酸一般将其保存在棕色试剂瓶中,并放置阴凉处 B、1mol氮气与3mol氢气反应可生成2mol氨气 C、氨汽化时吸收大量的热,使周围温度急剧降低,故可用作制冷剂 D、氮的固定就是将大气中游离态的氮转化为氮的化合物的过程12. 在一定条件下,下列物质可与甲烷发生取代反应的是( )A、O2 B、浓H2SO4 C、Cl2 D、酸性KMnO4溶液13. 类比推理法是研究物质性质的常用方法之一。下列类比推理正确的是( )
D、NaHCO3的电离方程式:NaHCO3=Na++H++
7. 下列说法错误的是( )A、CH4与CH3CH2CH3互为同系物 B、金刚石和石墨互为同素异形体 C、正丁烷与异丁烷互为同分异构体 D、 H2和 H2互为同位素8. 下列说法错误的是( )A、利用丁达尔效应鉴别氢氧化铁胶体和氯化镁溶液 B、在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质 C、硫黄在过量空气中燃烧生成SO3 D、工业上可用氨水消除燃煤烟气中的二氧化硫9. 下列各组中的两种物质作用时,反应条件、反应物的用量比或浓度改变,生成的化合物不会改变的是( )A、钠与氧气 B、过氧化钠与水反应 C、铜与硝酸 D、氢氧化钠与二氧化硫10. 下列物质间的转化不能通过一步反应实现的是( )A、Cl2→HClO→HCl B、Na2O2→Na2CO3→NaOH C、NH3→NO→NO2 D、Al→Al2O3→Al(OH)311. 下列说法错误的是( )A、浓硝酸一般将其保存在棕色试剂瓶中,并放置阴凉处 B、1mol氮气与3mol氢气反应可生成2mol氨气 C、氨汽化时吸收大量的热,使周围温度急剧降低,故可用作制冷剂 D、氮的固定就是将大气中游离态的氮转化为氮的化合物的过程12. 在一定条件下,下列物质可与甲烷发生取代反应的是( )A、O2 B、浓H2SO4 C、Cl2 D、酸性KMnO4溶液13. 类比推理法是研究物质性质的常用方法之一。下列类比推理正确的是( )选项
类比
推理
A
CO2能使澄清石灰水变浑浊
SO2也能使澄清石灰水变浑浊
B
Fe与S能直接化合生成FeS
Cu和S也能直接化合生成CuS
C
Fe能置换出CuSO4溶液中的Cu
Na也能置换出CuSO4溶液中的Cu
D
Cu与O2在加热条件下生成CuO
Na与O2在加热条件下生成Na₂O
A、A B、B C、C D、D14. 某化学兴趣小组设计如下装置(棉花球沾有无水硫酸铜粉末),并完成实验。下列说法错误的是( ) A、 处的温度高于 处的温度 B、加热一段时间后,棉花球处变蓝色 C、实验结束时,应先熄灭酒精灯,再移开烧杯B D、烧杯A中没有出现浑浊,烧杯B中出现浑浊,说明 热稳定性比 强15. 下列物质间反应,其能量变化符合如图所示的是( )
A、 处的温度高于 处的温度 B、加热一段时间后,棉花球处变蓝色 C、实验结束时,应先熄灭酒精灯,再移开烧杯B D、烧杯A中没有出现浑浊,烧杯B中出现浑浊,说明 热稳定性比 强15. 下列物质间反应,其能量变化符合如图所示的是( )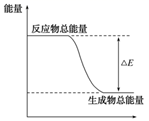 A、碳酸钙的分解 B、灼热的炭与二氧化碳反应 C、Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D、NaOH和盐酸反应16. 运用相关化学知识进行判断,下列结论正确的是( )A、需要加热或高温的条件才能发生的反应一定是吸热反应 B、对于正向吸热的可逆反应,其他条件不变时,升高温度可以使正反应速率增大,逆反应速率减小 C、为了减小稀盐酸与过量石灰石反应的速率,可向反应体系中加入适量的蒸馏水 D、增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率17. 纳米级Fe3O4可用于以太阳能为热源分解H2O制H2 , 过程如图所示。下列说法正确的是( )
A、碳酸钙的分解 B、灼热的炭与二氧化碳反应 C、Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D、NaOH和盐酸反应16. 运用相关化学知识进行判断,下列结论正确的是( )A、需要加热或高温的条件才能发生的反应一定是吸热反应 B、对于正向吸热的可逆反应,其他条件不变时,升高温度可以使正反应速率增大,逆反应速率减小 C、为了减小稀盐酸与过量石灰石反应的速率,可向反应体系中加入适量的蒸馏水 D、增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率17. 纳米级Fe3O4可用于以太阳能为热源分解H2O制H2 , 过程如图所示。下列说法正确的是( ) A、过程Ⅰ的反应为:6FeO+O2 2Fe3O4 B、过程Ⅱ中H2O为催化剂 C、整个过程的总反应为:2H2O 2H2↑+O2↑ D、FeO在过程Ⅱ中被还原18. 图为元素周期表短周期的一部分,其中X元素原子最外层电子数是次外层的两倍。下列说法错误的是( )
A、过程Ⅰ的反应为:6FeO+O2 2Fe3O4 B、过程Ⅱ中H2O为催化剂 C、整个过程的总反应为:2H2O 2H2↑+O2↑ D、FeO在过程Ⅱ中被还原18. 图为元素周期表短周期的一部分,其中X元素原子最外层电子数是次外层的两倍。下列说法错误的是( )X
Y
Z
W
A、X的原子半径比Y的大 B、Y元素的非金属性比Z强 C、z元素位于第3周期ⅣA族 D、W的氧化物的水化物是强酸19. 下列反应的离子方程式正确的是( )A、碳酸钙中加盐酸:CO +2H+=CO2↑+H2O B、氯化亚铁溶液中通氯气:2Fe2++Cl2=2Fe3++2Cl- C、铜与浓硝酸反应:3Cu+8H++2NO =3Cu2++2NO↑+4H2O D、稀硫酸中加氢氧化钡溶液:SO +H++Ba2++OH-=H2O+BaSO4↓20. 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )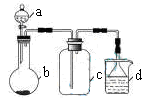
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
浓氨水
CaO
NH3
H2O
B
浓硫酸(70%)
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
A、A B、B C、C D、D21. 设NA表示阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,2.24LCO和CO2的混合气体中含有的碳原子数目为0.1NA B、5.6g铁与2.24L氯气完全反应,转移的电子数目为0.3NA C、常温常压下,80g硝酸铵中含有的氮原子数目为NA D、1 L 1 mol·L−1的硫酸钠溶液中含有的钠离子数为NA22.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法中正确的是( )
A、CO和O生成CO2是吸热反应 B、在该过程中,CO断键形成C和O C、CO和O生成了具有极性共价键的CO2 D、状态Ⅰ →状态Ⅲ表示CO与O2反应的过程23. 某温度下,在2 L恒容密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g) ⇌cC(g),12 s时生成C的物质的量为0.8 mol(过程如图)。下列说法中正确的是( ) A、b:c= 1:4 B、2s时,用A表示的反应速率为0.15 mol·L-1·s-1 C、图中交点时A的消耗速率等于A的生成速率 D、12 s时容器内气体的总物质的量为起始时的24. 某容器中发生一个化学反应,反应过程中存在H2O、 、H2O2、O2、Mn2+、H+六种粒子。在反应过程中测得 和O2物质的量随时间变化的曲线如图所示,下列有关判断正确的是( )
A、b:c= 1:4 B、2s时,用A表示的反应速率为0.15 mol·L-1·s-1 C、图中交点时A的消耗速率等于A的生成速率 D、12 s时容器内气体的总物质的量为起始时的24. 某容器中发生一个化学反应,反应过程中存在H2O、 、H2O2、O2、Mn2+、H+六种粒子。在反应过程中测得 和O2物质的量随时间变化的曲线如图所示,下列有关判断正确的是( ) A、H2O2作氧化剂,H2O是还原产物 B、KMnO4作氧化剂,O2是氧化产物 C、若生成2.24LO2 , 则转移电子0.2mol D、配平后氧化剂与还原剂的化学计量数之比为5:225. 下列实验操作、现象和结论均正确的是( )
A、H2O2作氧化剂,H2O是还原产物 B、KMnO4作氧化剂,O2是氧化产物 C、若生成2.24LO2 , 则转移电子0.2mol D、配平后氧化剂与还原剂的化学计量数之比为5:225. 下列实验操作、现象和结论均正确的是( )选项
实验操作
现象
结论
A
取一根洁净的铂丝,放在酒精灯火焰上灼烧至无色,然后蘸取少量试液,置于火焰上灼烧,透过蓝色钴玻璃观察
火焰呈紫色
溶液为钾盐
B
向Fe(NO3)2样品溶液中加入稀硫酸,然后再滴入KSCN溶液
溶液呈血红色
Fe(NO3)2已变质
C
向溶液中加入盐酸酸化的氯化钡溶液
产生白色沉淀
溶液中含有
D
向某溶液中加入足量NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
试纸变蓝色
溶液中含有
A、A B、B C、C D、D二、填空题
-
26. 按要求完成下列填空:(1)、写出NaCl的电子式:。(2)、 微粒中的中子数为。(3)、写出乙烷的结构简式。(4)、写出实验室制取氯气的化学方程式。27. 按图1所示装置进行实验,若图2中x轴表示流入正极的电子的物质的量,
 (1)、y轴可以表示_______
(1)、y轴可以表示_______①c(Cu2+) ②c( ) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A、①③ B、②④ C、①③⑤ D、②④⑤(2)、该装置的负极是 。(填a或者b)(3)、写出该装置中正极的电极反应式是。(4)、当反应中转移的电子数为0.4mol时,负极减少的质量为g。三、综合题
-
28. 已知A、B、C是金属单质,甲、乙、丙为常见气体,其中B是地壳中含量居第二位的金属元素。它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)、写出气体乙的化学式。(2)、写出反应①的化学方程式:。(3)、写出反应⑥的离子方程式:。(4)、检验物质F溶液中含有金属B元素的阳离子的方法为。29. 某学习小组探究铜跟浓硫酸的反应时,利用如图实验装置进行相关实验。按要求填写下列空白: (1)、装置A中发生的化学反应方程式为。(2)、实验过程中装置C中溶液褪色说明装置A中产生的气体具有性。(3)、实验结束拆开装置后,加热装置B的试管,观察到的现象是。(4)、实验结束后,发现试管A中底部出现了白色固体,设计实验方案检验该固体中含有CuSO4。(5)、将6.4 g铜片加入到盛有含0.2mol H2SO4的浓H2SO4试管中加热,充分反应后,铜片有剩余,原因是。30. 为了验证铜与稀硝酸反应产生的是一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去)。B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)、装置A中发生的化学反应方程式为。(2)、实验过程中装置C中溶液褪色说明装置A中产生的气体具有性。(3)、实验结束拆开装置后,加热装置B的试管,观察到的现象是。(4)、实验结束后,发现试管A中底部出现了白色固体,设计实验方案检验该固体中含有CuSO4。(5)、将6.4 g铜片加入到盛有含0.2mol H2SO4的浓H2SO4试管中加热,充分反应后,铜片有剩余,原因是。30. 为了验证铜与稀硝酸反应产生的是一氧化氮,某校学生实验小组设计了一个实验,其装置如图所示(加热装置和固定装置均已略去)。B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。 (1)、实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。设计此步操作的目的是。(2)、将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为。(3)、用F向E中鼓入空气的现象是。(4)、一段时间后,C中白色沉淀溶解,其原因是。(5)、装置D的作用是。31. 向铁和氧化铁的混合物中加入500mL0.20mol·L-1稀盐酸后恰好完全反应,得到只含一种金属离子的浅绿色溶液,并收集到448mL氢气(标准状况下测定)。回答下列问题;(1)、反应后溶液中的溶质为(填写化学式)。(2)、反应后溶液中的溶质为mol。(3)、原混合物中单质铁的质量为g。
(1)、实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。设计此步操作的目的是。(2)、将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为。(3)、用F向E中鼓入空气的现象是。(4)、一段时间后,C中白色沉淀溶解,其原因是。(5)、装置D的作用是。31. 向铁和氧化铁的混合物中加入500mL0.20mol·L-1稀盐酸后恰好完全反应,得到只含一种金属离子的浅绿色溶液,并收集到448mL氢气(标准状况下测定)。回答下列问题;(1)、反应后溶液中的溶质为(填写化学式)。(2)、反应后溶液中的溶质为mol。(3)、原混合物中单质铁的质量为g。