山东省临沂市兰陵县2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-07-09 类型:期中考试
一、单选题
-
1. 生产、生活中的化学知识随处可见。下列说法错误的是( )A、橡胶硫化的过程中发生了化学反应 B、碳纳米管有优良的电学性能,可用于生产电池 C、5G芯片“巴龙5000”的主要材料是高纯度的二氧化硅 D、陶瓷化学性质稳定,具有耐酸碱腐蚀、抗氧化等特点2. 下列叙述错误的是( )A、酸雨的pH小于5.6 B、能用浓硫酸干燥二氧化硫气体 C、铁粉与硫粉反应生成硫化亚铁是放热反应 D、锌锰干电池中,锌筒作正极3. 定容容器中发生反应I2(g)+H2(g) 2HI(g),下列措施不能提高其反应速率的是( )A、升高温度 B、使用催化剂 C、充入稀有气体,增大体系压强 D、增加I2和H2的起始量4. a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:
⑴a、c、e均能与稀硫酸反应放出气体;
⑵b与d的硝酸盐反应,置换出单质d;
⑶c与强碱反应放出气体;
⑷c、e在冷浓硫酸中发生钝化。
由此可判断a、b、c、d、e依次为( )
A、Fe、Cu、Al、Ag、Mg B、Al、Cu、Mg、Ag、Fe C、Mg、Cu、Al、Ag、Fe D、Mg、Ag、Al、Cu、Fe5. 下列有关化学反应速率和限度的说法中,错误的是( )A、实验室用H2O2分解制O2 , 加入MnO2后,反应速率明显加快 B、在金属钠与足量水反应中,增加水的量能加快反应速率 C、2SO2+O2⇌2SO3反应中,SO2的转化率不能达到100% D、实验室用碳酸钙和盐酸反应制取CO2 , 用碳酸钙粉末比块状反应要快6. 如图所示装置,开始时夹子处于关闭状态,将液体A滴入试管②中与气体B充分反应,打开夹子,可发现试管①中的水立刻沸腾了。则液体A和气体B的组合不可能是( ) A、氢氧化钠溶液、氯化氢 B、氢氧化钠溶液、一氧化碳 C、水、二氧化硫 D、水、二氧化氮7. 用如图所示装置进行实验,下列实验现象的解释不合理的是( )
A、氢氧化钠溶液、氯化氢 B、氢氧化钠溶液、一氧化碳 C、水、二氧化硫 D、水、二氧化氮7. 用如图所示装置进行实验,下列实验现象的解释不合理的是( )
①中试剂
①中现象
解释
A
品红溶液
溶液褪色
SO2具有漂白性
B
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
C
溴水
橙色褪去
SO2具有还原性
D
酸性Ba(NO3)2溶液
生成白色沉淀
SO 与Ba2+生成BaSO3沉淀
A、A B、B C、C D、D8. 某学生用纯净的Cu与50mL过量浓HNO3反应制取NO2 , 实验结果如图所示。(气体体积为标准状况,且忽略溶液体积变化)。下列说法正确的是( ) A、OA段比AB段反应速率快 B、AB段反应速率加快,仅因为产物有催化作用 C、OC段用浓硝酸表示的反应速率为0.2 mol·L-1·min-1 D、向反应体系中加入固体KNO3对反应速率无影响9. 根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法正确的是( )
A、OA段比AB段反应速率快 B、AB段反应速率加快,仅因为产物有催化作用 C、OC段用浓硝酸表示的反应速率为0.2 mol·L-1·min-1 D、向反应体系中加入固体KNO3对反应速率无影响9. 根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法正确的是( ) A、该反应为放热反应 B、2 mol氮原子结合生成N2(g)时需要放出946kJ能量 C、1molNO(g)分子中的化学键断裂时需要放出632kJ能量 D、NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水10. 绿色化学的原子经济性要求是在生产中所有原子均转化为产物,没有副产物。以下反应最符合绿色化学原子经济性要求的是( )A、将NO与O2按4:3的比例充分混合通入足量水中制备硝酸 B、利用SO2与O2反应制SO3 C、以铜和浓硝酸为原料生产硝酸铜 D、用SiO2制备高纯硅11. 对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述错误的是( )A、化学反应速率关系是:2v正(NH3)=3v正(H2O) B、达到化学平衡时,4v正(O2)=5v逆(NO) C、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率也减小 D、若单位时间内生成x mol NO的同时生成x mol NH3 , 则反应达到平衡状态
A、该反应为放热反应 B、2 mol氮原子结合生成N2(g)时需要放出946kJ能量 C、1molNO(g)分子中的化学键断裂时需要放出632kJ能量 D、NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水10. 绿色化学的原子经济性要求是在生产中所有原子均转化为产物,没有副产物。以下反应最符合绿色化学原子经济性要求的是( )A、将NO与O2按4:3的比例充分混合通入足量水中制备硝酸 B、利用SO2与O2反应制SO3 C、以铜和浓硝酸为原料生产硝酸铜 D、用SiO2制备高纯硅11. 对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述错误的是( )A、化学反应速率关系是:2v正(NH3)=3v正(H2O) B、达到化学平衡时,4v正(O2)=5v逆(NO) C、达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率也减小 D、若单位时间内生成x mol NO的同时生成x mol NH3 , 则反应达到平衡状态二、多选题
-
12. 下列关于物质的检验说法正确的是( )A、某红棕色气体使湿润的淀粉KI试纸变蓝,则该气体一定为NO2 B、加入稀硫酸和铜片,加热,溶液变蓝,同时生成无色气体遇空气转变为红棕色,证明一定含有NO C、加入盐酸生成无色气体,通入澄清石灰水中溶液变浑浊,则原溶液一定含有CO 或HCO D、加入NaOH溶液并加热,生成的气体使湿润的红色石蕊试纸变蓝,则原溶液一定含有NH13. 通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如图。下列说法正确的是( )
 A、在第①步中使用玻璃棒搅拌可加速粗盐溶解 B、第⑤步操作需用到的玻璃仪器有分液漏斗、烧杯、玻璃棒 C、在第②③④⑥步通过加入化学试剂除杂,每次所加的试剂都要稍微过量,加入试剂顺序只能为:BaCl2溶液→NaOH溶液→Na2CO3溶液→稀盐酸 D、除去CaCl2的离子方程式为:Ca2++CO =CaCO3↓14. 图中所示为零排放车载燃料电池,下列叙述正确的是( )
A、在第①步中使用玻璃棒搅拌可加速粗盐溶解 B、第⑤步操作需用到的玻璃仪器有分液漏斗、烧杯、玻璃棒 C、在第②③④⑥步通过加入化学试剂除杂,每次所加的试剂都要稍微过量,加入试剂顺序只能为:BaCl2溶液→NaOH溶液→Na2CO3溶液→稀盐酸 D、除去CaCl2的离子方程式为:Ca2++CO =CaCO3↓14. 图中所示为零排放车载燃料电池,下列叙述正确的是( ) A、正极通入H2 , 发生还原反应 B、负极通入O2 , 发生氧化反应 C、导电离子为质子,且在电池内部由负极定向移向正极 D、总反应式为2H2+O2=2H2O15. 某些化学知识用数轴表示能体现出形象直观、简明易记的特点。下列用数轴表示不合理的是( )
A、正极通入H2 , 发生还原反应 B、负极通入O2 , 发生氧化反应 C、导电离子为质子,且在电池内部由负极定向移向正极 D、总反应式为2H2+O2=2H2O15. 某些化学知识用数轴表示能体现出形象直观、简明易记的特点。下列用数轴表示不合理的是( )A
铁和稀硝酸反应

B
向烧碱溶液通入SO2后的产物

C
Na与O2加热反应的产物

D
向NaOH溶液中滴加AlCl3溶液,铝元素的存在形式
 A、A B、B C、C D、D
A、A B、B C、C D、D三、综合题
-
16. 物质的类别和元素的化合价是研究物质性质的两个重要角度。请根据如图所示,回答下列问题:
 (1)、欲制备Na2S2O3 , 从氧化还原角度分析,合理的是(填序号)。
(1)、欲制备Na2S2O3 , 从氧化还原角度分析,合理的是(填序号)。a.Na2S+S b.SO2+Na2SO4 c.Na2SO3+Na2SO4 d.Na2SO3+S
(2)、将X与Y混合使之充分反应,该反应的氧化产物与还原产物质量之比为。(3)、图为铜丝与W的浓溶液反应并验证其产物性质的实验装置。
I.①中反应的化学方程式是。想要立即终止①的反应,最恰当的方法是。
a.上移铜丝,使其脱离溶液
b.撤去酒精灯
c.拔去橡胶塞倒出溶液
II.装置④溶液中的现象为 , 发生的离子反应方程式。
III.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式。
17. 某化学兴趣小组进行如图所示实验,以检验化学反应中的能量变化。
请回答下列问题:
(1)、反应①的离子方程式是;反应②的化学方程式是。(2)、反应(填“①”或“②”)的能量变化可用图(b)表示。(3)、现有如下两个反应:A.NaOH+HCl=NaCl+H2O B.2FeCl3+Cu=2FeCl2+CuCl2
①A反应不能设计成原电池的原因是。
②利用B反应可设计成原电池,该电池正极的电极反应式为 , 可用做该电池正极材料的是(填序号)。
a.碳棒 b.铁片 c.铜片 d.铂棒
18. 恒温下,将ZmolN2与WmolH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:(1)、上述反应进行到某时刻t时,n(N2)=6.5mol,n(NH3)=3mol,Z=。(2)、反应达到平衡时,混合气体的体积为358.4L(标准状况下),其中NH3的含量(体积分数)为25%n(NH3)=。(3)、原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=。(4)、原混合气体中Z:W=。(5)、将1molN2和3molH2合成NH3反应时,下列叙述不能说明该反应已达到化学平衡状态的是(填序号)。a.容器内的总压强不随时间而变化b.反应后混合气体的密度不再发生变化
c.混合气体的平均相对分子质量不再发生变化d.N2的分解速率与生成速率相等
19. 中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如图1所示。 (1)、根据图1信息可以看出,下列哪种气体污染物不是由机动车行驶造成的
(1)、根据图1信息可以看出,下列哪种气体污染物不是由机动车行驶造成的a.SO2 b.NOx c.VOCs d.NH3
(2)、机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图2所示;写出稀燃过程中NO发生的主要反应的方程式。 (3)、科学家经过研究发现中国霾呈中性,其主要原因如图3所示:
(3)、科学家经过研究发现中国霾呈中性,其主要原因如图3所示:
请推断A的化学式为 , 并说明理由:。
(4)、在微生物作用下可实现NH →NO →NO 转化,称为硝化过程。在碱性条件下,NH 被氧气氧化为NO 的反应离子方程式为。(5)、煤燃烧排放的烟气含有SO2和NOx , 采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):离子
Na+
SO
NO
H+
Cl-
浓度/(mol/L)
5.5×10-3
y
6.0×10-4
2.0×10-4
3.4×10-3
①上述转化过程中表现氧化性的物质为 , 若该溶液为1000 mL(吸收前后溶液体积不变),该过程转移的电子数为mol。
②表中y=。
20. 近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400℃时发生反应:CO(g)+2H2(g) CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:时间(s)
0
1
2
3
5
n(CH3OH)(mol)
0
0.009
0.012
0.013
0.013
(1)、图中表示CH3OH的浓度变化的曲线是(填字母)。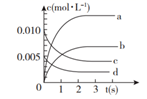 (2)、用H2表示从0~2s内该反应的平均速率v(H2)=。随着反应的进行,该反应的速率逐渐减慢的原因是。(3)、该反应是一个放热反应,说明该反应中破坏1 mol CO和2 mol H2的化学键吸收的能量形成1mol CH3OH释放的能量(填“<”、“=”或“>”)。(4)、已知在400℃时,反应CO(g)+2H2(g) CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=kJ。(5)、甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2 +6H2O
(2)、用H2表示从0~2s内该反应的平均速率v(H2)=。随着反应的进行,该反应的速率逐渐减慢的原因是。(3)、该反应是一个放热反应,说明该反应中破坏1 mol CO和2 mol H2的化学键吸收的能量形成1mol CH3OH释放的能量(填“<”、“=”或“>”)。(4)、已知在400℃时,反应CO(g)+2H2(g) CH3OH(g)生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q=kJ。(5)、甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。电池的总反应式为:2CH3OH+3O2+4OH-=2 +6H2O则电池放电时通入空气的电极为(“正”或“负”)极;从电极反应来看,每消耗1 mol CH3OH转移mol电子。