安徽省滁州市2020-2021学年高一下学期化学期中考试试卷
试卷更新日期:2021-07-09 类型:期中考试
一、单选题
-
1. 化学与生活密切相关。下列叙述错误的是( )A、高纯硅可用于制作光感电池 B、铝合金大量用于高铁建设 C、活性炭具有除异味和杀菌作用 D、冬季燃煤中掺石灰可降低SO2排放2. 人们利用焰色试验制造了绚丽多彩的烟花,下列物质的焰色为黄色的是( )A、K2CO3 B、NaCl C、CaCO3 D、CuSO43. 下列物质分类正确的是( )A、Na2O、FeO、Al2O3均为碱性氧化物 B、烧碱、纯碱、熟石灰均为碱 C、空气、碘酒、浓盐酸均为混合物 D、稀豆浆、氢氧化铁胶体、硫酸铜溶液均为胶体4. 下列离子方程式正确的是( )A、铁片插入氯化铁溶液中:Fe+Fe3+=Fe2+ B、稀硫酸与氢氧化钡溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O C、稀盐酸滴在铜片上:2H++Cu=Cu2++H2↑ D、石灰石投入稀硝酸中:CaCO3+2H+=Ca2++H2O+CO2↑5. 氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C 2AlN+3CO合成。下列关于该反应的叙述正确的是( )A、氧化剂与还原剂的物质的量之比为3:1 B、AlN是还原反应的产物 C、反应中Al2O3被还原 D、每生成1 mol AlN,转移电子的物质的量为6 mol6. 某10%NaOH溶液,加热蒸发掉100g水后得到80mL20%的溶液,则该20%NaOH溶液的物质的量浓度为( )A、6.25mol•L-1 B、12.5mol•L-1 C、7.5mol•L-1 D、5.25mol•L-17. 下列说法中正确的是( )A、IA族和ⅦA族原子化合时,一定生成离子键 B、具有共价键的化合物就是共价化合物 C、由非金属元素形成的化合物一定是共价化合物 D、离子化合物中一定有离子键8. 甲、乙、丙、丁分别是Al2(SO4)3、FeCl2、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生。据此可推断丙物质是( )A、Al2(SO4)3 B、NaOH C、BaCl2 D、FeCl29. 下列对浓硫酸相应性质的描述正确的是( )A、浓硫酸使纸张变黑——吸水性 B、浓硫酸作某些气体的干燥剂——脱水性 C、浓硫酸与木炭在加热条件下反应——氧化性 D、向蔗糖中加入浓硫酸生成海绵状的炭——酸性10. 将等体积的NO2和N2的混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积约为原总体积的( )A、1/2 B、2/3 C、1/3 D、1/611. 用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是( )A、铜 硝酸铜 B、铜 硫酸铜 硝酸铜 C、铜 氯化铜 硝酸铜 D、铜 氧化铜 硝酸铜12. 下列反应不属于氮的固定的是( )A、N2+O2 2NO B、N2+3Mg Mg3N2 C、NH4Cl+NaNO2 N2↑+NaCl+2H2O D、N2+3H2 2NH313. 下列实验报告记录的a、b、c、d四支试管中的实验现象正确的是( )
实验
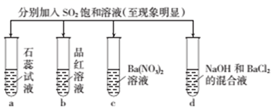
记录
A
蓝色
无色
白色沉淀
无色溶液
B
红色
无色
白色沉淀
白色沉淀
C
红色
无色
无色溶液
白色沉淀
D
无色
无色
无色溶液
无色溶液
A、A B、B C、C D、D14. 短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13。X的原子半径比Y的小,X与W同主族,Z是地壳中含M最高的元素。下列说法错误的是( )A、原子半径的大小顺序:r(W)>r(Y)>r(Z) B、元素Z、W的简单离子的电子层结构相同 C、元素Z分别与X、Y、W形成的化合物均为共价化合物 D、只含X、Y、Z三种元素的化合物可能是离子化合物二、综合题
-
15. 某化学实验小组同学用如图所示装置进行系列实验,以探究气体的性质(部分仪器已略去)。

回答下列问题:
(1)、若气体X为氯气,溶液Y为含有少量KSCN的FeCl2溶液,则可观察到溶液Y中的实验现象是 , 写出NaOH溶液中发生反应的离子方程式:。(2)、若溶液Y为品红溶液,气体X通过后,溶液褪色。取少量褪色后的溶液加热后恢复为红色,则气体X可能是(填化学式)。根据气体X的性质,上述实验装置应作一定的改进,则下列装置中可用来替代其尾气吸收装置的是(填序号)。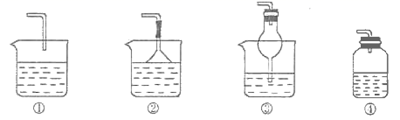 16. 某实验小组利用以下装置制取并探究氨气的性质:
16. 某实验小组利用以下装置制取并探究氨气的性质: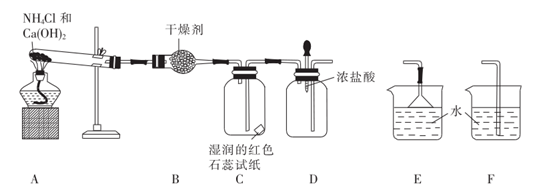 (1)、装置A中发生反应的化学方程式为。(2)、装置B中的干燥剂是(填名称)。(3)、装置C中的现象是。(4)、实验进行一段时间后,挤压装置D中的胶头滴管,滴入 滴浓盐酸,可观察到的现象是。(5)、为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是(填“E”或“F”),尾气吸收过程中发生反应的化学方程式为。17. 为了将混有硫酸钠、碳酸氢铵的氯化钠提纯,某同学设计实验流程如图:
(1)、装置A中发生反应的化学方程式为。(2)、装置B中的干燥剂是(填名称)。(3)、装置C中的现象是。(4)、实验进行一段时间后,挤压装置D中的胶头滴管,滴入 滴浓盐酸,可观察到的现象是。(5)、为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是(填“E”或“F”),尾气吸收过程中发生反应的化学方程式为。17. 为了将混有硫酸钠、碳酸氢铵的氯化钠提纯,某同学设计实验流程如图:NaCl、Na2SO4、NH4HCO3
回答下列问题:
(1)、操作①的目的是。操作②能否用硝酸钡溶液。(填“能”或“不能”)。(2)、进行操作②后,如何判断SO 已除尽,方法是。(3)、操作③中发生反应的化学方程式为。操作④的名称是。(4)、此设计方案是否严密(填“严密”或“不严密”),理由是。(5)、原固体样品中含NaClm1g,最后得到的NaCl固体m2g,则m1m2(填“>”“<”或“=”)。18. 现有部分元素的性质与原子(或分子)结构如表所示:元素
元素性质与原子(或分子)结构
T
最外层电子数是次外层电子数的3倍
X
常温下单质分子为双原子分子,是空气的主要成分,分子比较稳定
Y
M层比K层少一个电子
Z
有三个电子层,M层上有3个电子
回答下列问题:
(1)、T是(填元素符号)。(2)、Y与Z相比,金属性较强的是(填元素符号),下列表述中能证明这一事实的是(填标号)。A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)、T和氢元素能以原子个数比1:1化合形成化合物Q,X与氢元素能以原子个数比1:2化合形成常用于火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,反应的化学方程式为。19. 已知A为生活中的常见金属,C为磁性黑色晶体,A、B、C、D之间转化关系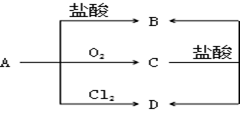 (1)、写出以下物质的化学式A、C、D。(2)、C+盐酸→B+D的离子方程式为 , D的溶液可作为印刷电路板“腐蚀液”,写出该反应的化学方程式。(3)、实验室保存B的溶液时常加入少量A,原因是(用离子方程式表示)(4)、向B溶液中滴加NaOH溶液,产生的现象是 , 过程中所发生的氧化还原反应的化学方程式是。20. 为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O。回答下列问题:(1)、该反应中,氧化剂是 , 氧化反应的产物是。(2)、当有3molI2生成时,有mol还原剂被氧化,转移电子的物质的量为mol。(3)、用双线桥法标出该反应的电子转移的方向和数目(4)、该反应的离子方程式为。
(1)、写出以下物质的化学式A、C、D。(2)、C+盐酸→B+D的离子方程式为 , D的溶液可作为印刷电路板“腐蚀液”,写出该反应的化学方程式。(3)、实验室保存B的溶液时常加入少量A,原因是(用离子方程式表示)(4)、向B溶液中滴加NaOH溶液,产生的现象是 , 过程中所发生的氧化还原反应的化学方程式是。20. 为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O。回答下列问题:(1)、该反应中,氧化剂是 , 氧化反应的产物是。(2)、当有3molI2生成时,有mol还原剂被氧化,转移电子的物质的量为mol。(3)、用双线桥法标出该反应的电子转移的方向和数目(4)、该反应的离子方程式为。