山东省淄博市2021年高考化学三模试卷
试卷更新日期:2021-07-09 类型:高考模拟
一、单选题
-
1. 我国古代典籍中记载了许多劳动人民对化学知识的认识。下列有关说法正确的是( )A、“丹砂烧之成水银,积变又还成丹砂”中“烧”的过程有单质硫生成 B、“凡石灰经火焚炼为用。成质之后,入水永劫不坏”中所有反应均为放热反应 C、“胡粉(碱式碳酸铅)投火中,色坏还为铅”中“色坏还为铅”过程为分解反应 D、“以火烧之,紫青烟起,乃真硝石也”中的“硝石”主要成分为NaNO32. 短周期主族元素X、Y、Z、W原子序数依次增大。基态X原子核外电子仅占据5个原子轨道且有3个未成对电子,Y在周期表中位于ⅢA族,Z与X属于同一主族,基态W原子的核外有1个未成对电子。下列说法错误的是( )A、原子半径:Y>Z>W B、最高价含氧酸的酸性:W>X>Z C、简单氢化物的还原性:X>Z D、X、Y、Z均可与W形成共价化合物3. 二茂铁在工业、医药、航天等领域具有广泛应用,其结构如图所示,其中Fe(Ⅱ)处在两个环戊二烯负离子(C5H )平面之间。下列有关说法错误的是( )
 A、环戊二烯负离子中的π键可以表示为π B、二茂铁核磁共振氢谱中有三组峰 C、二茂铁中碳原子的杂化方式只有sp2 D、二茂铁中所有碳碳键键长均相等4. 下列反应不属于加成反应的是( )A、乙炔与氯化氢反应生成氯乙烯 B、常温下丙烯与溴的四氯化碳溶液反应 C、乙醛与HCN反应生成羟基乙腈 D、顺酐(
A、环戊二烯负离子中的π键可以表示为π B、二茂铁核磁共振氢谱中有三组峰 C、二茂铁中碳原子的杂化方式只有sp2 D、二茂铁中所有碳碳键键长均相等4. 下列反应不属于加成反应的是( )A、乙炔与氯化氢反应生成氯乙烯 B、常温下丙烯与溴的四氯化碳溶液反应 C、乙醛与HCN反应生成羟基乙腈 D、顺酐( )与水反应生成顺丁烯二酸
5. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、46gC2H5OH中含有极性键的数目为7NA B、1molN2H4中含有孤电子对数为5NA C、8.5g15NH3中含有的中子数为4NA D、标准状况下,22.4LC2H4中含有电子数为12NA6. 有机物M具有镇痛、消炎等药理作用,结构简式如图所示。下列说法错误的是( )
)与水反应生成顺丁烯二酸
5. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、46gC2H5OH中含有极性键的数目为7NA B、1molN2H4中含有孤电子对数为5NA C、8.5g15NH3中含有的中子数为4NA D、标准状况下,22.4LC2H4中含有电子数为12NA6. 有机物M具有镇痛、消炎等药理作用,结构简式如图所示。下列说法错误的是( ) A、可与FeCl3溶液发生显色反应 B、该分子中含有5种官能团 C、1mol该分子最多能与2molNaOH发生反应 D、M与溴水既可发生加成反应又可发生取代反应7. 用Cu2S、FeS处理酸性废水中的Cr2O ,发生的反应如下:
A、可与FeCl3溶液发生显色反应 B、该分子中含有5种官能团 C、1mol该分子最多能与2molNaOH发生反应 D、M与溴水既可发生加成反应又可发生取代反应7. 用Cu2S、FeS处理酸性废水中的Cr2O ,发生的反应如下:反应①:Cu2S+Cr2O +H+→Cu2++SO +Cr3++H2O(未配平)
反应②:FeS+Cr2O +H+→Fe3++SO +Cr3++H2O(未配平)
下列判断错误的是( )
A、反应①中还原剂与氧化剂的物质的量之比为3:5 B、用相同物质的量的Cu2S和FeS处理Cr2O 时,Cu2S消耗更多Cr2O C、处理等物质的量的Cr2O 时,反应①和②中消耗H+的物质的量相等 D、用FeS处理废水不仅可以除去Cr2O ,还可吸附悬浮杂质8. 实验室利用反应2CH3CH2CH2CHO +H2O。制备辛烯醛(在沸点177℃时略有分解)的流程如图。下列说法错误的是( )
+H2O。制备辛烯醛(在沸点177℃时略有分解)的流程如图。下列说法错误的是( )  A、加热回流中温度计插入液面以下 B、操作Ⅰ中用到的玻璃仪器有分液漏斗、烧杯 C、无水Na2SO4的作用是除水 D、减压蒸馏操作中应使用空气冷凝管9. 用下列装置进行实验,能达到实验目的的是( )
A、加热回流中温度计插入液面以下 B、操作Ⅰ中用到的玻璃仪器有分液漏斗、烧杯 C、无水Na2SO4的作用是除水 D、减压蒸馏操作中应使用空气冷凝管9. 用下列装置进行实验,能达到实验目的的是( ) A、用装置甲制备NaHCO3晶体 B、用装置乙证明乙炔可使溴水褪色 C、用装置丙分离苯和溴苯 D、用装置丁测定KMnO4溶液的物质的量浓度10. 以Na3Ti2(PO4)3为负极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是( )
A、用装置甲制备NaHCO3晶体 B、用装置乙证明乙炔可使溴水褪色 C、用装置丙分离苯和溴苯 D、用装置丁测定KMnO4溶液的物质的量浓度10. 以Na3Ti2(PO4)3为负极材料的新型可充电钠离子电池的工作原理如图。下列说法错误的是( )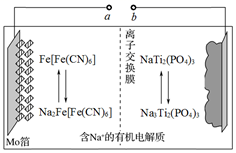 A、放电时,正极反应式为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6] B、充电时,a端接电源正极 C、充电时,每生成1molFe[Fe(CN)6]消耗2molNaTi2(PO4)3 D、充电时,Na+通过离子交换膜从左室移向右室11. 根据下列实验操作和现象,所得到的结论正确的是( )
A、放电时,正极反应式为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6] B、充电时,a端接电源正极 C、充电时,每生成1molFe[Fe(CN)6]消耗2molNaTi2(PO4)3 D、充电时,Na+通过离子交换膜从左室移向右室11. 根据下列实验操作和现象,所得到的结论正确的是( )实验操作和现象
结论
A
将溴乙烷和过量NaOH溶液混合共热并充分振荡,冷却后加入AgNO3溶液,未出现淡黄色沉淀
溴乙烷没有发生取代反应
B
向淀粉溶液中加入几滴稀硫酸,煮沸,冷却后加入少量银氨溶液,水浴加热,无银镜生成
淀粉水解的产物没有还原性
C
向1mL0.1mol·L-1FeCl3溶液中滴加2mL0.1mol·L-1KI溶液,充分反应后,滴加几滴KSCN溶液变为红色
FeCl3与KI的反应是可逆反应
D
将湿润的淀粉—KI试纸置于集满红棕色气体的集气瓶口,试纸变蓝
证明该气体为Br2
A、A B、B C、C D、D12. 甲醇与SO3在有水条件下生成硫酸氢甲酯的反应部分历程如图所示。CH3OH(g)+SO3(g) CH3OSO3H(g),其中粒子间的静电作用力用“…”表示。下列说法错误的是( ) A、水合CH3OH分子比水合SO3分子更稳定 B、反应历程中最大能垒(活化能)为6.62eV C、d到f转化的实质为质子转移 D、在反应过程中,水起催化作用
A、水合CH3OH分子比水合SO3分子更稳定 B、反应历程中最大能垒(活化能)为6.62eV C、d到f转化的实质为质子转移 D、在反应过程中,水起催化作用二、多选题
-
13. 利用含钴废料(主要成分为Co3O4 , 还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如图:
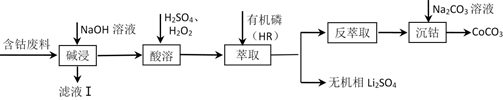
已知:萃取Co2+的反应原理:Co2++2HR(有机磷) CoR2+2H+。下列说法错误的是( )
A、“滤液Ⅰ”中溶质的主要成分是Na[Al(OH)4] B、“酸溶”中H2O2的作用是将Co2+氧化为Co3+ C、“反萃取”中可加入H2SO4分离出Co2+ D、“沉钴”时增大Na2CO3溶液的浓度或滴加速率,能够提高产品的纯度14. 利用间接成对电化学合成间氨基苯甲酸的工作原理如图所示。下列说法错误的是( )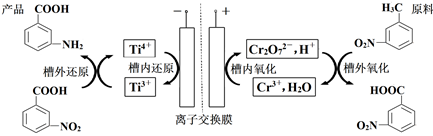 A、阳极的电极反应式为:2Cr3++7H2O-6e-=Cr2O +14H+ B、阳极槽外氧化反应为:
A、阳极的电极反应式为:2Cr3++7H2O-6e-=Cr2O +14H+ B、阳极槽外氧化反应为: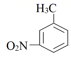 +Cr2O +8H+→
+Cr2O +8H+→ 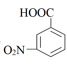 +2Cr3++5H2O
C、通电时阳极区pH增大
D、当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
15. 25℃时,向2.5L蒸馏水中加入0.05molBaSO4固体粉末,再逐渐加入一定量的Na2CO3固体粉末,边加边搅拌(忽略溶液体积变化)。溶液中部分离子的浓度变化如图所示。下列说法正确的是( )
+2Cr3++5H2O
C、通电时阳极区pH增大
D、当电路中转移1mole-时,理论上可得到1mol间氨基苯甲酸
15. 25℃时,向2.5L蒸馏水中加入0.05molBaSO4固体粉末,再逐渐加入一定量的Na2CO3固体粉末,边加边搅拌(忽略溶液体积变化)。溶液中部分离子的浓度变化如图所示。下列说法正确的是( ) A、25℃时,Ksp(BaCO3)>Ksp(BaSO4) B、BaSO4在水中的Ksp大于其在BaCl2溶液中的Ksp C、加入1.3molNa2CO3 , 即可使BaSO4全部转化为BaCO3 D、当BaSO4恰好全部转化为BaCO3时,c(CO )>c(Ba2+)>c(SO )>c(OH-)
A、25℃时,Ksp(BaCO3)>Ksp(BaSO4) B、BaSO4在水中的Ksp大于其在BaCl2溶液中的Ksp C、加入1.3molNa2CO3 , 即可使BaSO4全部转化为BaCO3 D、当BaSO4恰好全部转化为BaCO3时,c(CO )>c(Ba2+)>c(SO )>c(OH-)三、综合题
-
16. C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:(1)、第四周期与基态Ge原子具有相同未成对电子数的元素有(填元素符号);1mol晶体硅与1mol碳化硅所含共价键数目之比为 , 晶体硅的熔点比碳化硅的熔点 (填“高”或“低”)。(2)、SnCl2极易水解生成Sn(OH)Cl沉淀,Sn(OH)Cl中四种元素电负性由小到大的顺序为。在碱溶液中Sn(II)的存在形式为[Sn(OH)3]-(亚锡酸根离子),[Sn(OH)3]-中Sn的价层电子对数为 , 该离子中存在的化学键类型有 (填标号)。
a.离子键 b.共价键 c.配位键 d.氢键
(3)、常温下在水中的溶解度:Na2CO3NaHCO3(填“>”或“<”),用氢键的相关知识解释其原因:。(4)、灰锡的晶体结构与金刚石相似(如图甲所示),其中A处原子的原子分数坐标为(0,0,0),则B处原子的原子分数坐标为。在图乙网格中补全灰锡的晶胞沿y轴的投影图。已知灰锡的密度为ρg·cm-3 , 设NA为阿伏加德罗常数的值,根据硬球接触模型,则Sn原子半径r(Sn)=pm(用代数式表示)。
 17. CH4—CO2催化重整对温室气体的减排具有重要意义,其反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g)。回答下列问题:(1)、已知相关物质的燃烧热(25℃、101kPa):
17. CH4—CO2催化重整对温室气体的减排具有重要意义,其反应为:CH4(g)+CO2(g) 2CO(g)+2H2(g)。回答下列问题:(1)、已知相关物质的燃烧热(25℃、101kPa):物质
CH4(g)
CO(g)
H2(g)
燃烧热(ΔH/kJ·mol-1)
-890.3
-283.0
-285.8
则CH4—CO2催化重整反应的ΔH=kJ·mol-1。
(2)、将原料按初始组成n(CH4):n(CO2)=1:1充入密闭容器中,保持体系压强为100kPa发生反应,达到平衡时CO2体积分数与温度的关系如图所示。
①T1℃、100kPa下,n(平衡时气体):n(初始气体)=;该温度下,此反应的平衡常数Kp=(kPa)2(以分压表示,列出计算式)。
②若A、B、C三点表示不同温度和压强下已达平衡时CO2的体积分数,点对应的平衡常数最小,理由是;点对应压强最大,理由是。
(3)、900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)
由图可知,75min后CH4转化率与炭催化剂目数的关系为 , 原因是。
18. 某兴趣小组利用葡萄糖酸钙[Ca(C6H11O7)2]与硫酸锌反应制备葡萄糖酸锌[Zn(C6H11O7)2]的流程为:
已知:①有关物质在水和乙醇中的溶解性:
葡萄糖酸钙
葡萄糖酸锌
硫酸锌
硫酸钙
水
可溶于冷水,易溶于热水
易溶
微溶
乙醇
微溶
难溶
②葡萄糖酸锌稍高于100℃即开始分解。
回答下列问题:
(1)、反应须控温90℃,可以采用的加热方式为 , 反应控温在90℃的原因为。(2)、“趁热抽滤”的目的是。在“蒸发浓缩至黏稠状,冷却至室温”后添加95%乙醇的作用是。(3)、对粗产品进行提纯操作的名称是。(4)、用EDTA(乙二胺四乙酸的二钠盐)滴定法测定粗产品中锌的含量,步骤如下:Ⅰ.取5.200g粗产品溶于水配成100.00mL溶液,取25.00mL置于锥形瓶中,并向其中加入少量EBT(一种指示剂,溶液呈蓝色,与Zn2+形成的配合物溶液呈酒红色)。
Ⅱ.向锥形瓶中加入2.000mol·L-1EDTAl0.00mL(过量),振荡。
Ⅲ.用1.000mol·L-1锌标准溶液进行滴定至终点,消耗锌标准溶液17.00mL。
已知:向滴有指示剂的粗产品溶液中加入EDTA时,会发生反应:Zn—EBT+EDTA=Zn—EDTA+EBT。
①滴定终点的现象为。
②该粗产品中Zn的质量分数为。已知葡萄糖酸锌中Zn的质量分数为14.29%,则造成此次测定结果偏差的可能原因是。
A.该粗产品中混有ZnSO4杂质
B.滴定前滴定管的尖嘴部分有气泡,滴定后气泡消失
C.配制粗产品溶液,定容时俯视刻度线
D.未用锌标准溶液润洗滴定管
19. 化合物I是一种重要的有机合成中间体,其合成路线如图:
已知:Ⅰ.RBr RMgBr
 RCH2CH2OH
RCH2CH2OHⅡ.

Ⅲ.

回答下列问题:
(1)、实验室制备A的化学方程式为 , C→D、H→I的反应类型分别为、。(2)、H中官能团的名称为。(3)、符合下列条件的D的同分异构体有种。①能发生银镜反应;②能与FeCl3溶液发生显色反应。
(4)、G、I的结构简式分别为、。(5)、写出以甲苯为原料制备 的合成路线(其它试剂任选)。 20. 利用某冶金行业产生的钒炉渣(主要含V2O3及少量SiO2、P2O5等杂质)可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产流程如图:
的合成路线(其它试剂任选)。 20. 利用某冶金行业产生的钒炉渣(主要含V2O3及少量SiO2、P2O5等杂质)可以制备氧钒碱式碳酸铵晶体[(NH4)5(VO)6(CO3)4(OH)9·10H2O],其生产流程如图:
已知:V2O5微溶于水,可溶于碱生成VO 。向Na3VO4溶液中加酸,不同pH对应的主要存在形式如表:
pH
≥13
10.6~12
约8.4
3~8
约2
<1
存在形式
VO
V2O
V3O
V10O
V2O5
VO
回答下列问题:
(1)、“焙烧”后V元素转化为NaVO3 , 该反应的化学方程式为。(2)、欲除去磷元素[使c(PO )≤1.0×10-6mol·L-1],则应控制溶液中Mg2+浓度至少为mol·L-1(已知Ksp[Mg3(PO4)2]=1.0×10-24)。此时Si元素转化为(写化学式)。(3)、“沉钒”的作用为 , “沉钒”需要控制pH约为。(4)、“还原”过程中,生成VOSO4和一种常温下无色无味的气体化合物,该反应的离子方程式为。用浓盐酸与V2O5反应也可以制得VO2+ , 该方法的缺点是。