山东省泰安市与济南章丘区2021年高考化学5月模拟试卷
试卷更新日期:2021-07-09 类型:高考模拟
一、单选题
-
1. 《齐民要术》中记载的“浸曲三日,如鱼眼汤沸,酸米”描述的过程是( )A、制米糖 B、酿酒 C、榨油 D、晒盐2. 化学与生产、生活密切相关,下列说法正确的是( )A、“凡火药,硫为纯阳,硝为纯阴”中的“硫”是指硫黄,“硝”是指硝酸 B、金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 C、光化学烟雾、臭氧空洞、温室效应的形成都与氮氧化物有关 D、 的乙醇、含氯消毒剂、过氧乙酸均可有效灭活新型冠状病毒3. 下列实验操作描述正确且能达到实验目的的是( )
A
B
C
D




苯萃取碘水后的分离操作
配制 1 mol/L的NaCl溶液时的定容操作
探究接触面积对反应速率的影响
验证Ksp(AgSO4)>Ksp(Ag2S)
A、A B、B C、C D、D4. 捕获二氧化碳生成甲酸的过程如图所示,下列说法错误的是( ) A、甲酸可与碳酸氢钠发生反应,有气体生成 B、甲酸分子中所有的原子可能在同一平面上 C、甲酸、醋酸都可以与水任意比互溶,所以含有 的化合物都可以与水任意比互溶 D、该方法有利于减缓温室效应5. 1877年人类首次合成的氮化铝是一种硬度、熔点都很高的晶体,是良好的耐热冲击材料,其晶胞结构如图所示。下列说法正确的是( )
A、甲酸可与碳酸氢钠发生反应,有气体生成 B、甲酸分子中所有的原子可能在同一平面上 C、甲酸、醋酸都可以与水任意比互溶,所以含有 的化合物都可以与水任意比互溶 D、该方法有利于减缓温室效应5. 1877年人类首次合成的氮化铝是一种硬度、熔点都很高的晶体,是良好的耐热冲击材料,其晶胞结构如图所示。下列说法正确的是( ) A、氮化铝属于离子晶体 B、氮化铝可用于制造切割金属的刀具 C、一个氮化铝晶胞中含有 个 原子 D、氮化铝晶体中 的配位数为6. 如何对肿瘤精准治疗一直是医疗领域需攻克的难题之一、我国科研人员开发出的一种医用亲水凝胶,能使药物的释放更为精确。医用亲水凝胶生产过程中的一种中间体M的结构如图所示,下列有关M的说法正确的是( )
A、氮化铝属于离子晶体 B、氮化铝可用于制造切割金属的刀具 C、一个氮化铝晶胞中含有 个 原子 D、氮化铝晶体中 的配位数为6. 如何对肿瘤精准治疗一直是医疗领域需攻克的难题之一、我国科研人员开发出的一种医用亲水凝胶,能使药物的释放更为精确。医用亲水凝胶生产过程中的一种中间体M的结构如图所示,下列有关M的说法正确的是( ) A、M分子间可通过缩聚反应合成高分子化合物 B、分子中N和O的杂化方式相同 C、该分子亲水的原因是能形成分子内氢键 D、分子中所有的碳原子和氮原子可能共平面7. 下列离子方程式书写正确的是( )A、向硫酸铜溶液中加入少量过氧化钠:2Na2O2 +2Cu2+ +2H2O=4Na+ +2Cu(OH)2↓+O2↑ B、将氯气通入氢氧化钠溶液中:Cl2+OH-=Cl-+ClO- +H2O C、等物质的量的CaCl2、Ba(OH)2和HCl溶液混合:Ca2++2OH-=Ca(OH)2 ↓ D、氧化亚铁溶于稀硝酸:FeO+2H+=Fe2+ +H2O8. 海水中不仅含有丰富的水资源,而且蕴藏着宝贵的化学资源。海水资源利用的部分过程如图,下列有关说法错误的是( )
A、M分子间可通过缩聚反应合成高分子化合物 B、分子中N和O的杂化方式相同 C、该分子亲水的原因是能形成分子内氢键 D、分子中所有的碳原子和氮原子可能共平面7. 下列离子方程式书写正确的是( )A、向硫酸铜溶液中加入少量过氧化钠:2Na2O2 +2Cu2+ +2H2O=4Na+ +2Cu(OH)2↓+O2↑ B、将氯气通入氢氧化钠溶液中:Cl2+OH-=Cl-+ClO- +H2O C、等物质的量的CaCl2、Ba(OH)2和HCl溶液混合:Ca2++2OH-=Ca(OH)2 ↓ D、氧化亚铁溶于稀硝酸:FeO+2H+=Fe2+ +H2O8. 海水中不仅含有丰富的水资源,而且蕴藏着宝贵的化学资源。海水资源利用的部分过程如图,下列有关说法错误的是( ) A、海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等 B、在氯碱工业中,电解饱和食盐水可得到氢气、氯气和烧碱 C、在制镁工业中,由步骤②得到镁的反应中,另一产物可用于步骤③⑤中作氧化剂 D、在制溴工业中,步骤③④⑤分别为浓缩、氧化、提取9. 根据如图所示的反应判断,下列说法中错误的是( )
A、海水淡化的方法主要有蒸馏法、电渗析法和离子交换法等 B、在氯碱工业中,电解饱和食盐水可得到氢气、氯气和烧碱 C、在制镁工业中,由步骤②得到镁的反应中,另一产物可用于步骤③⑤中作氧化剂 D、在制溴工业中,步骤③④⑤分别为浓缩、氧化、提取9. 根据如图所示的反应判断,下列说法中错误的是( ) A、该反应是一个吸热反应 B、 和 中碳原子的杂化类型相同 C、该反应中既有离子键断裂,又有共价键断裂 D、 的分子立体构型是直线形10. 甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法错误的是( )
A、该反应是一个吸热反应 B、 和 中碳原子的杂化类型相同 C、该反应中既有离子键断裂,又有共价键断裂 D、 的分子立体构型是直线形10. 甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如图。下列说法错误的是( ) A、CH3SH为共价化合物 B、该过程中断裂了O—H键、S—H键和C—S键 C、该催化剂可降低该反应的活化能 D、该过程的总反应为H2S+CH3OH CH3SH+H2O11. 下列实验操作及现象不能推出相应结论的是( )
A、CH3SH为共价化合物 B、该过程中断裂了O—H键、S—H键和C—S键 C、该催化剂可降低该反应的活化能 D、该过程的总反应为H2S+CH3OH CH3SH+H2O11. 下列实验操作及现象不能推出相应结论的是( )选项
实验操作
现象
结论
A
分别将少量钠投入盛有水和乙醇的烧杯中
钠与水反应更剧烈
乙醇中氢的活泼性比水中氢的弱
B
将石蜡油与碎瓷片混合加强热,产生的气体通入酸性KMnO4溶液中
酸性KMnO4溶液褪色
石蜡油加强热产生的气体是乙烯
C
将灼热后表面变黑的螺旋状铜丝插入约50℃的乙醇中
铜丝能保持红热,反应后溶液有刺激性气味
乙醇的催化氧化反应是放热反应
D
向苯酚钠溶液中通二氧化碳
溶液变浑浊
苯酚的酸性比碳酸的弱
A、A B、B C、C D、D12. 已知:25℃时,Ka(CH3COOH)=1.7×10-5 , Kb(NH3·H2O)=1.7×10-5。用0.01 mol/L的CH3COOH溶液滴定20 mL由浓度均为0.01 mol/L的NaOH溶液和氨水组成的混合溶液,溶液的相对导电能力随加入CH3COOH溶液体积的变化趋势如图所示。下列叙述错误的是( ) A、a点时混合溶液中:c( )≈l.7×10-5 mol·L-1 B、b点时混合溶液中:c(CH3COOH)<c( ) C、c点时混合溶液中:c(CH3COO- )+c(CH3COOH)=c( )+c(NH3·H2O)+c(Na+) D、c点时混合溶液中:pH=7
A、a点时混合溶液中:c( )≈l.7×10-5 mol·L-1 B、b点时混合溶液中:c(CH3COOH)<c( ) C、c点时混合溶液中:c(CH3COO- )+c(CH3COOH)=c( )+c(NH3·H2O)+c(Na+) D、c点时混合溶液中:pH=7二、多选题
-
13. 用 表示阿伏加德罗常数的值,下列叙述正确的是( )A、0.1mol苯乙烯中碳碳双键的数目为 B、常温下,46g由 和甲硫醛 组成的混合物中含有的分子数为 C、标准状况下, 中含有的共价键数目为 D、 的 溶液中阴离子总数大于14. 短周期元素X、Y、Z、R的原子序数依次增大,离子化合物YR可用于调味和食品保存,X、Y、Z三种元素组成的两种化合物A、B的性质如图,X的基态原子中s能级与p能级上的电子数相等。下列说法正确的是( )
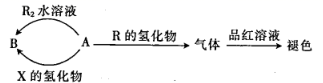 A、X与Z形成的三原子分子为直线形分子 B、简单离子半径:Y<R<Z C、X、Z、R的氢化物的分子间均能形成氢键 D、X、Y、Z、R中,Y的第一电离能最小15. 用质子导体固体氧化物燃料电池(P—SOFC)脱氢可得丙烯,可实现“烯烃—电力”联产。
A、X与Z形成的三原子分子为直线形分子 B、简单离子半径:Y<R<Z C、X、Z、R的氢化物的分子间均能形成氢键 D、X、Y、Z、R中,Y的第一电离能最小15. 用质子导体固体氧化物燃料电池(P—SOFC)脱氢可得丙烯,可实现“烯烃—电力”联产。
下列说法正确的是( )
A、催化剂促进电能转变为化学能 B、O2-由负极迁移至正极 C、负极上发生的电极反应为C3H8-2e-=C3H6+2H+ D、电池总反应为2C3H8+O2=2C3H6+2H2O三、综合题
-
16. 某化工厂用水钴矿(主要成分为Co2O3 , 含少量Fe2O3、Al2O3、MnO等)制取CoCl2的工艺流程如下:

已知:①氧化性:Co3+>Cl2>H2O2>Fe3+。
②“酸浸”后溶液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等。
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(当离子浓度不大于10-5 mol/L 时,认为该离子沉淀完全):
沉淀物
Fe(OH)3
Fe(OH)2
Co(OH)2
Al(OH)3
Mn(OH)2
完全沉淀的pH
3.7
9.6
9.2
5.2
9.8
回答下列问题:
(1)、“酸浸”过程中加入Na2SO3的主要作用是;写出Co2O3与盐酸反应的离子方程式:。(2)、为了提高Fe2+的转化速率,可以适当升高温度,但不能过高,其原因是。(3)、①加NaOH是为了除铁和铝,则常温时a的最小值是;当c(Fe3+)<10-5.9 mol·L-1时,溶液中c(OH-)>mol·L-1。②“滤液”中加入萃取剂的作用是。
(4)、为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称量其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是(答一条即可)。17. “中国紫”——硅酸铜钡 ,其合成原料为 、孔雀石 和砂子 。回答下列问题:(1)、基态Ba原子的价电子排布式为。(2)、 常用作光导纤维,在生产和生活中有广泛的用途。 属于晶体,在 晶体中,硅原子的杂化类型为。(3)、 不溶于水,但可溶于浓氨水,反应的化学方程式为 。①氨水中存在的化学键有(填标号)。
A.极性键 B.非极性键 C.氢键 D. 键 E. 键
② 中配体是 , 所含元素中电负性最小的非金属元素是(填元素符号)。
(4)、 的熔点比 的(填“高”或“低”),原因是。(5)、Cu和Ba形成的某种合金的晶胞结构如图所示,该合金中Cu与Ba的原子个数比为。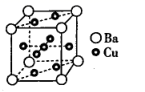 18. 随着低碳钢等洁净钢技术的发展, 耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:(1)、在埋炭实验条件下,不同碳素材料的 耐火材料与铁液之间的可能反应如下:
18. 随着低碳钢等洁净钢技术的发展, 耐火材料和钢水之间的相互作用已成为当前的一个研究重点。请回答下列问题:(1)、在埋炭实验条件下,不同碳素材料的 耐火材料与铁液之间的可能反应如下:①
②
③
④
则 。
(2)、直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:⑤
⑥
反应⑤、反应⑥中吉布斯自由能(ΔG)与温度(T)的变化关系如图1所示,由此判断反应⑤对应图中的曲线(填“Ⅰ”或“Ⅱ”),试分析氧化铝碳热还原氯化法炼铝的可行性:。
(3)、在埋炭情况下,碳过剩时,碳的氧化反应主要考虑: 。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为 )中加入足量的碳和 ,平衡时体系中气体体积分数与温度的关系如图2所示。 ①650℃反应达到平衡时,容器体积为10L,则平衡时 。
①650℃反应达到平衡时,容器体积为10L,则平衡时 。②T℃时,若向平衡体系中再充入一定量 的混合气体,则平衡(填“向正反应方向”、“向逆反应方向”或“不”)移动。
③800℃时,用平衡分压代替平衡浓度表示的化学平衡常数 [用含 的代数式表示,气体分压 ]。
(4)、CO可作某熔融盐电池的燃料,电解质为Li2CO3和Na2CO3的熔融盐混合物,空气与CO2的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为。19. 对氨基水杨酸钠(G)是抗结核药物,主要用于结核菌感染的综合治疗,其合成路线如下:
已知:①

 ;②
;② 
 。
。回答下列问题:
(1)、B的化学名称为;F中含氧官能团的名称为。(2)、C的结构简式为;合成路线的6步反应中属于还原反应的是(填标号)。(3)、反应⑥中所加试剂Ⅱ为(填化学式)。(4)、M为A的同分异构体,符合下列条件的M的结构简式为。a.属于链状烃 b.分子中只有碳碳三键一种官能团
c.分子中有6个碳原子在一条直线上
(5)、苯环上原有取代基对新引入取代基位置的影响叫做定位效应,原有的取代基叫做定位取代基,几种定位取代基的定位效应如下表所示:定位取代基
-CH3
-Br
-OH
-NH2
-COOH
-NO2
定位效应
邻位、对位
间位
请以
 为原料,设计一条合成
为原料,设计一条合成  的合理路线(无机试剂任选) 。20. 某活动小组的同学对甲烷还原氧化铜进行了探究,回答下列问题:
的合理路线(无机试剂任选) 。20. 某活动小组的同学对甲烷还原氧化铜进行了探究,回答下列问题:查阅资料得:实验室制取甲烷常用的方法为无水醋酸钠 与氢氧化钠在二氧化锰作催化剂的条件下共热,产物中有少量的副产物丙酮 ,丙酮可与水混溶。
 (1)、组装好仪器后,首先进行的操作是 , 实验中先点燃(填“A”或“D”)处酒精灯,此时 、 的状态为(填标号)。
(1)、组装好仪器后,首先进行的操作是 , 实验中先点燃(填“A”或“D”)处酒精灯,此时 、 的状态为(填标号)。A. 关闭、 关闭 B. 关闭、 打开
C. 打开、 打开 D. 打开、 关闭
(2)、装置A中主要发生反应的化学方程式为 , 试管内壁加一层铝箔不仅能使药品受热均匀,还能。(3)、装置B中盛装的试剂为。(4)、实验过程中记录的实验数据如下:实验前装置总质量/g
D
E
F
G
实验后装置总质量/g
180.0
277.8
311.5
301.0
实验前装置总质量/g
177.2
279.6
312.6
301.0
若装置D中的氧化铜全部被还原成铜,则气球中收集到的由D中反应产生的气体在标准状况下的体积为L,此条件下,装置D中发生反应的化学方程式为。