山东省泰安市2021年高考化学四模试卷
试卷更新日期:2021-07-09 类型:高考模拟
一、单选题
-
1. 化学与生产、生活密切相关,下列说法正确的是( )A、误食重金属离子后,迅速补充牛奶、蛋清等食物可减缓中毒 B、“84”消毒液浓度越大,消毒效果越好 C、可向淀粉溶液中加入食盐,检验食盐中是否含碘 D、蔗糖、淀粉在人体内水解的产物均为葡萄糖2. 下列关于物质的用途的说法错误的是( )A、K2FeO4可用于自来水杀菌消毒及净水 B、氮化镓属于优良的半导体材料,可用作光导纤维 C、NaCl、C2H5OH、CH3COOH都可用作食品调味剂 D、超级钢耐腐蚀、强度大,可实现轻薄化,用于航空航天3. X、Y、Z、W、M为原子序数依次增大的短周期主族元素;由5种元素组成的某化合物是电池工业中的重要原料,该化合物的结构式如图所示。下列说法正确的是( )
 A、原子半径:Y<Z<W B、最高价含氧酸酸性:Z>M C、电负性:X<Y<Z D、该化合物中既含极性键又含非极性键4. 下列说法正确的是( )A、基态Mn原子的价电子排布图为
A、原子半径:Y<Z<W B、最高价含氧酸酸性:Z>M C、电负性:X<Y<Z D、该化合物中既含极性键又含非极性键4. 下列说法正确的是( )A、基态Mn原子的价电子排布图为 B、沸点:CO<N2
C、键角:NH3<H2O
D、S8中S原子的杂化方式为sp3
5. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、18gD2O中所含中子的数目为10NA B、1molNa与O2完全反应生成34g固体时转移的电子数目为NA C、1 L 0.1mol·L-1Na2CO3溶液中含有的 的数目为0.1NA D、11.2 L乙烷与丙烯的混合物中含有的氢原子数目为3NA6. m、n、p、q是有机合成中常见的4种小分子。下列说法正确的是( )
B、沸点:CO<N2
C、键角:NH3<H2O
D、S8中S原子的杂化方式为sp3
5. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、18gD2O中所含中子的数目为10NA B、1molNa与O2完全反应生成34g固体时转移的电子数目为NA C、1 L 0.1mol·L-1Na2CO3溶液中含有的 的数目为0.1NA D、11.2 L乙烷与丙烯的混合物中含有的氢原子数目为3NA6. m、n、p、q是有机合成中常见的4种小分子。下列说法正确的是( ) A、m的分子式为C5H10O2 B、n与p互为同系物 C、可用溴的四氯化碳溶液鉴别p和q D、含羧基的n的同分异构体有8种(不包括立体异构)7. 硫化锌有两种常见的晶体,分别是六方硫化锌(晶胞结构如图甲所示)和立方硫化锌(晶胞结构如图乙所示)。下列说法错误的是( )
A、m的分子式为C5H10O2 B、n与p互为同系物 C、可用溴的四氯化碳溶液鉴别p和q D、含羧基的n的同分异构体有8种(不包括立体异构)7. 硫化锌有两种常见的晶体,分别是六方硫化锌(晶胞结构如图甲所示)和立方硫化锌(晶胞结构如图乙所示)。下列说法错误的是( ) A、可用X-射线衍射实验鉴别硫化锌是否属于晶体 B、每个六方硫化锌晶胞中含2个S原子 C、立方硫化锌中锌的配位数为4 D、氧化锌的熔点低于六方硫化锌和立方硫化锌8. 卤代烃与端基炔(R'C≡CH)催化偶联反应的一种机理如图所示。下列说法错误的是( )
A、可用X-射线衍射实验鉴别硫化锌是否属于晶体 B、每个六方硫化锌晶胞中含2个S原子 C、立方硫化锌中锌的配位数为4 D、氧化锌的熔点低于六方硫化锌和立方硫化锌8. 卤代烃与端基炔(R'C≡CH)催化偶联反应的一种机理如图所示。下列说法错误的是( ) A、偶联反应中起催化作用的是M和CuI B、R'C≡CCu为该催化过程的中间产物 C、该偶联反应的原理为R'C≡CH+RI→R'C≡CR+HI D、该催化机理改变了反应路径和反应热9. 下列分离原理和操作均正确且能达到分离目的的是( )
A、偶联反应中起催化作用的是M和CuI B、R'C≡CCu为该催化过程的中间产物 C、该偶联反应的原理为R'C≡CH+RI→R'C≡CR+HI D、该催化机理改变了反应路径和反应热9. 下列分离原理和操作均正确且能达到分离目的的是( )选项
A
B
C
D
装置




目的
分离NaCl和I2的固体混合物
分离Fe(OH)3胶体中的FeCl3
除去CO2中混有的SO2
用乙醇萃取碘水中的碘并分离
A、A B、B C、C D、D10. 锌-空气燃料电池是一种低能耗电池,在生产生活中应用广泛,其装置示意图如图所示。下列说法错误的是( ) A、充电时,a与电源正极相连 B、放电过程中,KOH溶液浓度不变 C、充电时,N极的电极反应式为ZnO+2H++2e-=Zn+H2O D、放电时,M极每消耗16gO2 , 理论上N极质量增加16g11. 下列实验操作、实验现象和实验结论均正确且有对应关系的是( )
A、充电时,a与电源正极相连 B、放电过程中,KOH溶液浓度不变 C、充电时,N极的电极反应式为ZnO+2H++2e-=Zn+H2O D、放电时,M极每消耗16gO2 , 理论上N极质量增加16g11. 下列实验操作、实验现象和实验结论均正确且有对应关系的是( )选项
实验操作
实验现象
实验结论
A
向溶液中滴加稀硫酸,并将产生的气体通过澄清石灰水
产生无色无味的气体,且石灰水变浑浊
该溶液中含
B
向5mL 0.1mol·L-1NaOH溶液中滴加5mL0.01mol·L-1MgCl2溶液,然后再滴加5mL0.01mol·L-1CuCl2溶液
先产生白色沉淀,后产生蓝色沉淀
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
C
向蔗糖中加入适量浓硫酸并不断搅拌,同时将产生的气体通入品红溶液
蔗糖体积膨胀并变黑,品红溶液腿色
浓硫酸具有脱水性和氧化性
D
向淀粉溶液中加入足量稀硫酸,加热一段时间后,加入少量Cu(OH)2悬浊液
产生砖红色沉淀
淀粉水解成葡萄糖
A、A B、B C、C D、D12. 某闪锌矿的主要成分为ZnS,还含有SiO2、FeS2等,利用该闪锌矿制备皓钒(ZnSO4·7H2O)的工艺流程如下图所示。
下列说法错误的是( )
A、“破碎”可加快“煅烧”速率,并使反应更充分 B、“废气”合理处理可用于工业制硫酸 C、“滤渣”的主要成分为Fe2O3 , 可用于冶炼铁 D、“一系列操作”包括蒸发浓缩、冷却结晶、过滤等二、多选题
-
13. M与N存在如图所示的转化。下列说法错误的是( )

 A、M中所有原子一定共平面 B、N能发生酯化反应、氧化反应和还原反应 C、沸点:N<M D、属于芳香化合物且能与银氨溶液反应的N的同分异构体有3种14. 我国科学家在利用电解法合成高纯度有机产品的研究上有重大突破。其中在酸性环境中电解糠醛(
A、M中所有原子一定共平面 B、N能发生酯化反应、氧化反应和还原反应 C、沸点:N<M D、属于芳香化合物且能与银氨溶液反应的N的同分异构体有3种14. 我国科学家在利用电解法合成高纯度有机产品的研究上有重大突破。其中在酸性环境中电解糠醛( )制备有机产品的原理示意图如下所示。下列说法正确的是( )
)制备有机产品的原理示意图如下所示。下列说法正确的是( )  A、交换膜适宜选用质子交换膜 B、N极电势高于M极电势 C、N极上发生的电极反应包括
A、交换膜适宜选用质子交换膜 B、N极电势高于M极电势 C、N极上发生的电极反应包括 +H2O-2e-=
+H2O-2e-= 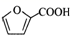 +2H+
D、电路上每通过1mol e- , 理论上生成1 mol
+2H+
D、电路上每通过1mol e- , 理论上生成1 mol  15. 常温下,Cu(OH)2和Fe(OH)3饱和溶液的浓度随pH的变化如图所示,已知:Ksp[Cu(OH)2]=1×10-20 , Ksp[Fe(OH)3]=1×10-38.下列说法正确的是( )
15. 常温下,Cu(OH)2和Fe(OH)3饱和溶液的浓度随pH的变化如图所示,已知:Ksp[Cu(OH)2]=1×10-20 , Ksp[Fe(OH)3]=1×10-38.下列说法正确的是( ) A、曲线a对应的是Fe(OH)3饱和溶液 B、调节pH为4.5可除去FeCl3中的CuCl2 C、酸性溶液中Cu元素的存在形式可能为Cu2+或Cu(OH)2 D、滴加NaOH溶液,可实现X到Y的转化
A、曲线a对应的是Fe(OH)3饱和溶液 B、调节pH为4.5可除去FeCl3中的CuCl2 C、酸性溶液中Cu元素的存在形式可能为Cu2+或Cu(OH)2 D、滴加NaOH溶液,可实现X到Y的转化三、综合题
-
16. 某工业矿渣废料的主要成分为SiO2、MnO2和Fe2O3 , 还含有少量CaO和MgO。利用该矿渣废料制备高纯MnCO3和回收含铁化合物的工业流程如下:

已知:i.当微粒浓度低于10-5mol·L1时,认为溶液中不存在该微粒;
ⅱ.常温下,部分难溶物的溶度积常数如下表:
难溶物
Fe(OH)3
Fe(OH)2
Mn(OH)2
Mg(OH)2
Ksp
1×10-38
1×10-16
2×10-13
2×10-25
回答下列问题:
(1)、“滤渣I”的成分为(填化学式,下同);流程最终回收的含铁化合物为。(2)、通入SO2“还原”时需要不断搅拌,不断搅拌的目的为 , 该过程中发生的主要氧化还原反应的离子方程式为。(3)、“氧化”时需要少量、多次加入H2O2 , 其目的是。(4)、“调pH”时可选择的试剂为___________(填字母)。A、MnO2 B、Fe2O3 C、NH3·H2O D、FeO(5)、常温下,若“调pH”后所得溶液中c(Mn2+)=0.2 mol·L-1、c(Mg2+)=0.002 mol·L-1 , 则所调pH的范围为。(6)、“沉锰”时发生反应的离子方程式为。17. Ni/Yb催化的不对称炔丙基化反应在药物分子合成中的应用广泛。我国科学家利用该原理合成了有机物M如图
请回答下列问题:
(1)、基态Ni原子的价电子排布式为。(2)、M是用于治疗糖尿病有效的GPR40受体激动剂。①M中同周期元素第一电离能由大到小的顺序为 , 原因为。
②M中结构片段“
 ”中4个碳原子共线的原因为。
”中4个碳原子共线的原因为。③M中的“

图I和图Ⅱ的堆积方式分别为和;二者的空间利用率之比为。
18. 氮氧化物气体是造成光化学污染的主要气体,降低氮氧化物气体的排放是环境保护的重要课题。已知汽车尾气中的氮氧化物气体主要涉及如下反应:ⅰ.N2(g)+O2(g)⇌2NO(g) △H=+180.5kJ·mol-1;
ⅱ.2NO(g)+O2(g)⇌2NO2(g) △H=-114.0kJ·mol-1;
ⅲ.2NO2(g)⇌N2O4(g) △H=-52.7kJ·mol-1。
回答下列问题:
(1)、该条件下,N2中N≡N键的键能为916.5kJ·mol-1 , O2中O=O键的键能为458.0kJ·mol-1 , 则NO中化学键的键能为。(2)、向某刚性密闭容器中充入等量的N2和O2 , 一定温度下发生上述3个反应。①下列状态能说明上述反应达到平衡状态的是(填字母)。
a.NO浓度不再变化
b.混合气体的颜色不再变化
c.混合气体的密度不再变化
d.每消耗2molNO2 , 同时消耗1molN2O4。
②若起始时容器内总压强为p1 kPa,10s时容器内3个反应达到平衡状态,此时的总压强和N2O4的分压分别为p2 kPa和p3 kPa;则前10s内N2O4的平均生成速率为kPa·s-1 , 该温度下反应ⅲ的平衡常数Kp=kPa-1。
③若升高温度,平衡体系中NO的体积分数(填“增大”“减小”或“无法确定”),原因为。
(3)、反应6NO(g)+4NH3(g)⇌5N2(g)+6H2O(g) △H<0,是工业上处理氮氧化物的方法之一、向某密闭容器中投入等量的NO和NH3发生上述反应,平衡时,NO和H2O的物质的量随温度的变化如图所示。
①图中代表NO物质的量变化的曲线为。
②T1℃下,N2的平衡体积分数为。
19. 高分子化合物G在电子科技的前沿领域应用广泛。利用芳香烃A合成G的一种路线如图所示。
已知:
 (R代表烃基)。
(R代表烃基)。请回答下列问题:
(1)、B的化学名称为;C中所含官能团的名称为。(2)、反应②和③的反应类型分别为、。(3)、若用芳香烃A制备 ,所需试剂和条件分别为。 (4)、反应⑥的化学方程式为。(5)、M为A的链状同分异构体,其中存在顺反异构的顺式M的结构简式为。(6)、苯环上有2个取代基的D的同分异构体有种。(7)、参考上述合成路线和信息,设计以A和CH3Cl为原料制备
,所需试剂和条件分别为。 (4)、反应⑥的化学方程式为。(5)、M为A的链状同分异构体,其中存在顺反异构的顺式M的结构简式为。(6)、苯环上有2个取代基的D的同分异构体有种。(7)、参考上述合成路线和信息,设计以A和CH3Cl为原料制备 的合成路线(其他试剂任选):。 20. 葡萄糖酸钙是一种常用的药物,临床上用于治疗骨质疏松症。某实验室对葡萄糖酸钙的制备工艺进行研究,先以葡萄糖[CH2OH(CHOH)4CHO]和H2O2为原料制备葡萄糖酸[CH2OH(CHOH)4COOH],再用葡萄糖酸与碳酸钙反应制备葡萄糖酸钙。已知:30%H2O2溶液的密度为1.1g·cm-3 , 回答下列问题:(1)、I.制备葡萄糖酸(装置如图所示)。
的合成路线(其他试剂任选):。 20. 葡萄糖酸钙是一种常用的药物,临床上用于治疗骨质疏松症。某实验室对葡萄糖酸钙的制备工艺进行研究,先以葡萄糖[CH2OH(CHOH)4CHO]和H2O2为原料制备葡萄糖酸[CH2OH(CHOH)4COOH],再用葡萄糖酸与碳酸钙反应制备葡萄糖酸钙。已知:30%H2O2溶液的密度为1.1g·cm-3 , 回答下列问题:(1)、I.制备葡萄糖酸(装置如图所示)。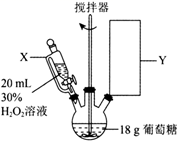
仪器X的名称为 , Y处为冷凝回流装置,下列仪器使用正确且效果最好的是(填字母)。
 (2)、滴入双氧水,水浴加热一段时间后,得到无色透明的葡萄糖酸溶液。反应的化学方程式为。(3)、Ⅱ.测定葡萄糖的转化率,确定合适的反应温度。
(2)、滴入双氧水,水浴加热一段时间后,得到无色透明的葡萄糖酸溶液。反应的化学方程式为。(3)、Ⅱ.测定葡萄糖的转化率,确定合适的反应温度。用移液管取出三口烧瓶中的反应液2.00mL置于锥形瓶中,以酚酞作为指示剂并加20mL蒸馏水稀释,用0.04mol·L-1NaOH标准溶液滴定。
①滴定管使用的正确的操作顺序为蒸馏水洗涤→标准液润洗→→→→→洗净→放回滴定管架(填字母)。
a.滴定结束后,记录刻度
b.调节液面至0刻度或0刻度略靠下,记录刻度
c.装入标准液并排净尖嘴处的气泡
d.将未滴定完的标准液回收
②达到滴定终点时的现象为。
③滴定过程消耗NaOH标准溶液的体积为V0mL,反应后三口烧瓶内溶液的体积为V1mL,实验条件下葡萄糖的转化率为(用含V0和V1的代数式表示)。
④若滴定终点时俯视读数,对转化率的影响为(填“偏高”“偏低”或“无影响”)。
(4)、Ⅲ.制备葡萄糖酸钙。将CaCO3分散于适量蒸馏水中形成浊液,加入葡萄糖酸,至无CO2气体放出为止,煮沸,并趁热采用下图装置抽滤,滤掉未反应的CaCO3 , 得到澄清透明的葡萄糖酸钙溶液。

抽滤时自来水流的作用是使瓶内与大气形成压强差,与普通过滤操作相比,抽滤的优点是。