山东省日照市2021年高考化学三模试卷
试卷更新日期:2021-07-09 类型:高考模拟
一、单选题
-
1. 化学与科学、技术、生活密切相关,下列说法正确的是( )A、“中国天眼”的球面射电板由铝合金板制成,铝合金比纯铝的熔点低、硬度大 B、工业上常用硫化物沉淀法处理重金属废水,且不会产生二次污染 C、“神舟十一号”飞船使用的半导体材料GaAs可用SiO2代替 D、ⅢB族的17种稀土元素均属于d区元素2. 下列说法正确的是( )A、液溴需贮存在带橡胶塞的棕色细口瓶中,并进行水封 B、洗净的滴定管和容量瓶应放入烘箱中烘干 C、可以将高锰酸钾固体和无水乙醇放在一个药品柜里保存 D、滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁3. 下列实验装置不能达到相应实验目的的是( )
 A、用甲装置验证NH3在水中的溶解度大 B、用乙装置验证牺牲阳极保护法 C、用丙装置将CuCl2溶液蒸干制备CuCl2 D、用丁装置验证溴乙烷的消去产物是乙烯4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W与氢元素形成的二元化合物为五核10电子;X元素价电子排布式为nsnnpn+2;X、Y同主族相邻。下列说法正确的是( )A、WY2属于极性分子 B、W的某种单质可能是共价晶体 C、YX 的空间构型为平面三角形 D、氧化物对应水化物的酸性:W<Y<Z5. NA为阿伏加德罗常数的值。下列说法错误的是( )A、1mol白磷分子中含有P—P共价键数为6NA B、1molNH4Cl溶于水形成的溶液中阳离子总数大于NA C、1molH2O分子中氧原子的价层电子对数为4NA D、常温下,pH=10的NaHCO3溶液中,由水电离产生的H+数为10-4NA6. 五味子丙素对急慢性肝损伤有较好的改善效果,五味子丙素的结构如图所示,下列有关说法错误的是( )
A、用甲装置验证NH3在水中的溶解度大 B、用乙装置验证牺牲阳极保护法 C、用丙装置将CuCl2溶液蒸干制备CuCl2 D、用丁装置验证溴乙烷的消去产物是乙烯4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W与氢元素形成的二元化合物为五核10电子;X元素价电子排布式为nsnnpn+2;X、Y同主族相邻。下列说法正确的是( )A、WY2属于极性分子 B、W的某种单质可能是共价晶体 C、YX 的空间构型为平面三角形 D、氧化物对应水化物的酸性:W<Y<Z5. NA为阿伏加德罗常数的值。下列说法错误的是( )A、1mol白磷分子中含有P—P共价键数为6NA B、1molNH4Cl溶于水形成的溶液中阳离子总数大于NA C、1molH2O分子中氧原子的价层电子对数为4NA D、常温下,pH=10的NaHCO3溶液中,由水电离产生的H+数为10-4NA6. 五味子丙素对急慢性肝损伤有较好的改善效果,五味子丙素的结构如图所示,下列有关说法错误的是( ) A、五味子丙素能发生取代、氧化、还原、加成反应 B、分子中所有氧原子一定共面 C、1mo1五味子丙素分子中含有2mol手性碳原子 D、五味子丙素的一溴代物有12种7. ClO2是国际上公认的安全绿色消毒剂。工业上利用甲醇还原NaClO3的方法制备ClO2的反应原理为:NaClO3+H2SO4+CH3OH→ClO2↑+HCOOH+Na3H(SO4)2↓+H2O(未配平),下列说法错误的是( )A、HCOOH为该反应的氧化产物 B、生成2.24L ClO2时,电子转移数是0.1NA C、反应中氧化剂和还原剂物质的量之比为4:1 D、ClO2和SO2均能漂白纸张,但漂白原理不同8. 某汽车安全气囊的气体发生剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。已知叠氮酸(HN3)与CH3COOH的酸性相似。下列说法错误的是( )A、室温下,Kh(N )>Kh(HCO ) B、室温下,NaN3溶液中:c(Na+)=c(N )+2c(HN3)+c(H+)-c(OH-) C、Fe2O3的作用是与NaN3分解产生的Na发生置换反应生成Fe和Na2O D、KClO4是助氧化剂,NaHCO3是冷却剂,气囊打开时其中的气体主要是N2和CO29. 用TiOSO4溶液生产纳米TiO2的工艺流程如下:
A、五味子丙素能发生取代、氧化、还原、加成反应 B、分子中所有氧原子一定共面 C、1mo1五味子丙素分子中含有2mol手性碳原子 D、五味子丙素的一溴代物有12种7. ClO2是国际上公认的安全绿色消毒剂。工业上利用甲醇还原NaClO3的方法制备ClO2的反应原理为:NaClO3+H2SO4+CH3OH→ClO2↑+HCOOH+Na3H(SO4)2↓+H2O(未配平),下列说法错误的是( )A、HCOOH为该反应的氧化产物 B、生成2.24L ClO2时,电子转移数是0.1NA C、反应中氧化剂和还原剂物质的量之比为4:1 D、ClO2和SO2均能漂白纸张,但漂白原理不同8. 某汽车安全气囊的气体发生剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。已知叠氮酸(HN3)与CH3COOH的酸性相似。下列说法错误的是( )A、室温下,Kh(N )>Kh(HCO ) B、室温下,NaN3溶液中:c(Na+)=c(N )+2c(HN3)+c(H+)-c(OH-) C、Fe2O3的作用是与NaN3分解产生的Na发生置换反应生成Fe和Na2O D、KClO4是助氧化剂,NaHCO3是冷却剂,气囊打开时其中的气体主要是N2和CO29. 用TiOSO4溶液生产纳米TiO2的工艺流程如下:
下列说法错误的是( )
A、在实验室中进行“操作I”,需要的玻璃仪器有烧杯、玻璃棒、漏斗 B、“沉钛”时反应的离子方程式为:‘TiO2++2NH3·H2O=TiO(OH)2↓+2NH C、回收“滤液”中的(NH4)2SO4 , 应采用蒸发结晶法 D、纳米TiO2形成分散系时,具有较好的散射能力10. 用下图所示装置探究某浓度浓硝酸与铁的反应。装置①中Fe表面产生红棕色气泡,过一会儿停止;装置②插入铜连接导线一段时间后,Fe表面产生红棕色气泡,而后停止;随即又产生红棕色气泡,而后停止,……,如此往复多次;Cu表面始终有红棕色气泡。下列说法正确的是( )
 A、①中现象说明该浓硝酸具有强氧化性,能将Fe钝化为Fe2O3 B、②中连接导线后,体系形成了原电池,Cu始终为负极 C、②中Fe表面产生红棕色气泡时,Fe为负极 D、Cu表面发生的反应只有:Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O、NO +2H++e-=NO2↑+H2O11. 以197g六氨合氯化镁为原料,经酸化、碳化、热解、过滤、干燥制得932g碱式碳酸镁产品,同时获取副产物CO2 26.88L(标准状况)。原理如下(假定每步反应都没有损耗; x、y、z的最简整数比为x:y:z)。
A、①中现象说明该浓硝酸具有强氧化性,能将Fe钝化为Fe2O3 B、②中连接导线后,体系形成了原电池,Cu始终为负极 C、②中Fe表面产生红棕色气泡时,Fe为负极 D、Cu表面发生的反应只有:Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O、NO +2H++e-=NO2↑+H2O11. 以197g六氨合氯化镁为原料,经酸化、碳化、热解、过滤、干燥制得932g碱式碳酸镁产品,同时获取副产物CO2 26.88L(标准状况)。原理如下(假定每步反应都没有损耗; x、y、z的最简整数比为x:y:z)。酸化反应:MgCl2·6NH3+6HCl=MgCl2+6NH4Cl;
碳化反应:MgCl2+2NH4HCO3=Mg(HCO3)2+2NH4Cl;
热解反应:Mg(HCO3)2→xMgCO3·yMg(OH)2·zH2O↓+CO2↑(未配平)。
下列说法正确的是( )
A、xMgCO3·yMg(OH)2·zH2O属于混合物 B、x=z=2 C、y=1 D、副产物NH4Cl可用作化肥,也可用热分解法制备氨气12. 包覆纳米硅复合材料(GS-Si)的可充电石墨烯电池工作原理如图所示。放电时,GS-Si包覆石墨烯电极上的物质变化为:C6Li→C6Li1-x;多元含锂过渡金属氧化物电极上的物质变化为:Li1-xMO2→LiMO2 , 下列说法错误的是( ) A、放电时,胶状聚合物电解质和固体电解质的作用均为传导离子,构成闭合回路 B、若放电前两个电极质量相等,转移0.1mol电子后两个电极质量相差0.7g C、充电时,与正极连接的电极反应为LiMO2-xe-=Lil-xMO2+xLi+ D、为保护电池,GS-Si包覆石墨烯的电极反应不能进行至C6Li-e-=C6+Li+
A、放电时,胶状聚合物电解质和固体电解质的作用均为传导离子,构成闭合回路 B、若放电前两个电极质量相等,转移0.1mol电子后两个电极质量相差0.7g C、充电时,与正极连接的电极反应为LiMO2-xe-=Lil-xMO2+xLi+ D、为保护电池,GS-Si包覆石墨烯的电极反应不能进行至C6Li-e-=C6+Li+二、多选题
-
13. 有机化合物G是合成抗真菌药物的重要中间体,结构简式如下图。下列说法错误的是( )
 A、G的分子式为C11H13O5Cl B、G分子中含四种官能团 C、G分子含有σ键、π键、大π键、氢键等化学键 D、1molG最多可与3molH2加成,最多与4molNaOH反应14. 中国科学院化学研究所报道了化合物1催化CO2氢化机理。其机理中化合物1(催化剂,固态)→化合物2(中间产物,固态)的过程和其相对能量曲线如下图所示。下列说法错误的是( )
A、G的分子式为C11H13O5Cl B、G分子中含四种官能团 C、G分子含有σ键、π键、大π键、氢键等化学键 D、1molG最多可与3molH2加成,最多与4molNaOH反应14. 中国科学院化学研究所报道了化合物1催化CO2氢化机理。其机理中化合物1(催化剂,固态)→化合物2(中间产物,固态)的过程和其相对能量曲线如下图所示。下列说法错误的是( )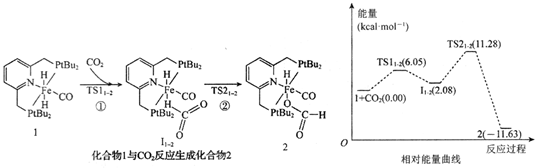 A、化合物1与CO2反应生成化合物2的过程中有两个过渡态TS11-2、TS21-2 , 说明这一过程包含两个基元反应 B、图中Ⅰ1-2与化合物2互为同分异构体 C、过程①的活化能高于过程②的活化能 D、过程①的热化学方程式为:I(s)+CO2(g)=I1-2 (s) △H=2.08 kJ·mol-115. 向x mol·L-1的20mLH2B溶液中滴入相同浓度的NaOH溶液,测得H2B、HB-、B2-的pH-pc(pc=-lgc)曲线如图所示。下列说法正确的是( )
A、化合物1与CO2反应生成化合物2的过程中有两个过渡态TS11-2、TS21-2 , 说明这一过程包含两个基元反应 B、图中Ⅰ1-2与化合物2互为同分异构体 C、过程①的活化能高于过程②的活化能 D、过程①的热化学方程式为:I(s)+CO2(g)=I1-2 (s) △H=2.08 kJ·mol-115. 向x mol·L-1的20mLH2B溶液中滴入相同浓度的NaOH溶液,测得H2B、HB-、B2-的pH-pc(pc=-lgc)曲线如图所示。下列说法正确的是( ) A、a、b点所在曲线对应的粒子为HB- B、水电离出的氢离子浓度大小关系为:c>b>a C、c点,滴入NaOH溶液的体积为10mL D、
A、a、b点所在曲线对应的粒子为HB- B、水电离出的氢离子浓度大小关系为:c>b>a C、c点,滴入NaOH溶液的体积为10mL D、三、综合题
-
16. 硼酸(H3BO3)是玻璃工业、电子元件行业的重要原料。回答下列问题:(1)、与B、O同周期,第一电离能介于二者之间的有(填元素符号)。(2)、硼酸晶体结构为平面层状结构(如图I),四硼酸根为立体结构(如图Ⅱ)。

①硼酸为晶体;晶体中各层之间的作用力为。
②四硼酸根中硼原子的杂化方式为。
(3)、工业上曾用碳氨法制备硼酸,先用MgO·B2O3与NH4HCO3、H2O制得(NH4)H2BO3和MgCO3 , 然后再将(NH4)H2BO3脱NH3生成H3BO3。①NH 与CO 的空间构型:NH :CO 。
②MgO晶体结构属于NaCl型(如图),图中表示Mg2+的为(填“大球”或“小球”),其配位数是;MgO晶胞参数为a pm,则MgO晶胞的密度为g·cm-3(NA表示阿伏加德罗常数的值,用含a、NA的式子表示)。
 17. 氢能是一种理想的绿色能源,一种太阳能两步法甲烷蒸气重整制氢原理合成示意图如下:
17. 氢能是一种理想的绿色能源,一种太阳能两步法甲烷蒸气重整制氢原理合成示意图如下:
回答下列问题:
(1)、第Ⅰ步:NiFe2O4(s)+CH4(g) NiO(s)+2FeO(s)+CO(g)+2H2(g) =a kJ·mol-1。总反应可表示为:CH4(g)+H2O(g) CO(g)+3H2(g) =b kJ·mol-1。写出第Ⅱ步反应的热化学方程式:。(2)、实验测得分步制氢比直接利用CH4和H2O(g)反应具有更高的反应效率,原因是。(3)、第Ⅰ、Ⅱ步反应的lgKp-T图像如下。
由图像可知ab(填“大于”或“小于”),1000℃时,第Ⅱ步反应的化学平衡常数K= , 测得该温度下第Ⅰ步反应平衡时CH4的平衡分压p(CH4)=4.0kPa,则平衡混合气体中H2的体积分数为(保留一位小数)。
 (4)、第Ⅰ步反应产生的合成气(CO和H2的混合气体)可用于F-T合成(以合成气为原料在催化剂和适当条件下合成碳氢化合物的工艺过程)。合成碳氢化合物时易发生副反应CO+H2O(g) CO2+H2 , 如图为相同条件下用不同催化剂在不同时间段测得反应体系内CO2的体积分数,据此应选择的催化剂是(填“Ⅰ”或“Ⅱ”),选择的依据是。18. NiSO4·nH2O易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中回收制备NiSO4·nH2O和其它金属的工艺流程如下。
(4)、第Ⅰ步反应产生的合成气(CO和H2的混合气体)可用于F-T合成(以合成气为原料在催化剂和适当条件下合成碳氢化合物的工艺过程)。合成碳氢化合物时易发生副反应CO+H2O(g) CO2+H2 , 如图为相同条件下用不同催化剂在不同时间段测得反应体系内CO2的体积分数,据此应选择的催化剂是(填“Ⅰ”或“Ⅱ”),选择的依据是。18. NiSO4·nH2O易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中回收制备NiSO4·nH2O和其它金属的工艺流程如下。
已知:Ⅰ.电镀污泥含有Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等。
Ⅱ.萃取剂(RH)萃取Ni2+的原理为Ni2++2RH2 NiR2+2H+。
回答下列问题:
(1)、“酸浸”时,为加快浸出速率,提高生产效益,下列措施不合理的有___________(填标号)。A、用机械搅拌器搅拌 B、体积不变增加硫酸的浓度 C、进一步球磨粉碎(2)、“电解”时,铜的电解电压较低,且电解速率很快,铁和铬存在形式随电解电压的变化如下表。为得到纯的NiSO4·nH2O,电解电压的范围应选择V。电解电压/V
1.0
1.2
1.5
2.0
2.5
3.0
3.5
Fe2+
有
有
有
无
无
无
无
Cr4+
无
无
无
无
无
有
有
(3)、萃取余液可在中循环利用(填操作单元),反萃取剂X为(填化学式)。(4)、“反萃取”得到的NiSO4溶液,可在强碱溶液中被NaClO氧化,得到用作镍镉电池正极材料的NiOOH。该反应的离子方程式为。NiSO4溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作可得NiSO4·nH2O。下列说法正确的是(填标号)。A.为得到较大NiSO4·nH2O晶体颗粒,宜用冰水快速冷却结晶
B.蒸发浓缩至溶液表面出现晶膜时,停止加热
C.可通过抽滤提高过滤速度,在80℃鼓风干燥,快速得到干燥晶体
D.向冷却结晶后的固液混合物中加入乙醇可提高产率
(5)、采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为;C点产物的化学式为。 19. FeCl2是重要的媒染剂和污水处理剂。某校化学探究团队查阅有关资料,在实验室中用氯苯消氯法制备无水FeCl2 , 原理为:C6H5Cl+2FeCl3→2FeCl2+C6H4Cl2+HCl↑,装置如下图(夹持装置已略去)。
19. FeCl2是重要的媒染剂和污水处理剂。某校化学探究团队查阅有关资料,在实验室中用氯苯消氯法制备无水FeCl2 , 原理为:C6H5Cl+2FeCl3→2FeCl2+C6H4Cl2+HCl↑,装置如下图(夹持装置已略去)。
已知:
Ⅰ.FeCl2、FeCl3不溶于氯苯、二氯苯;
Ⅱ.C6H5Cl、C6H4Cl2二者互溶,不溶于水;沸点分别为132℃、173℃。
回答下列问题:。
(1)、仪器a的名称为 , 该仪器(填“能”或“不能”)用于石油的分馏。(2)、该团队用3.25g FeCl3与过量氯苯反应,实验结束后将三颈烧瓶中的物质倒出,过滤、洗涤、干燥后得到粗产品,回收滤液中氯苯的方法为(填操作名称)。(3)、经讨论后,分为甲、乙两组用不同方法测定FeCl3的转化率。①甲组:用0.40mol·L-1NaOH标准液滴定锥形瓶内的溶液,可选用的指示剂为;若终点时消耗18.50mL NaOH标准液,则FeCl3转化率为%。
②乙组:将粗产品制成250mL溶液,取出25.00mL,用0.0200mol·L-1标准KMnO4溶液滴定(已知:本实验条件下,Cl-不参与反应:KMnO4还原产物为Mn2+)。达到滴定终点时的现象为 , 经平行实验测得平均消耗标准液16.00mL,则甲组测定结果(填“高于”或“低于”)乙组测定结果。
③某检测机构对粗产品进行测定,经数据分析测得FeCl3的转化率为79.95%。与乙组和检测机构的测定结果对比,若无操作失误,甲组产生较大误差可能的原因为。
20. 抗抑郁药物米氮平(物质G)的一种合成路线如下:
已知:Ⅰ. RCH=CH2

Ⅱ.


Ⅲ. (各过程中R,R’表示含C原子团或H原子)
回答下列问题:
(1)、物质A的名称为 , 测定其所含官能团的仪器一般用(填光谱仪器名称)。(2)、有机物H与物质B互为同分异构体,H不能使溴的四氯化碳溶液褪色,且分子中只含两种不同环境的氢原子,则H的结构简式为。(3)、C的结构简式为 , D的分子式为。(4)、E生成F的反应方程为 , F生成G的反应类型为反应。(5)、参照题中所给信息,设计以 和
和  为原料,合成
为原料,合成  的路线(无机试剂任选)
的路线(无机试剂任选)