山东省青岛市2021年高考化学二模试卷
试卷更新日期:2021-07-09 类型:高考模拟
一、单选题
-
1. 三星堆两次考古挖掘举世震惊,二号祭祀坑出土商代的铜人铜像填补了我国考古学、青铜文化、青铜艺术史上的诸多空白。下列有关说法错误的是( )
 A、铜像表面的铜绿[ ]能在空气中稳定存在 B、测定出土文物年代的 是碳的一种同素异形体 C、X射线衍射法可对青铜器微观晶体结构进行分析 D、青铜器的出土表明我国商代已经掌握冶炼铜技术2. 下列化学用语正确的是( )A、 的比例模型:
A、铜像表面的铜绿[ ]能在空气中稳定存在 B、测定出土文物年代的 是碳的一种同素异形体 C、X射线衍射法可对青铜器微观晶体结构进行分析 D、青铜器的出土表明我国商代已经掌握冶炼铜技术2. 下列化学用语正确的是( )A、 的比例模型: B、丙醛的键线式:
B、丙醛的键线式:  C、次氯酸的电子式:
C、次氯酸的电子式:  D、 的电离方程式:
3. 以脱脂棉为材质的化妆棉,吸水效果优于普通棉花,其主要成分为纤维素,结构如图。下列说法错误的是( )
D、 的电离方程式:
3. 以脱脂棉为材质的化妆棉,吸水效果优于普通棉花,其主要成分为纤维素,结构如图。下列说法错误的是( ) A、纤维素的吸水性较强与其结构中含羟基有关 B、纤维素能与醋酸发生酯化反应制得人造纤维 C、淀粉和纤维素都属于多糖,且二者互为同分异构体 D、棉花脱脂时加入2%~5%的 目的是为了促进酯的水解4. 是一种无色无味的气体,结构式如图,可溶于水生成草酸: 。下列说法正确的是( )
A、纤维素的吸水性较强与其结构中含羟基有关 B、纤维素能与醋酸发生酯化反应制得人造纤维 C、淀粉和纤维素都属于多糖,且二者互为同分异构体 D、棉花脱脂时加入2%~5%的 目的是为了促进酯的水解4. 是一种无色无味的气体,结构式如图,可溶于水生成草酸: 。下列说法正确的是( ) A、甲酸与草酸互为同系物 B、 是非极性分子 C、晶体熔点:草酸>冰>三氧化二碳>干冰 D、 、 和 分子中碳原子的杂化方式均相同5. 用下列仪器或装置进行相应实验,达不到实验目的的是( )
A、甲酸与草酸互为同系物 B、 是非极性分子 C、晶体熔点:草酸>冰>三氧化二碳>干冰 D、 、 和 分子中碳原子的杂化方式均相同5. 用下列仪器或装置进行相应实验,达不到实验目的的是( )熔融 固体
检验溴乙烷消去产物中的乙烯
制取并收集少量
探究温度对平衡移动的影响




A
B
C
D
A、A B、B C、C D、D6. 绿色食材百合所含的秋水仙碱,是一种酰胺类化合物,具有抗炎和免疫调节等作用。下列关于秋水仙碱的说法正确的是( ) A、分子式为 B、分子中含有3种官能团 C、分子中所有碳原子可能共面 D、1 秋水仙碱最多能与7 发生加成反应7. 表中元素①~⑧均为短周期元素:
A、分子式为 B、分子中含有3种官能团 C、分子中所有碳原子可能共面 D、1 秋水仙碱最多能与7 发生加成反应7. 表中元素①~⑧均为短周期元素:元素
①
②
③
④
⑤
⑥
⑦
⑧
原子半径/
0.066
0.160
0.152
0.077
0.099
0.186
0.070
0.082
最外层电子数
6
2
3
常见化合价
+1
-4,+4
-1,+7
-3、+5
焰色实验
黄色
下列说法错误的是( )
A、③单质能在①或⑦的单质中燃烧 B、②和⑥元素原子的失电子能力强弱可通过单质与水反应比较 C、⑤分别与⑦、⑧形成的最简单分子的空间构型相同 D、第一电离能大小顺序:8. ( 储存还原)技术可有效降低柴油发动机中的 排放, 的储存和还原在不同时段交替进行,工作原理如图所示。下列说法正确的是( ) A、 储存过程中N元素化合价不变 B、 和 都是该反应过程的催化剂 C、 储存还原总反应中, 是还原剂, 是还原产物 D、 还原过程发生的反应为:9. 下列实验操作、现象及结论均正确的是( )
A、 储存过程中N元素化合价不变 B、 和 都是该反应过程的催化剂 C、 储存还原总反应中, 是还原剂, 是还原产物 D、 还原过程发生的反应为:9. 下列实验操作、现象及结论均正确的是( )实验操作和现象
实验结论
A
将惰性电极插入氢氧化铁胶体中,通电一段时间后,阴极区红褐色加深
氢氧化铁胶体带正电荷
B
向饱和食盐水中依次通入足量 、 ,有大量晶体析出
该条件下溶解度:
C
将苯加入到橙色的溴水中,充分振荡后静置,下层液体几乎无色
苯与 发生了取代反应
D
铜片投入到稀硫酸中,加热无明显现象;再加入少量硝酸钾固体,溶液变蓝色
硝酸钾起催化作用
A、A B、B C、C D、D10. 硫元素的价类二维图如图所示。下列说法错误的是( ) A、a与c、d、e都有可能反应生成b B、d溶液久置于空气中会生成e,溶液的 减小 C、盐g与盐f之间也可能发生反应 D、铜与e的浓溶液共热产生的气体通入 溶液中,无明显现象11. 甲磺酸伊马替尼是治疗慢性粒细胞白血病的首选药物,其合成路线如下图所示(次要产物省略)。下列有关说法错误的是( )
A、a与c、d、e都有可能反应生成b B、d溶液久置于空气中会生成e,溶液的 减小 C、盐g与盐f之间也可能发生反应 D、铜与e的浓溶液共热产生的气体通入 溶液中,无明显现象11. 甲磺酸伊马替尼是治疗慢性粒细胞白血病的首选药物,其合成路线如下图所示(次要产物省略)。下列有关说法错误的是( ) A、Ⅰ→Ⅲ通过发生取代反应产生酰胺键 B、Ⅱ、Ⅳ分子中均存在配位键 C、有机物Ⅲ不能使酸性高锰酸钾溶液褪色 D、Ⅳ分子中的C、N原子均存在 和 两种杂化方式12. 常温下,向10 0.1 的 溶液中逐滴滴入0.1 的 溶液,所得溶液电导率及 变化如图所示,已知 。下列分析错误的是( )
A、Ⅰ→Ⅲ通过发生取代反应产生酰胺键 B、Ⅱ、Ⅳ分子中均存在配位键 C、有机物Ⅲ不能使酸性高锰酸钾溶液褪色 D、Ⅳ分子中的C、N原子均存在 和 两种杂化方式12. 常温下,向10 0.1 的 溶液中逐滴滴入0.1 的 溶液,所得溶液电导率及 变化如图所示,已知 。下列分析错误的是( ) A、曲线Ⅰ表示溶液的 变化情况 B、 为弱酸,其电离常数 C、开始阶段溶液电导率增大是因为生成了强电解质 D、溶液中水的电离程度变化趋势与曲线Ⅱ相似
A、曲线Ⅰ表示溶液的 变化情况 B、 为弱酸,其电离常数 C、开始阶段溶液电导率增大是因为生成了强电解质 D、溶液中水的电离程度变化趋势与曲线Ⅱ相似二、多选题
-
13. 新型 双离子可充电电池是一种高效、低成本的储能电池,其工作原理如图。当闭合 时,发生反应为 ,下列关于该电池说法错误的是( )
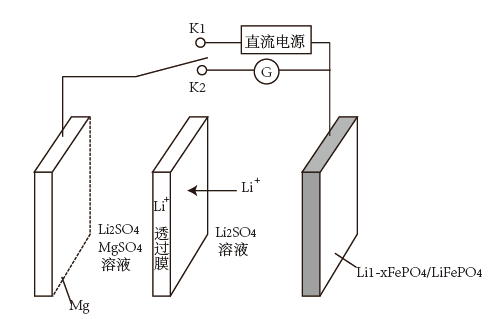 A、当闭合 时,出现图示中 移动情况 B、放电时正极的电极反应式为 C、可以通过提高 、 溶液的酸度来提高该电池的工作效率 D、若 ,则 中 与 的个数比为14. 铬与氮能形成多种化合物,其中氮化铬( )是一种良好的耐磨材料。实验室可用无水氯化铬( )与氨气在高温下反应制备,反应原理为: 。
A、当闭合 时,出现图示中 移动情况 B、放电时正极的电极反应式为 C、可以通过提高 、 溶液的酸度来提高该电池的工作效率 D、若 ,则 中 与 的个数比为14. 铬与氮能形成多种化合物,其中氮化铬( )是一种良好的耐磨材料。实验室可用无水氯化铬( )与氨气在高温下反应制备,反应原理为: 。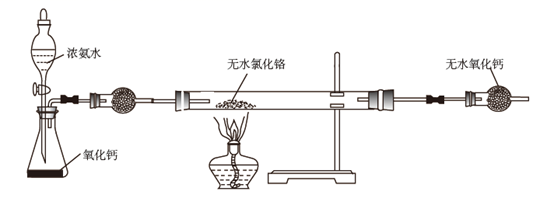
下列说法正确的是( )
A、无水氯化铬可以通过直接加热氯化铬晶体( )脱水得到 B、反应开始时应先将硬质玻璃管预热,再打开分液漏斗活塞 C、硬质玻璃管右端的导气管过细,易产生堵塞 D、将12.8g产品在空气中充分加热,得15.2g固体残渣( ),产品中可能含有15. 极易发生水解,水解机理如图所示,下列说法错误的是( ) A、整个反应历程中P的化合价不变 B、水解产物 是一种三元弱酸 C、 中3个 原子被取代的机会不相等 D、 分子的P原子有孤电子对,易与金属离子配位而形成配合物
A、整个反应历程中P的化合价不变 B、水解产物 是一种三元弱酸 C、 中3个 原子被取代的机会不相等 D、 分子的P原子有孤电子对,易与金属离子配位而形成配合物三、综合题
-
16. HgCl2稀溶液可用作外科手术刀消毒剂,HgCl2晶体熔点较低,熔融状态下不导电。(1)、HgCl2属于化合物(填“离子”或“共价”)。(2)、HgCl2和不同浓度NH3-NH4Cl反应得到某种含汞化合物的晶胞结构M如图所示:(部分微粒不在晶胞内)

①写出该含汞化合物的化学式。
②M中 (填“大于”、“小于”、或“等于”)NH3中的 ,分析原因。
③该含汞化合物晶体在水中的溶解性(填“可溶”或“难溶”),分析原因。
④在晶胞中Cl原子a的分数坐标为( , ,1),则Hg原子b的分数坐标为;晶胞的体积为V cm3 , 则该晶体的密度为 。
17. 铍可应用于飞机、火箭制造业和原子能工业。素有“中国铍业一枝花”之称的湖南水口山六厂改进国外生产工艺,以硅铍石(主要成分为 、 、 、 、 )为原料提取铍,具体流程如下:
已知:①铍和铝在元素周期表中处于对角线位置,电负性相近,其单质及化合物在结构与性质等方面具有相似性。
②铝铵钒在不同温度下的溶解度:
温度/℃
0
10
20
30
40
60
溶解度/g
2.10
5.00
7.74
10.9
14.9
26.7
回答下列问题:
(1)、流程中“系列操作”为。(2)、将“中和液”沉淀时,调节溶液的 不能过大或过小。 过大时发生反应的离子方程式为。(3)、已知 , 。若 浓度为0.40 的中和液开始沉淀时,溶液中 。(4)、若在实验室洗涤粗 ,操作为;洗涤时加入 溶液除去表面吸附的少量氢氧化铝,反应的离子方程式为。(5)、氧化铍转化为氯化铍的化学方程式为。(6)、 的电子式为;电解时须加入氯化钠的作用是。18. 实验室制取硝基苯常规方法为:在大试管中将浓硝酸和浓硫酸按体积比 混合,摇匀、冷却后滴入苯,水浴加热至55℃~60℃,即可制得硝基苯。将该实验进行改进,以 为绿色硝化剂制取硝基苯的反应原理、实验装置及实验步骤如下:反应方程式:

实验步骤:
Ⅰ.将100 浓度为0.108 的 溶液加入到装有高选择性分子筛催化剂( )的反应器中。
Ⅱ.在搅拌状态下,将一定量的苯用恒压滴液漏斗滴加至反应器中,使 与 物质的量之比达到 ,并控制反应温度在15℃以下。
Ⅲ.滴加完毕后继续搅拌一段时间,将反应器中的液体倒入饱和 溶液中,分液得到粗产品。
Ⅳ.将粗产品进一步纯化得到硝基苯9.84g。
回答下列问题:
(1)、常规法制取硝基苯的化学方程式为。(2)、对比常规法,以 制取硝基苯的方法更符合“绿色化学”理念,原因是。(3)、准确配制100 浓度为0.108 的 的 溶液用到的玻璃仪器有烧杯、玻璃棒、、。(4)、控制反应温度15℃左右的操作是。(5)、“步骤3”中饱和碳酸氢钠溶液的作用是。(6)、“步骤4”中“进一步纯化”的方法是。(7)、若忽略提纯过程中硝基苯的损耗, 的转化率为。19. 有机物M在有机化工生产中应用广泛,其合成路线如下: 已知:
已知:①M的核磁共振氢谱图显示分子中有4种不同化学环境的氢,峰面积比为 。
②

③

回答下列问题:
(1)、A的名称为。(2)、B结构简式为;M中官能团名称为。(3)、C→D的化学方程式为。(4)、E的同分异构体中,满足下列条件的有种。①苯环上含有3个取代基 ②遇 溶液显紫色 ③能发生水解反应
(5)、 的反应中,使用浓 能大大提高M的产率,请从原理角度分析原因。(6)、以 和
和  为起始原料合成
为起始原料合成  的合成路线为。(其它无机试剂任选) 20. 汽车尾气是否为导致空气质量问题的主要原因,由此引发的“汽车限行”争议,是当前备受关注的社会性科学议题。(1)、反应 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示( 表示过渡态、 表示中间产物)。
的合成路线为。(其它无机试剂任选) 20. 汽车尾气是否为导致空气质量问题的主要原因,由此引发的“汽车限行”争议,是当前备受关注的社会性科学议题。(1)、反应 可有效降低汽车尾气污染物的排放。一定条件下该反应经历三个基元反应阶段,反应历程如图所示( 表示过渡态、 表示中间产物)。
三个基元反应中,属于放热反应的是(填标号);图中 。
(2)、探究温度、压强(2 、5 )对反应 的影响,如图所示,表示2 的是(填标号)。 (3)、用 可以消除 污染:
(3)、用 可以消除 污染:①某条件下该反应速率 , ,该反应的平衡常数 ,则 , 。
②一定温度下,在体积为1L的恒容密闭容器中加入4 和6 发生上述反应,测得 和 的物质的量随时间变化如图。

a点的正反应速率c点的逆反应速率(填“大于”、“小于”或“等于”);测得平衡时体系压强为 ),则该反应温度下 。(用含 的式子表示,只列式不用化简)。若在相同时间内测得 的转化率随温度的变化曲线如下图,400℃~900℃之间 的转化率下降由缓到急的原因是。
