山东省临沂市2021年高考化学二模试卷
试卷更新日期:2021-07-09 类型:高考模拟
一、单选题
-
1. “嫦娥五号”成功着陆月球,实现了中国首次月球无人采样返回。下列说法错误的是( )A、运载火箭使用了煤油液氧推进剂,其中煤油是由煤干馏获得 B、探测器装有太阳能电池板,其主要成分为晶体硅 C、上升器用到碳纤维复合材料,主要利用其质轻、强度大和耐高温性能 D、返回器带回的月壤中含有3He,与地球上的4He互为同位素2. 下列应用涉及氧化还原反应的是( )A、用TiCl4制备纳米级TiO2 B、高铁酸钾(K2FeO4)用作新型水处理剂 C、用明矾溶液除去铜制品表面的铜绿 D、工业上将NH3和CO2通入饱和食盐水制备小苏打3. 一水合甘氨酸锌是一种矿物类饲料添加剂,其结构简式如图所示。下列说法正确的是( )
 A、第一电离能:O>N>C>H B、分子中C和N的杂化方式相同 C、基态Zn原子的核外电子有15种空间运动状态 D、该物质中,Zn 的配位数为4,配位原子为O、N4. 短周期主族元素X、Y、Z、W的原子半径依次增大。X、Y位于同一主族,Z元素在第三周期中离子半径最小,Z和W的原子序数之和是X的3倍。下列说法错误的是( )A、简单氢化物的热稳定性:X>Y B、氧化物的熔点:Z>W C、含Z元素的盐溶液可能显碱性 D、X与Y组成的分子中所有原子均满足8电子稳定结构5. 实验室提供的仪器有:试管、导管、酒精灯、容量瓶、玻璃棒、烧杯、蒸发皿、分液漏斗(非玻璃仪器任选),选用上述仪器不能完成的实验是( )A、用苯萃取溴水中的溴 B、配制0.5 mol/L的硫酸 C、制备乙酸乙酯 D、硫酸铜溶液的浓缩结晶6. 合成环己酮缩乙二醇的原理为
A、第一电离能:O>N>C>H B、分子中C和N的杂化方式相同 C、基态Zn原子的核外电子有15种空间运动状态 D、该物质中,Zn 的配位数为4,配位原子为O、N4. 短周期主族元素X、Y、Z、W的原子半径依次增大。X、Y位于同一主族,Z元素在第三周期中离子半径最小,Z和W的原子序数之和是X的3倍。下列说法错误的是( )A、简单氢化物的热稳定性:X>Y B、氧化物的熔点:Z>W C、含Z元素的盐溶液可能显碱性 D、X与Y组成的分子中所有原子均满足8电子稳定结构5. 实验室提供的仪器有:试管、导管、酒精灯、容量瓶、玻璃棒、烧杯、蒸发皿、分液漏斗(非玻璃仪器任选),选用上述仪器不能完成的实验是( )A、用苯萃取溴水中的溴 B、配制0.5 mol/L的硫酸 C、制备乙酸乙酯 D、硫酸铜溶液的浓缩结晶6. 合成环己酮缩乙二醇的原理为 + HOCH2CH2OH
+ HOCH2CH2OH  +H2O。在反应体系中加入适量苯,利用如图装置(加热及夹持装置省略)可提高环已酮缩乙二醇产率。下列说法错误的是( )
+H2O。在反应体系中加入适量苯,利用如图装置(加热及夹持装置省略)可提高环已酮缩乙二醇产率。下列说法错误的是( )  A、b是冷却水的进水口 B、对甲基苯磺酸可能起催化作用 C、苯可将反应产生的水及时带出 D、当苯即将回流烧瓶中时,必须将分水器中的水和苯放出7. CuCl是一种白色晶体,难溶于水,在潮湿的空气中易被氧化。实验室制备CuCl的反应原理为SO2+ 2CuCl2+2H2O=2CuCl ↓+H2SO4+2HCl。用下列装置进行实验,不能达到实验目的的是( )
A、b是冷却水的进水口 B、对甲基苯磺酸可能起催化作用 C、苯可将反应产生的水及时带出 D、当苯即将回流烧瓶中时,必须将分水器中的水和苯放出7. CuCl是一种白色晶体,难溶于水,在潮湿的空气中易被氧化。实验室制备CuCl的反应原理为SO2+ 2CuCl2+2H2O=2CuCl ↓+H2SO4+2HCl。用下列装置进行实验,不能达到实验目的的是( )A
B
C
D




制备SO2
制备CuCl
干燥CuCl
吸收SO2尾气
A、A B、B C、C D、D8. 用[ Ru]催化硝基化合物(R1NO2)与醇(R2CH2OH)反应制备胺(R2CH2NHR1),反应过程如图所示。已知:R1、R2表示烃基或氢原子。下列叙述错误的是( ) A、[ Ru]可以降低该反应过程中的活化能 B、历程中存在反应:R1NH2+R2CHO→R2CH=NR1+H2O C、每生成1 mol R2CH2NHR1 , 消耗1 mol R2CH2OH D、制备CH3CH2NHCH3的原料可以是CH3CH2NO2和CH3OH9. 利用K2Cr2O7处理含苯酚废水的装置如下图所示,其中a为阳离子交换膜,b为阴离子交换膜。处理后的废水毒性降低且不引入其它杂质。工作一段时间后,下列说法错误的是( )
A、[ Ru]可以降低该反应过程中的活化能 B、历程中存在反应:R1NH2+R2CHO→R2CH=NR1+H2O C、每生成1 mol R2CH2NHR1 , 消耗1 mol R2CH2OH D、制备CH3CH2NHCH3的原料可以是CH3CH2NO2和CH3OH9. 利用K2Cr2O7处理含苯酚废水的装置如下图所示,其中a为阳离子交换膜,b为阴离子交换膜。处理后的废水毒性降低且不引入其它杂质。工作一段时间后,下列说法错误的是( ) A、正极区溶液的pH变大 B、每转移3 mol电子,N极室溶液质量减少51 g C、中间室NaCl的物质的量保持不变 D、M极的电极反应式:C6H5OH+11H2O-28e-=6CO2↑+28H+10. 锑白(Sb2O3)为白色粉末,不溶于水,溶于酸和强碱,主要用于制备白色颜料、油漆等。一种利用锑矿粉(主要成分为Sb2S3、SiO2)制取锑白的流程如下。
A、正极区溶液的pH变大 B、每转移3 mol电子,N极室溶液质量减少51 g C、中间室NaCl的物质的量保持不变 D、M极的电极反应式:C6H5OH+11H2O-28e-=6CO2↑+28H+10. 锑白(Sb2O3)为白色粉末,不溶于水,溶于酸和强碱,主要用于制备白色颜料、油漆等。一种利用锑矿粉(主要成分为Sb2S3、SiO2)制取锑白的流程如下。
已知:浸出液中的阳离子主要为Sb3+、Fe3+、Fe2+。
下列说法错误的是( )
A、“浸出”时发生的反应为Sb2S3+6Fe3+=2Sb3++6Fe2++3S B、可以用KSCN溶液检验“还原”反应是否完全 C、“滤液”中通入Cl2后可返回“浸出”工序循环使用 D、“中和”时可用过量的NaOH溶液代替氨水11. 根据下列实验操作和现象不能得到相应结论的是( )选项
实验操作和现象
结论
A
乙醇钠的水溶液显强碱性
C2H5O-结合H+的能力强
B
向KBrO3溶液中通入少量Cl2 , 然后再加入少量苯,有机层呈橙红色
氧化性:Cl2>Br2
C
向盛有KI3溶液的两支试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀
溶液中存在平衡: I2+I-
D
向等体积等浓度的稀硫酸中分别加入少许等物质的量的ZnS和CuS固体,ZnS溶解而CuS不溶解
Ksp(CuS)<Ksp(ZnS)
A、A B、B C、C D、D12. 一定条件下,在容积为2 L的刚性容器中充入1 mol (g) 和2 mol H2 , 发生反应
(g) 和2 mol H2 , 发生反应  (g)+2H2(g)
(g)+2H2(g)  (g) △H<0,反应过程中测得容器内压强的变化如图所示。下列说法正确的是( )
(g) △H<0,反应过程中测得容器内压强的变化如图所示。下列说法正确的是( )  A、升高温度可增大反应速率,提高环戊二烯的平衡转化率 B、0~20 min内,H2的平均反应速率为0.05 mol/(L·min) C、达到平衡时,环戊烷和环戊二烯的体积分数相同 D、该温度下平衡常数Kp=4.0 MPa-2
A、升高温度可增大反应速率,提高环戊二烯的平衡转化率 B、0~20 min内,H2的平均反应速率为0.05 mol/(L·min) C、达到平衡时,环戊烷和环戊二烯的体积分数相同 D、该温度下平衡常数Kp=4.0 MPa-2二、多选题
-
13. 内酯Y可以由X通过电解合成,并能在一定条件下转化为Z,转化路线如下图所示。



下列说法正确的是( )
A、Y的一氯代物有4种 B、X→Y的反应在电解池阳极发生 C、1 mol X最多可与7 mol H2发生加成反应 D、在一定条件下,Z可与甲醛发生反应14. 我国科学家利用电解法在常温常压下实现了氨的合成,该装置工作时阴极区的微观示意图如下,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。 下列说法正确的是( )A、三氟甲磺酸锂的作用是增强导电性 B、选择性透过膜允许N2、NH3和H2O通过 C、该装置用Au作催化剂,目的是改变N2的键能 D、生成NH3的电板反应为N2+6C2H5OH+6e-=2NH3+6C2H5O-15. 25℃时,甘氨酸在水中存在下列关系:+NH3CH2COOH +NH3CH2COO- NH2CH2COO- , 向10 mL 0.10 mol/L的+NH3CH2COOH溶液中滴加0.10 mol/L的NaOH溶液,溶液pH与所加NaOH溶液体积的关系如图所示。下列说法正确的是( )
下列说法正确的是( )A、三氟甲磺酸锂的作用是增强导电性 B、选择性透过膜允许N2、NH3和H2O通过 C、该装置用Au作催化剂,目的是改变N2的键能 D、生成NH3的电板反应为N2+6C2H5OH+6e-=2NH3+6C2H5O-15. 25℃时,甘氨酸在水中存在下列关系:+NH3CH2COOH +NH3CH2COO- NH2CH2COO- , 向10 mL 0.10 mol/L的+NH3CH2COOH溶液中滴加0.10 mol/L的NaOH溶液,溶液pH与所加NaOH溶液体积的关系如图所示。下列说法正确的是( ) A、K1的数量级为10-2 B、水的电离程度:a>b>c C、甘氨酸溶于水后显酸性 D、pH=7时,溶液中:c(+NH3CH2COO-)>c(NH2CH2COO-)>c(+NH3CH2COOH)
A、K1的数量级为10-2 B、水的电离程度:a>b>c C、甘氨酸溶于水后显酸性 D、pH=7时,溶液中:c(+NH3CH2COO-)>c(NH2CH2COO-)>c(+NH3CH2COOH)三、综合题
-
16. 工业上用钼精矿(主要成分是MoS2 , 含少量的PbS)制备钼酸钠晶体(Na2MoO4·2H2O)的流程如图所示。
 已知:“浸取”时PbO转化为Na2PbO2。
已知:“浸取”时PbO转化为Na2PbO2。回答下列问题:
(1)、“焙烧”时为了使钼精矿充分反应,可采取的措施是(答出一条即可);“焙烧”时MoS2转化为MoO3 , 该反应中氧化剂和还原剂的物质的量之比为;“浸取”时生成气体a的电子式为。(2)、“除铅”过程中发生反应的离子方程式为。(3)、①结晶前需加入Ba(OH)2固体以除去 。当BaMoO4开始沉淀时, 的去除率为87.5%,则Ksp(BaMoO4)=。 [结晶前溶液中 c( MoO )= 0.40 mol/L,c( )= 0.20 mol/L,Ksp( BaCO3)= 1×10-9 , 溶液体积变化可忽略]②结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是。
(4)、钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在不同介质中的腐蚀速率实验结果如下图。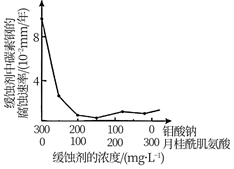
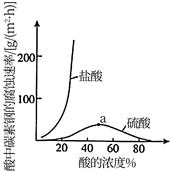
①若缓蚀剂钼酸钠-月桂酰肌氨酸的总浓度为300 mg/L,则缓蚀效果最好时钼酸钠( M=206 g/ mol)的物质的量浓度为mol/L(保留3位有效数字)。
②a点前,随着酸的浓度增大,碳素钢在盐酸中的腐蚀速率明显比在硫酸中腐蚀速率快,其原因可能是 , 请设计实验证明上述结论。
17. 氮的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。(1)、已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) △H1 =-907.0 kJ/mol4NH3(g) +3O2(g)=2N2(g)+6H2O(g) △H2=-1269.0 kJ/mol
若4NH3(g) +6NO(g) 5N2(g) +6H2O(g)的正反应活化能为E正 kJ/mol,则其逆反应活化能为kJ/mol(用含E正的代数式表示)。
(2)、在一定条件下,向某2 L密闭容器中分别投入一定量的NH3、NO发生反应:4NH3(g) +6NO(g) 5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。
①工业上应选择催化剂(填“甲”或“乙”)。
②M点是否为对应温度下NO的平衡转化率,判断理由是。温度高于210℃时,NO转化率降低的可能原因是。
(3)、已知:NO2(g) +SO2(g) NO(g)+SO3(g) △H<0.向密闭容器中充入等体积的NO2和SO2 , 测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。
①ab两点体系总压强pa与pb的比值 =;同一温度下图象呈线性变化的理由是。
②温度为T2时化学平衡常数Kp= , T1T2(填“>”、“<”或“=”)。
18. 钛(Ti)和锆(Zr)是同一副族的相邻元素,它们的化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)、钛和锆的价层电子结构相同,基态锆原子的价电子排布式为;与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有种。(2)、Ti(BH4)2是一种储氢材料。BH 的空间构型是 , H、B、Ti的电负性由小到大的顺序为。(3)、ZrCl4可以与乙二胺形成配合物[ ZrCl4( H2NCH2CH2NH2)]。①1 mol [ ZrCl4( H2NCH2CH2NH2)]中含有σ键的物质的量为mol。
②H2NCH2CH2NH2形成[ ZrCl4( H2NCH2CH2NH2)]后,H-N-H键角将(填“变大”、“变小”或“不变”),原因是。
(4)、已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。
①TiO2晶胞中O2-的配位数是。
②TiO2晶胞中A、B的原子坐标为(0.69,0.69,1),(0.19,0.81,0.5),则C、D原子坐标为、。
③已知二氧化锆晶胞的密度为ρ g·cm-3 , 则晶体中Zr原子和O原子之间的最短距离pm(列出表达式,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。
19. 氧钒(Ⅳ)碱式碳酸铵晶体难溶于水,是制备热敏材料VO2的原料,其化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O。实验室以VOCl2和NH4HCO3为原料制备氧钒( Ⅳ )碱式碳酸铵晶体的装置如图所示。
已知:+4价钒的化合物易被氧化。
回答下列问题:
(1)、装置D中盛放NH4HCO3溶液的仪器名称是;上述装置依次连接的合理顺序为e→( 按气流方向,用小写字母表示)。(2)、实验开始时,先关闭K2 , 打开K1 , 当(填实验现象)时,关闭K1 , 打开K2 , 进行实验。(3)、写出装置D中生成氧钒(Ⅳ)碱式碳酸铵晶体的化学方程式;实验完毕后,从装置D中分离产品的操作方法是 (填操作名称)。(4)、测定粗产品中钒的含量。实验步骤如下:称量a g产品于锥形瓶中,用20 mL蒸馏水与30 mL稀硫酸溶解后,加入0.02mol/LKMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2 , 最后用c mol/L (NH4)2Fe( SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知: +Fe2++2H+= VO2++Fe3++H2O)
①NaNO2溶液的作用是。
②粗产品中钒的质量分数表达式为(以VO2计)。
③若(NH4)2Fe( SO4)2标准溶液部分变质,会使测定结果 ( 填“偏高"、“偏低”或“无影响")。
20. 某抗病毒药物H的一种合成路线如图所示。
已知:①R-NH2+R'Cl R-NH-R' +HCl
②
 具有芳香性。
具有芳香性。回答下列问题:
(1)、A→B的反应类型为;D中含氧官能团的名称为。(2)、D→E的化学方程式为。(3)、F的结构简式为 , X的结构简式为。(4)、C的六元环芳香同分异构体中,核磁共振氢谱有3组峰的结构简式为(任写一种)。(5)、设计以 为原料制备
为原料制备  的合成路线(其他试剂任选) 。
的合成路线(其他试剂任选) 。