山东省济宁市2021年高考化学二模试卷
试卷更新日期:2021-07-09 类型:高考模拟
一、单选题
-
1. 化学与人类生产、生活密切相关,下列有关说法正确的是( )A、过期药品和纸箱均应投入到可回收垃圾箱内 B、石墨烯和碳纳米管互为同素异形体,均为无机非金属材料 C、“天问一号”火星探测器,其太阳能电池板的主要材料是二氧化硅 D、在三星堆“祭祀坑”提取到丝绸制品残留物,其中丝绸主要成分为纤维素2. 下列叙述不涉及氧化还原反应的是( )A、食物腐败变质 B、对电力不足的新能源汽车充电 C、用SO2漂白纸浆 D、苯酚放置在空气中变为粉红色3. 常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01mol·L-1)的pH和原子半径、原子序数的关系如图所示。下列说法错误的是( )
 A、第一电离能:W>Z>Y>X B、简单离子的半径:Y>Z>W>X C、W的氢化物空间构型不一定是三角锥形 D、Z的单质具有强氧化性和漂白性4. 下列关于物质结构与性质的论述错误的是( )A、I 离子的空间构型为V形 B、斜方硫和单斜硫都易溶于CS2 , 是因为这两种物质的分子都属于非极性分子 C、PH3和H2O分子中均含有孤电子对,且PH3提供孤电子对的能力强于H2O D、键能O—H>S—H>Se—H>Te—H,因此水的沸点在同族氢化物中最高5. 实验室制备苯甲酸乙酯,装置如图所示,原理是在环己烷中发生如下反应:C6H5COOH+C2H5OH C6H5COOC2H5+H2O。已知:环己烷沸点为80.8℃,可与水形成共沸物,其混合物沸点为62.1℃。
A、第一电离能:W>Z>Y>X B、简单离子的半径:Y>Z>W>X C、W的氢化物空间构型不一定是三角锥形 D、Z的单质具有强氧化性和漂白性4. 下列关于物质结构与性质的论述错误的是( )A、I 离子的空间构型为V形 B、斜方硫和单斜硫都易溶于CS2 , 是因为这两种物质的分子都属于非极性分子 C、PH3和H2O分子中均含有孤电子对,且PH3提供孤电子对的能力强于H2O D、键能O—H>S—H>Se—H>Te—H,因此水的沸点在同族氢化物中最高5. 实验室制备苯甲酸乙酯,装置如图所示,原理是在环己烷中发生如下反应:C6H5COOH+C2H5OH C6H5COOC2H5+H2O。已知:环己烷沸点为80.8℃,可与水形成共沸物,其混合物沸点为62.1℃。下列说法错误的是( )
 A、水浴加热具有受热均匀,便于控制温度的优点 B、加入的环己烷可提高苯甲酸乙酯产率 C、向仪器A中加药品顺序:苯甲酸、浓硫酸、无水乙醇、环己烷 D、反应后向A中的溶液加入碳酸钠以除去硫酸和剩余的苯甲酸6. 中国科学院发现CO2在核(Fe—Zn—Zr)—壳(Zeolite)催化剂内能高效氢化成异构化烷烃,反应机理如图所示。下列说法正确的是( )
A、水浴加热具有受热均匀,便于控制温度的优点 B、加入的环己烷可提高苯甲酸乙酯产率 C、向仪器A中加药品顺序:苯甲酸、浓硫酸、无水乙醇、环己烷 D、反应后向A中的溶液加入碳酸钠以除去硫酸和剩余的苯甲酸6. 中国科学院发现CO2在核(Fe—Zn—Zr)—壳(Zeolite)催化剂内能高效氢化成异构化烷烃,反应机理如图所示。下列说法正确的是( ) A、该过程中没有发生电子的转移 B、1个四氨合锌(II)—[Zn(NH3)4]2+中含12个σ键 C、示意图中含碳化合物碳原子的杂化方式均相同 D、催化剂内能高效氢化成异构化烷烃与催化剂的选择性有关7. 2021年3月报道中国科学院研究人员在抗肿瘤候选药物淫羊藿素(Icaritin)的生物合成研究中获进展,首次搭建了人工生物合成途径。其结构如图所示,下列有关Icaritin的说法错误的是( )
A、该过程中没有发生电子的转移 B、1个四氨合锌(II)—[Zn(NH3)4]2+中含12个σ键 C、示意图中含碳化合物碳原子的杂化方式均相同 D、催化剂内能高效氢化成异构化烷烃与催化剂的选择性有关7. 2021年3月报道中国科学院研究人员在抗肿瘤候选药物淫羊藿素(Icaritin)的生物合成研究中获进展,首次搭建了人工生物合成途径。其结构如图所示,下列有关Icaritin的说法错误的是( ) A、Icaritin具有显著的抗氧化活性 B、Icaritin分子中所有碳原子可能在同一平面上 C、Icaritin存在顺反异构和对映异构 D、一定条件下,1 mol Icaritin最多能与9 mol H2发生加成反应(不考虑开环)8. 以含钴废渣(主要成分CoO、Co2O3 , 还含有Al2O3、ZnO等杂质)为原料制备Co2O3的一种实验流程如下:
A、Icaritin具有显著的抗氧化活性 B、Icaritin分子中所有碳原子可能在同一平面上 C、Icaritin存在顺反异构和对映异构 D、一定条件下,1 mol Icaritin最多能与9 mol H2发生加成反应(不考虑开环)8. 以含钴废渣(主要成分CoO、Co2O3 , 还含有Al2O3、ZnO等杂质)为原料制备Co2O3的一种实验流程如下:
下列与流程相关的装置和原理能达到实验目的的是( )
 A、用装置甲制备“酸浸”所需的SO2 B、用装置乙配制“酸浸”所需的1mol·L-1H2SO4溶液 C、用装置丙过滤“沉钴”所得悬浊液 D、用装置丁灼烧CoCO3固体制Co2O39. 以硅石(SiO2)和萤石(CaF2)为原料制备冰晶石(Na3AlF6)的一种流程如图:
A、用装置甲制备“酸浸”所需的SO2 B、用装置乙配制“酸浸”所需的1mol·L-1H2SO4溶液 C、用装置丙过滤“沉钴”所得悬浊液 D、用装置丁灼烧CoCO3固体制Co2O39. 以硅石(SiO2)和萤石(CaF2)为原料制备冰晶石(Na3AlF6)的一种流程如图:
已知:无水氟硅酸(H2SiF6)为易溶于水、不稳定的强酸;滤渣2的主要成分为Na2SiF6。
下列说法错误的是( )
A、硅石和萤石需预先研磨目的是加快反应速率 B、“反应Ⅲ”应该在陶瓷器皿中进行 C、滤液1、滤液2经浓缩处理后可在流程中循环利用 D、“反应Ⅳ”的化学方程式为2NaF+4NH4F+NaAlO2+2H2O=Na3AlF6↓+4NH3·H2O10. 环氧乙烷是重要的有机合成原料,2020年《Science》报道科研人员研发了一种将乙烯高效转化为环氧乙烷的电化学合成方法。反应在KCl电解液的流动池中进行,工作原理如图。电解结束后,将阴阳极电解液输出混合,便可生成环氧乙烷。下列说法错误的是( ) A、整个过程中,氯离子浓度一直不变 B、离子交换膜应为阴离子交换膜 C、泡沫镍电极为阳极,连接电源正极 D、当生成0.5 mol环氧乙烷时,阴极区溶液质量减少36.5 g11. 根据下列实验操作和现象能得到相应结论的是( )
A、整个过程中,氯离子浓度一直不变 B、离子交换膜应为阴离子交换膜 C、泡沫镍电极为阳极,连接电源正极 D、当生成0.5 mol环氧乙烷时,阴极区溶液质量减少36.5 g11. 根据下列实验操作和现象能得到相应结论的是( )选项
实验操作和现象
结论
A
向FeCl2和KSCN的混合溶液中滴入硝酸酸化的AgNO3溶液,溶液变红
氧化性:Fe3+<Ag+
B
将蘸有浓氨水的玻璃棒靠近溶液X,有白烟产生
溶液X一定是浓盐酸
C
将电石与水反应产生的气体通入溴水,溴水褪色
生成的乙炔气体中含有H2S
D
向碘水中加入等体积CCl4 , 振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
A、A B、B C、C D、D12. 化合物Y具有保肝、抗炎、增强免疫等功效,可由X制得。下列有关化合物X、Y的说法错误的是( )
 A、一定条件下X可发生氧化、取代、加成反应 B、1molY最多能与5molNaOH反应 C、X与足量H2反应后,每个产物分子中含有7个手性碳原子 D、等物质的量的X、Y分别与足量Br2反应,最多消耗Br2的物质的量相等
A、一定条件下X可发生氧化、取代、加成反应 B、1molY最多能与5molNaOH反应 C、X与足量H2反应后,每个产物分子中含有7个手性碳原子 D、等物质的量的X、Y分别与足量Br2反应,最多消耗Br2的物质的量相等二、多选题
-
13. 可充电水系Zn—CO2电池用锌和催化剂材料作两极,电池工作示意图如图所示,其中双极膜是由阳膜和阴膜制成的复合膜,在直流电场的作用下,双极膜复合层间的H2O电离出的H+和OH-可以分别通过膜移向两极。下列说法错误的是( )
 A、放电时,右侧电极的电极反应为CO2+2H+-2e-=HCOOH B、放电时,金属锌为负极,发生氧化反应 C、充电时,双极隔膜产生的H+向右侧正极室移动 D、充电时,电池总反应为2Zn(OH) =2Zn +O2↑+4OH-+2H2O14. CO与亚硝酸甲酯(CH3ONO)在Pd催化剂作用下发生反应的机理如图所示,下列说法正确的是( )
A、放电时,右侧电极的电极反应为CO2+2H+-2e-=HCOOH B、放电时,金属锌为负极,发生氧化反应 C、充电时,双极隔膜产生的H+向右侧正极室移动 D、充电时,电池总反应为2Zn(OH) =2Zn +O2↑+4OH-+2H2O14. CO与亚硝酸甲酯(CH3ONO)在Pd催化剂作用下发生反应的机理如图所示,下列说法正确的是( ) A、脱附过程1的总反应为:2CO+2CH3ONO
A、脱附过程1的总反应为:2CO+2CH3ONO +2NO
B、CH3ONO中氮氧双键在Pd表面断裂
C、增大投料比[n(CO):n(CH3ONO)],可提高最终产物中碳酸二甲酯的比率
D、脱附过程2生成了碳酸二甲酯(
+2NO
B、CH3ONO中氮氧双键在Pd表面断裂
C、增大投料比[n(CO):n(CH3ONO)],可提高最终产物中碳酸二甲酯的比率
D、脱附过程2生成了碳酸二甲酯(  )
15. 25℃时,用HCl气体调节0.1 mol·L-1氨水的pH,系统中微粒浓度的对数值(lgc)与pH的关系如图1所示,反应物的物质的量之比[ι= ]与pH的关系如图2所示。若忽略通过气体后溶液体积的变化,下列有关说法正确的是( )
)
15. 25℃时,用HCl气体调节0.1 mol·L-1氨水的pH,系统中微粒浓度的对数值(lgc)与pH的关系如图1所示,反应物的物质的量之比[ι= ]与pH的关系如图2所示。若忽略通过气体后溶液体积的变化,下列有关说法正确的是( ) A、P1所示溶液:c(Cl-)=0.05 mol·L-1 B、P2所示溶液:c(NH3·H2O)<c(OH-)+c(Cl-) C、P3所示溶液:c( )+c(NH3·H2O)=c(Cl-)+c(H+) D、25℃时,NH3·H2O的电离平衡常数为10-4.75
A、P1所示溶液:c(Cl-)=0.05 mol·L-1 B、P2所示溶液:c(NH3·H2O)<c(OH-)+c(Cl-) C、P3所示溶液:c( )+c(NH3·H2O)=c(Cl-)+c(H+) D、25℃时,NH3·H2O的电离平衡常数为10-4.75三、综合题
-
16. 用锑砷烟灰(主要成分为Sb2O3、As2O3 , 含Pb、Ag、Cu等元素)制取焦锑酸钠[NaSb(OH)6]和砷酸钠(Na3AsO4),不仅治理了砷害污染,还可综合回收其它有价金属。其工艺流程如图所示:

已知:
①Ag、Cu、Fe的氧化物不溶于Na2S溶液
②硫浸后,锑砷以Na3SbS3、Na3AsS3存在;
③NaSb(OH)6易溶于热水,难溶于冷水,不溶于乙醇。
回答下列问题:
(1)、“硫浸”时,Sb2O3溶解的离子方程式为。(2)、用NaNO3和NaOH浸取锑砷烟灰也可得到Na3SbO4 , 其缺陷是。(3)、“氧化”时所用H2O2的电子式为 , 反应温度不宜太高的原因是。(4)、“中和”时,生成NaSb(OH)6的化学方程式为 , 操作X为、过滤、洗涤、干燥。(5)、As2O3对应的酸为H3AsO3 , 测得某工业酸性废液中含H3AsO3和Fe2+ , 其浓度如表:物质
H3AsO3
Fe2+
浓度/g·L-1
0.378
0.840
已知:Ksp(FeAsO3)>Ksp(FeAsO4)=5.70×10-21 , H3AsO3的还原性比Fe2+强。
根据题目信息,则可采用方法除去该废水中的砷,除去砷后的废液中c(AsO )=mol·L-1(不考虑反应过程中溶液体积的微小变化)
17. 氮氧化物(NOx)是一类特殊的污染物,它本身会对生态系统和人体健康造成危害,必须进行治理或综合利用。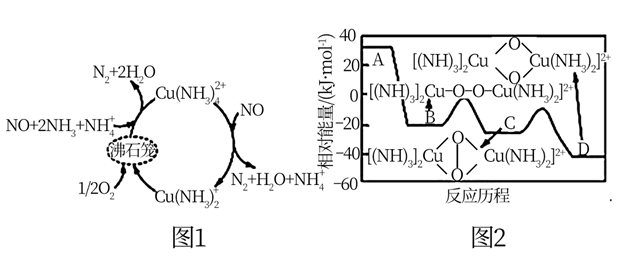 (1)、一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图1所示,A在沸石笼内转化为B、C、D等中间体的过程如图2所示。
(1)、一种以沸石笼作为载体对氮氧化物进行催化还原的原理如图1所示,A在沸石笼内转化为B、C、D等中间体的过程如图2所示。①由A到B的变化过程可表示为。
②已知:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)△H1=-907.28kJ·mol-1
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)△H2=-1269.02kJ·mol-1
则图1脱除NO的总反应的热化学方程式为。
③关于该催化剂的说法正确的是(填标号)。
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
(2)、在温度500K时,向盛有食盐的恒容密闭容器中加入NO2、NO和Cl2 , 发生如下两个反应:Ⅰ.2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g)△H1
Ⅱ.2NO(g)+Cl2(g) 2ClNO(g)△H2
①关于恒温恒容密闭容器中进行的反应Ⅰ和Ⅱ的下列说法中,正确的是(填标号)。
a.△H1和△H2不再变化,说明反应达到平衡状态
b.反应体系中混合气体的颜色保持不变,说明反应Ⅰ达到平衡状态
c.同等条件下,反应Ⅰ的速率远远大于反应Ⅱ,说明反应Ⅰ的活化能小,△H1<△H2
d.达平衡后,向反应体系中再通入一定量ClNO(g),NO2(g)和NO(g)的百分含量均减小
②若向2L恒容密闭容器中加入0.2molNO和0.1molCl2发生反应Ⅱ,起始总压为p。10分钟后达到平衡,用ClNO(g)表示平均反应速率v平(ClNO)=0.008mol·L-1·min-1。则NO的平衡转化率α= , 该反应的平衡常数Kp=(以分压表示,分压=总压×物质的量分数)。
③假设反应Ⅱ的速率方程为:v=k (1-nαt)式中:k为反应速率常数,随温度t升高而增大;α为NO平衡转化率,α′为某时刻NO转化率,n为常数。在α′=0.8时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线如图所示。

曲线上v最大值所对应温度称为该α′下反应的最适宜温度tm , t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是。
18. 硼及其化合物在材料制造、有机合成等方面用途非常广泛。回答下列问题:(1)、氨硼烷(H3NBH3)是目前最具潜力的储氢材料之一。①氨硼烷能溶于水,其原因是。
②氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是。
A.苯和三氯甲烷 B.LiH和HCN C.C2H4和C2H2 D.B2H6和NH3
③氨硼烷电池放电时的总反应为:H3NBH3+3H2O2=NH4BO2+4H2O。写出负极电极反应。
(2)、在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多硼酸根,其化学式为;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型。 (3)、硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:
(3)、硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:
①该晶体中Na+的配位数为。标注为“1”的Na+分数坐标为。
②H3BO3分子中的O—B—O的键角(填“大于”、“等于”或“小于”)BH 中的H—B—H的键角。
③已知硼氢化钠晶体的密度为ρg·cm-3 , NA代表阿伏加德罗常数的值,则a=(用含ρ、NA的代数式表示);
④若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为。
19. 化合物H常用于防治血栓栓塞性疾病,其合成路线如图所示(部分反应条件略去)。
已知:
①
 +
+ 
 (其中一种产物)
(其中一种产物)②
 +
+ 
 +R2OH
+R2OH③烯醇式(
 )结构不稳定,容易结构互变,但当有共轭体系(苯环、碳碳双键、碳氧双键等)与其相连时变得较为稳定。(1)、化合物E的名称为 , H中含氧官能团的名称是酯基、。(2)、A→B反应类型为 , 化合物D的结构简式。(3)、反应F→G的化学方程式为。(4)、写出一种满足下列条件的F的同分异构体的结构简式。
)结构不稳定,容易结构互变,但当有共轭体系(苯环、碳碳双键、碳氧双键等)与其相连时变得较为稳定。(1)、化合物E的名称为 , H中含氧官能团的名称是酯基、。(2)、A→B反应类型为 , 化合物D的结构简式。(3)、反应F→G的化学方程式为。(4)、写出一种满足下列条件的F的同分异构体的结构简式。①属于芳香族化合物,但不含甲基;
②与FeCl3溶液发生显色反应;
③1mol该有机物能与2molNaOH恰好完全反应;
④核磁共振氢谱有4组峰,且峰面积之比为2:2:1:1。
(5)、参照以上合成路线,设计一种以 和
和  为原料制备
为原料制备  的合成路线(其他无机试剂任选)。 20. 二氯异氰尿酸钠为白色固体,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂,难溶于冷水。实验室用如图所示装置制备(夹持装置已略去)。请回答下列问题:
的合成路线(其他无机试剂任选)。 20. 二氯异氰尿酸钠为白色固体,是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂,难溶于冷水。实验室用如图所示装置制备(夹持装置已略去)。请回答下列问题:
已知:实验原理为2NaClO+(CNO)3H3=(CNO)3Cl2Na+NaOH+H2O
(1)、仪器a的名称为 , 装置A中的药品为 , 装置C中的试剂为。(2)、实验发现装置B中NaOH溶液的利用率较低,改进方法是。(3)、当装置B出现现象时,打开装置B的活塞加入(CNO)3H3溶液,在反应过程中仍不断通入Cl2的目的是。实验过程中B的温度必须保持为17℃~20℃,pH值控制在6.5~8.5的范围,则该实验的受热方式是(填“冷水浴”或“热水浴”),若温度过高,pH过低,会生成NCl3 , 写出C3N3O3H3生成NCl3的化学方程式为。(4)、二氯异氰尿酸钠缓慢水解产生HClO消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的有效氯。准确称取ag样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol·L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。①该样品的有效氯测定值%。(用含a,V的代数式表示)
②下列操作会导致样品的有效氯测定值偏低的是(填标号)。
a.盛装Na2S2O3标准溶液的滴定管未润洗
b.滴定管在滴定前无气泡,滴定后有气泡
c.碘量瓶中加入的稀硫酸偏少
已知:①该样品的有效氯= ×100%
②实验检测原理为:C3N3O3Cl +2H2O=C3H3N3O3+2HClO
HClO+2I-+H+=I2+Cl-+H2O 测定中转化HCl的氯元素质量
I2+S2O =S4O +2I-