湖北省十堰市2021年高考化学4月模拟试卷
试卷更新日期:2021-07-09 类型:高考模拟
一、单选题
-
1. 化学与环境、工农业生产等密切相关,下列说法正确的是( )A、碱式氯化铝和二氧化氯均可作净水剂,且净水原理相同 B、过期药品属于有害垃圾,为防止污染环境应当深埋处理 C、推广使用煤液化技术可以减少温室气体二氧化碳的排放 D、浸有酸性高锰酸钾溶液的硅藻土可用于水果保鲜2. 在电池工业上,碳酸乙烯酯(EC)可作为锂电池电解液的优良溶剂,其结构为
 ,熔点为35℃。下列有关说法错误的是( ) A、一个分子中有10个σ键 B、EC分子间能形成氢键 C、分子中至少有4个原子共平面 D、EC由固态变成液态破坏了分子间的作用力3. NA是阿伏加德罗常数的值。下列说法正确的是( )A、12 g 14C中含有的质子数为6NA B、0.1 mol Cu与浓硝酸充分反应最终得到NO2分子的数目为0.2NA C、23 g Na在空气中点燃后充分反应,转移的电子数为NA D、100 g质量分数为30%的甲醛(HCHO)水溶液中氧原子的数目为NA4. 下列化学用语对事实的表述正确的是( )A、向CuCl2和FeCl3的混合溶液中加入少量的Fe:Cu2++Fe=Fe2++Cu B、碱性锌锰干电池的正极反应式:MnO2+H2O+e-=MnO(OH)+OH- C、向NaOH溶液中加少量AlCl3溶液:Al3++3OH-=Al(OH)3↓ D、磁性氧化铁溶于浓硝酸:3Fe3O4+28H++NO =9Fe2++NO↑+14H2O5. 我国成功研制出第一个具有自主知识产权的抗艾滋病新药——二咖啡酰奎尼酸(简称IBE—5)。IBE—5的结构简式如图所示,下列有关IBE—5的说法错误的是( )
,熔点为35℃。下列有关说法错误的是( ) A、一个分子中有10个σ键 B、EC分子间能形成氢键 C、分子中至少有4个原子共平面 D、EC由固态变成液态破坏了分子间的作用力3. NA是阿伏加德罗常数的值。下列说法正确的是( )A、12 g 14C中含有的质子数为6NA B、0.1 mol Cu与浓硝酸充分反应最终得到NO2分子的数目为0.2NA C、23 g Na在空气中点燃后充分反应,转移的电子数为NA D、100 g质量分数为30%的甲醛(HCHO)水溶液中氧原子的数目为NA4. 下列化学用语对事实的表述正确的是( )A、向CuCl2和FeCl3的混合溶液中加入少量的Fe:Cu2++Fe=Fe2++Cu B、碱性锌锰干电池的正极反应式:MnO2+H2O+e-=MnO(OH)+OH- C、向NaOH溶液中加少量AlCl3溶液:Al3++3OH-=Al(OH)3↓ D、磁性氧化铁溶于浓硝酸:3Fe3O4+28H++NO =9Fe2++NO↑+14H2O5. 我国成功研制出第一个具有自主知识产权的抗艾滋病新药——二咖啡酰奎尼酸(简称IBE—5)。IBE—5的结构简式如图所示,下列有关IBE—5的说法错误的是( ) A、苯环上的一氯代物有三种 B、可与氢气发生加成反应 C、分子中含有25个碳原子 D、1molIBE—5最多消耗7molNaOH6. 中国人民在悠久的历史中创造了绚丽多彩的中华文化,下列说法正确的是( )A、织锦是可以做礼服的高档缎类丝织物,蚕丝与棉、麻的主要成分都是纤维素 B、秦朝·兵马俑用陶土烧制而成,陶土属于合成高分子材料 C、王羲之的《兰亭集序》保存完好、字迹清晰的原因是墨的主要成分是碳,在常温下化学性质稳定 D、宋代张杲《医说》记载:“每每外出,用雄黄 桐子大,在火中烧烟熏……,以消毒灭菌,……”古代烟熏的消毒原理与酒精相同,都是利用其强氧化性7. 溴化苄是重要的有机合成工业原料,可由苯甲醇为原料合成,实验原理及装置如图所示:
A、苯环上的一氯代物有三种 B、可与氢气发生加成反应 C、分子中含有25个碳原子 D、1molIBE—5最多消耗7molNaOH6. 中国人民在悠久的历史中创造了绚丽多彩的中华文化,下列说法正确的是( )A、织锦是可以做礼服的高档缎类丝织物,蚕丝与棉、麻的主要成分都是纤维素 B、秦朝·兵马俑用陶土烧制而成,陶土属于合成高分子材料 C、王羲之的《兰亭集序》保存完好、字迹清晰的原因是墨的主要成分是碳,在常温下化学性质稳定 D、宋代张杲《医说》记载:“每每外出,用雄黄 桐子大,在火中烧烟熏……,以消毒灭菌,……”古代烟熏的消毒原理与酒精相同,都是利用其强氧化性7. 溴化苄是重要的有机合成工业原料,可由苯甲醇为原料合成,实验原理及装置如图所示:

下列有关说法错误的是( )
A、先加热至反应温度,然后从冷凝管接口b处通水 B、该实验适宜用热水浴加热 C、浓硫酸作催化剂和吸水剂 D、反应液可按下列步骤分离和纯化:静置→分液→水洗→纯碱洗→水洗→干燥→减压蒸馏8. 有机物C为合成某种抗支气管哮喘药物的中间体,C可由A在一定条件下转化得到(如图所示)。下列说法错误的是( ) A、A与B互为同分异构体 B、C的分子式为C13H12O3 C、核磁共振氢谱表明A与B均有七组峰 D、C既能发生加成反应,又能发生水解反应9. 已知元素X、Y、Z、W为原子序数依次增大的短周期主族元素,其中X与W同主族,且W的最外层电子数是其内层电子总数的一半,X和Y的原子序数之和等于W的原子序数,用 He粒子轰击Z核会产生W核和中子(即 n),可表示为 He+ Z→ W+ n。下列说法正确的是( )A、 Z与 W互为同位素 B、第一电离能:X<W C、Y和W形成的化合物不止一种 D、W的最高价氧化物对应的水化物是强酸10. 十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“ ”脱氢过程释放氢气。下列说法正确的是( )
A、A与B互为同分异构体 B、C的分子式为C13H12O3 C、核磁共振氢谱表明A与B均有七组峰 D、C既能发生加成反应,又能发生水解反应9. 已知元素X、Y、Z、W为原子序数依次增大的短周期主族元素,其中X与W同主族,且W的最外层电子数是其内层电子总数的一半,X和Y的原子序数之和等于W的原子序数,用 He粒子轰击Z核会产生W核和中子(即 n),可表示为 He+ Z→ W+ n。下列说法正确的是( )A、 Z与 W互为同位素 B、第一电离能:X<W C、Y和W形成的化合物不止一种 D、W的最高价氧化物对应的水化物是强酸10. 十氢萘(C10H18)是具有高储氢密度的氢能载体,经历“ ”脱氢过程释放氢气。下列说法正确的是( ) A、总反应的 B、C10H18(l)的脱氢过程中,不会有大量中间产物C10H12(l) C、十氢萘脱氢的总反应速率由第二步反应决定 D、选择合适的催化剂不能改变Ea1、Ea2的大小11. PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是( )A、PH3分子呈三角锥形 B、PH3分子是极性分子 C、PH3沸点低于NH3沸点,因为P-H键键能低 D、PH3分子稳定性低于NH3分子,因为N-H键键高12. 室温下进行下列实验,根据实验操作和现象,所得到的结论正确的是( )
A、总反应的 B、C10H18(l)的脱氢过程中,不会有大量中间产物C10H12(l) C、十氢萘脱氢的总反应速率由第二步反应决定 D、选择合适的催化剂不能改变Ea1、Ea2的大小11. PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是( )A、PH3分子呈三角锥形 B、PH3分子是极性分子 C、PH3沸点低于NH3沸点,因为P-H键键能低 D、PH3分子稳定性低于NH3分子,因为N-H键键高12. 室温下进行下列实验,根据实验操作和现象,所得到的结论正确的是( )选项
实验操作和现象
结论
A
乙醇钠的水溶液呈强碱性
结合 的能力强
B
将某溶液滴在 淀粉试纸上,试纸变蓝
原溶液中一定含有
C
向 和 的混合溶液中滴入硝酸酸化的 溶液,溶液变红
氧化性:
D
向盛有 一定浓度的 溶液的试管中,滴入5滴 的 溶液,产生黄色沉淀
发生了水解
A、A B、B C、C D、D13. 化工行业常用硒(Se)作催化剂,该催化剂具有反应条件温和、成本低、环境污染小、用后处理简便等优点。以铜阳极泥(主要成分为Cu2Se、Ag2Se,还含有少量Ag、Au、Pt等)为原料制备纯硒的工艺流程如图。
已知:①“净化除杂”时采用真空蒸馏的方法提纯硒(沸点为685℃);
②焙烧后,Cu、Ag均以硫酸盐形式存在, ;
③“浸出液”中溶质的饱和浓度不小于0.01 。
下列说法错误的是( )
A、“加硫酸并焙烧”时使用的硫酸应为浓硫酸 B、“水吸收”过程得到的溶液呈酸性 C、在实验室蒸馏时,需要用到直形冷凝管 D、“浸出液”中的溶质成分不可能含有Ag2SO414. 图(a)、(b)分别是二氧化碳氧化乙烷的电催化和光催化裂解。下列说法正确的是( )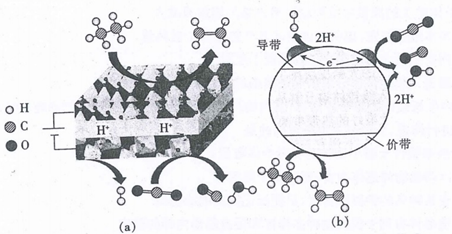 A、(a)中阴极的电极反应式为2H++2e-=H2、CO2+2H++2e-=CO+H2O B、当(a)的电路中转移2 mol电子时,阳极生成22.4 LC2H4 C、(b)中电子由导带向价带移动 D、图(a)、(b)中的电解质溶液均可能为NaOH溶液15. 保持温度始终为T℃,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速率来滴定,根据测定结果绘制出ClO-、ClO 的物质的量浓度c与时间t的关系曲线(如图)。下列说法正确的是( )
A、(a)中阴极的电极反应式为2H++2e-=H2、CO2+2H++2e-=CO+H2O B、当(a)的电路中转移2 mol电子时,阳极生成22.4 LC2H4 C、(b)中电子由导带向价带移动 D、图(a)、(b)中的电解质溶液均可能为NaOH溶液15. 保持温度始终为T℃,用滴定管量取一定体积的浓氯水置于锥形瓶中,用NaOH溶液以恒定速率来滴定,根据测定结果绘制出ClO-、ClO 的物质的量浓度c与时间t的关系曲线(如图)。下列说法正确的是( ) A、0~t1时发生反应的离子方程式:OH-+Cl2=Cl-+ClO-+H2O B、a点溶液中:c(ClO-)>c(ClO )>c(Na+)>c(OH-)>c(H+) C、b点溶液中:c(Na+)+c(H+)=8c(ClO-)+c(OH-) D、t2~t4过程中: 一直减小
A、0~t1时发生反应的离子方程式:OH-+Cl2=Cl-+ClO-+H2O B、a点溶液中:c(ClO-)>c(ClO )>c(Na+)>c(OH-)>c(H+) C、b点溶液中:c(Na+)+c(H+)=8c(ClO-)+c(OH-) D、t2~t4过程中: 一直减小二、综合题
-
16. 氯化氨基汞[Hg(NH2)Cl]是祛斑霜中常用的添加剂,某学习小组在实验室中利用如图所示装置制备Hg(NH2)Cl,回答下列问题:
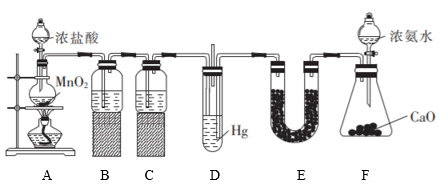 (1)、A装置中装浓盐酸的仪器名称为。(2)、B装置的作用为 , C装置中的试剂是(填名称)。(3)、实验结束后,D装置中生成了固体氯化氨基汞,请写出D装置中生成氯化氨基汞反应的化学方程式:。D装置采用长短不同的导管的原因是。(4)、E装置中装入的固体可以是__(填字母)。A、CaO B、碱石灰 C、P2O5 D、CaCl2(5)、该实验的不足之处是。(6)、样品中氯化氨基汞的含量测定:称取0.55g样品,加入水及稀硫酸溶解,向溶解后的溶液中加入0.1mol·L-1的KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知:Hg2++2I-=HgI2↓(橙红色),HgI2+2I-=HgI (无色)],共消耗80.00mLKI溶液。则样品中氯化氨基汞的质量分数为__(保留三位有效数字)。17. F是抑制白色念球菌药物的中间体,可经如图所示合成路线进行制备。
(1)、A装置中装浓盐酸的仪器名称为。(2)、B装置的作用为 , C装置中的试剂是(填名称)。(3)、实验结束后,D装置中生成了固体氯化氨基汞,请写出D装置中生成氯化氨基汞反应的化学方程式:。D装置采用长短不同的导管的原因是。(4)、E装置中装入的固体可以是__(填字母)。A、CaO B、碱石灰 C、P2O5 D、CaCl2(5)、该实验的不足之处是。(6)、样品中氯化氨基汞的含量测定:称取0.55g样品,加入水及稀硫酸溶解,向溶解后的溶液中加入0.1mol·L-1的KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知:Hg2++2I-=HgI2↓(橙红色),HgI2+2I-=HgI (无色)],共消耗80.00mLKI溶液。则样品中氯化氨基汞的质量分数为__(保留三位有效数字)。17. F是抑制白色念球菌药物的中间体,可经如图所示合成路线进行制备。
已知:—SO2Cl —SH。
回答下列问题:
(1)、A的名称为。(2)、B的结构简式为;C→D的反应类型为。(3)、一定条件下,D与水反应生成二元羧酸的化学方程式为。(4)、E中含氧官能团的名称为。(5)、反应E→F所需的试剂及反应条件分别是 , F中有个手性碳(注:连有4个不同的原子或基团的碳为手性碳)。(6)、某温度下,对A→B反应的产物成分进行研究发现,其—SO2Cl基化的不同位置的产物成分的含量如表所示:与F的相对位置
邻
间
对
其他
含量/%
38.8
3.66
57.25
0.29
请找出规律:。
(7)、G为E与1molH2完全反应后的产物,G的同分异构体中能同时满足以下条件的有种(不考虑立体异构)。Ⅰ.苯环上只有三个取代基且处于邻位,且—SH、—F直接与苯环相连;
Ⅱ.能发生银镜反应;
Ⅲ.能与NaHCO3溶液反应。
18. 工业上用合成气(主要成分为CO、H2)制备二甲醚(CH3OCH3),涉及的主要反应如下:Ⅰ.CO(g)+2H2(g) CH3OH(g)△H1=-90.8kJ·mol-1
Ⅱ.2CH3OH(g) CH3OCH3(g)+H2O(g)△H2=-23.5kJ·mol-1
(1)、2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)△H3=kJ·mol-1。(2)、若在恒温恒容的密闭容器内只发生反应Ⅱ,可判断该反应已达到平衡状态的是 (填标号)。A、气体的平均摩尔质量保持不变 B、CH3OCH3浓度与H2O浓度相等 C、CH3OCH3的体积分数保持不变 D、2v(CH3OCH3)=v(CH3OH)(3)、T℃时,将2molCO和2molH2充入一恒容密闭容器内发生反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)。起始时,容器内压强为2×106Pa,平衡时总压减少了25%,H2的转化率为 , 该反应的平衡常数Kp=Pa-4(保留2位有效数字)。达到平衡后﹐欲增加CO的平衡转化率,可采取的措施有(填标号)。A.再通入一定量的CO B.降低温度
C.及时移走CH3OCH3(g) D.通入氮气
(4)、当压强为p时,在一密闭容器中充入一定量的CO和H2 , 测得不同温度下CO的平衡转化率及催化剂的催化效率如图所示。
达到平衡后,增大压强,反应Ⅰ的平衡(填“向正反应方向”、“向逆反应方向”或“不”,下同)移动,反应Ⅱ的平衡移动,故工业上选择(填“高压”或“低压”)制备二甲醚。工业生产中不选择350℃的原因是。
19. 锆(40Zr)是现代工业中重要的金属原料,具有良好的可塑性,其抗蚀性能强于钛。以锆英石(主要成分是ZrSiO4 , 还含有少量Al2O3、SiO2、Fe2O3等杂质)为原料生产错及其化合物的流程如图所示: (1)、分馏属于(填“物理变化”或“化学变化”)。(2)、锆英石(填“能”或“不能”)直接用稀盐酸浸取后再分馏,理由是。(3)、“高温气化”中ZrSiO4发生反应得到ZrCl4的反应的化学方程式为。(4)、流程中ZrCl4与水反应后经过滤、洗涤、干燥等操作可获得ZrOCl2·8H2O,检验该物质是否洗涤干净的实验操作为。(5)、工业上使用惰性电极电解K2ZrF6与KCl组成的熔盐来制取金属错。阳极上的电极反应式为 , 每转移0.4mole- , 理论上阴极增加的质重为。(6)、极稀溶液中溶质的物质的量浓度很小,常用其负对数pc(pcB=-lgcB)表示。某温度下Ksp[Zr(CO3)2]=4.0×10-12 , 则其饱和溶液中pc(Zr4+)+pc(CO )=。(已知lg2=0.3)
(1)、分馏属于(填“物理变化”或“化学变化”)。(2)、锆英石(填“能”或“不能”)直接用稀盐酸浸取后再分馏,理由是。(3)、“高温气化”中ZrSiO4发生反应得到ZrCl4的反应的化学方程式为。(4)、流程中ZrCl4与水反应后经过滤、洗涤、干燥等操作可获得ZrOCl2·8H2O,检验该物质是否洗涤干净的实验操作为。(5)、工业上使用惰性电极电解K2ZrF6与KCl组成的熔盐来制取金属错。阳极上的电极反应式为 , 每转移0.4mole- , 理论上阴极增加的质重为。(6)、极稀溶液中溶质的物质的量浓度很小,常用其负对数pc(pcB=-lgcB)表示。某温度下Ksp[Zr(CO3)2]=4.0×10-12 , 则其饱和溶液中pc(Zr4+)+pc(CO )=。(已知lg2=0.3)