辽宁省沈阳市2021年中考化学试卷
试卷更新日期:2021-07-09 类型:中考真卷
一、单选题
-
1. 逻辑推理是一种重要的化学思维方法。下列推理合理的是( )A、因为碱溶液呈碱性,所以显碱性的溶液一定都是碱的溶液 B、混合物中至少含有两种物质,则混合物中至少含有两种元素 C、溶液是均一、稳定的,所以均一、稳定的物质一定是溶液 D、物质在发生化学变化时,原子的种类不变,则元素的种类也不会改变2. 下列富含糖类的食品是( )
 A、①③ B、①④ C、②④ D、①②3. 关于水的净化的知识,说法正确的是( )A、采用过滤的方法,可以将硬水转变成软水 B、可以往自来水中加入胆矾作为絮凝剂 C、用过滤的方法可以从食盐水中获得食盐 D、滤纸要紧贴漏斗的内壁,是为了防止过滤时液体流速过慢4. 下列用途中,主要是由物质的化学性质决定的是( )A、用铜丝作导线 B、用干冰作制冷剂 C、用氢气作燃料 D、用金刚石裁玻璃5. 有关燃烧与灭火说法正确的是( )A、可燃物与氧气接触就会燃烧 B、隔绝氧气可以灭火 C、水灭火的原理是降低可燃物着火点 D、温度达可燃物着火点就能燃烧6. 胡萝卜中富含的维生素A1具有预防夜盲症、抗衰老和促进骨髓生长等功效,其化学式为 C20H30O 。下列说法正确的是( )A、维生素A1的相对分子质量为286 g B、维生素A1分子是由碳元素,氢元素和氧元素组成 C、维生素A1中碳元素的质量分数最大 D、维生素A1中碳元素、氢元素、氧元素的质量比为20:30:17. 硫酸氢钠是一种酸式盐,其水溶液显酸性。它的固体与过氧化钠粉末加热时发生如下反应: ,则X的化学式为( )A、 B、 C、Na D、NaOH8. 下列物质的性质与用途的对应关系错误的是( )A、苏打可与盐酸反应,可用于治疗胃酸过多症 B、活性炭疏松多孔可用于吸附水中杂质 C、氮气的化学性质不活泼可作焊接金属的保护气 D、浓硫酸具有强吸水性,可用作干燥剂9. 下列实验方法错误的是( )A、用肥皂水区分硬水和软水 B、实验室用双氧水制氧气,用MnO2作催化剂 C、用燃着的木条鉴别O2、CO2和空气三瓶无色气体 D、将5克NaCl倒入50mL水中溶解,配得50克10%的NaCl溶液10. 下列各组离子中,能在 的溶液中大量共存的是( )A、 、 、 、 B、 、 、 、 C、 、 、 、 D、 、 、 、11. 有一固体物质(不含结晶水)的溶液甲,在一定温度下,经历如下变化:
A、①③ B、①④ C、②④ D、①②3. 关于水的净化的知识,说法正确的是( )A、采用过滤的方法,可以将硬水转变成软水 B、可以往自来水中加入胆矾作为絮凝剂 C、用过滤的方法可以从食盐水中获得食盐 D、滤纸要紧贴漏斗的内壁,是为了防止过滤时液体流速过慢4. 下列用途中,主要是由物质的化学性质决定的是( )A、用铜丝作导线 B、用干冰作制冷剂 C、用氢气作燃料 D、用金刚石裁玻璃5. 有关燃烧与灭火说法正确的是( )A、可燃物与氧气接触就会燃烧 B、隔绝氧气可以灭火 C、水灭火的原理是降低可燃物着火点 D、温度达可燃物着火点就能燃烧6. 胡萝卜中富含的维生素A1具有预防夜盲症、抗衰老和促进骨髓生长等功效,其化学式为 C20H30O 。下列说法正确的是( )A、维生素A1的相对分子质量为286 g B、维生素A1分子是由碳元素,氢元素和氧元素组成 C、维生素A1中碳元素的质量分数最大 D、维生素A1中碳元素、氢元素、氧元素的质量比为20:30:17. 硫酸氢钠是一种酸式盐,其水溶液显酸性。它的固体与过氧化钠粉末加热时发生如下反应: ,则X的化学式为( )A、 B、 C、Na D、NaOH8. 下列物质的性质与用途的对应关系错误的是( )A、苏打可与盐酸反应,可用于治疗胃酸过多症 B、活性炭疏松多孔可用于吸附水中杂质 C、氮气的化学性质不活泼可作焊接金属的保护气 D、浓硫酸具有强吸水性,可用作干燥剂9. 下列实验方法错误的是( )A、用肥皂水区分硬水和软水 B、实验室用双氧水制氧气,用MnO2作催化剂 C、用燃着的木条鉴别O2、CO2和空气三瓶无色气体 D、将5克NaCl倒入50mL水中溶解,配得50克10%的NaCl溶液10. 下列各组离子中,能在 的溶液中大量共存的是( )A、 、 、 、 B、 、 、 、 C、 、 、 、 D、 、 、 、11. 有一固体物质(不含结晶水)的溶液甲,在一定温度下,经历如下变化:溶液甲 溶液乙 溶液丙
据此判断下列结论中正确的是( )
A、该温度下,固体物质的溶解度是 30g/100g 水 B、溶液丙再蒸发 10g 水,析出晶体的质量一定大于 3g C、溶液乙一定是不饱和溶液 D、溶液乙和溶液丙的溶质质量分数可能相等12. 下列由事实得出的结论正确的是( )编号
事实
结论
A
某气体不能使带火星木条复燃
该气体一定不含氧气
B
某物质可以导电
该物质一定是金属单质
C
某元素原子的质子数为6
该原子核外电子数也一定为6
D
某物质完全燃烧,生成物只有CO2和H2O
该物质一定由C、H、O三种元素组成
A、A B、B C、C D、D13. 下列是火柴头中含有的四种物质,火柴点燃时会生成刺激性气味的气体,已知这种气体会污染空气,生成这种有害物质的是( )A、二氧化锰 B、氯酸钾 C、红磷 D、硫二、填空题
-
14. 2019年诺贝尔化学奖授予三位科学家,因他们研制出锂电池。
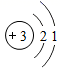
 (1)、“无‘锂’不走天下”,锂电池改变了我们的生活。下列说法正确的是______(填序号)。A、锂离子的相对原子质量是 B、锂原子核外电子数为3 C、锂离子电池放电时,电能转化成化学能(2)、锂被誉“21世纪的能源金属”,是世界上最轻的金属。在化学反应中容易(填“得到”或“失去”)电子,锂离子化学符号为。(3)、锂是一种比铁活泼的金属。锂与稀硫酸反应的化学方程式为 , 化学基本反应类型为反应。(4)、高性能锂空气电池的反应原理: ,二氧化锰是反应中的(填“反应物”、“生成物”或“催化剂”)。(5)、扬州纯电动公交车使用磷酸亚铁锂(LiFePO4)电池,磷酸亚铁锂中非金属元素的原子个数比为 , 锂、铁元素的质量比为 , 铁元素的质量分数为(精确到0.1%)。(6)、储氢材料也会用到锂,氢化锂(LiH)可用于储存氢气,氢化锂与水反应生成氢氧化锂(LiOH)和一种可燃性气体,该反应的化学反应方程式为。15. 合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下:
(1)、“无‘锂’不走天下”,锂电池改变了我们的生活。下列说法正确的是______(填序号)。A、锂离子的相对原子质量是 B、锂原子核外电子数为3 C、锂离子电池放电时,电能转化成化学能(2)、锂被誉“21世纪的能源金属”,是世界上最轻的金属。在化学反应中容易(填“得到”或“失去”)电子,锂离子化学符号为。(3)、锂是一种比铁活泼的金属。锂与稀硫酸反应的化学方程式为 , 化学基本反应类型为反应。(4)、高性能锂空气电池的反应原理: ,二氧化锰是反应中的(填“反应物”、“生成物”或“催化剂”)。(5)、扬州纯电动公交车使用磷酸亚铁锂(LiFePO4)电池,磷酸亚铁锂中非金属元素的原子个数比为 , 锂、铁元素的质量比为 , 铁元素的质量分数为(精确到0.1%)。(6)、储氢材料也会用到锂,氢化锂(LiH)可用于储存氢气,氢化锂与水反应生成氢氧化锂(LiOH)和一种可燃性气体,该反应的化学反应方程式为。15. 合成氨是人类科学技术上的一项重大突破,对社会发展与科技进步做出了巨大贡献。合成氨工艺的主要流程如下: (1)、合成塔中的反应在高温、高压、催化剂条件下进行,其化学方程式是。(2)、上述反应中,一定发生改变的是_____(填字母序号)。A、元素种类 B、分子种类 C、原子种类(3)、生产过程中可循环使用的物质是。(4)、根据表中的数据回答问题。
(1)、合成塔中的反应在高温、高压、催化剂条件下进行,其化学方程式是。(2)、上述反应中,一定发生改变的是_____(填字母序号)。A、元素种类 B、分子种类 C、原子种类(3)、生产过程中可循环使用的物质是。(4)、根据表中的数据回答问题。物质
H2
N2
NH3
沸点/℃(1.01×105 Pa)
–252
–195.8
–33.35
在1.01×105 Pa时,要将工业合成氨的产物氨气(NH3)从它的反应物氮气和氢气的混合物中分离开来,最适宜的温度应该控制在℃≤ T <℃。
16. 金属用途广泛,其结构和性质等是化学的重要研究内容。 (1)、如图1是铝的原子结构示意图。下列说法错误的是______。A、铝原子的质子数为13 B、在化合物中铝通常显 价 C、铝是地壳中含量最多的元素 D、铝可作导线是由于它具有良好的导电性(2)、向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉并充分反应,过滤得滤渣和滤液。
(1)、如图1是铝的原子结构示意图。下列说法错误的是______。A、铝原子的质子数为13 B、在化合物中铝通常显 价 C、铝是地壳中含量最多的元素 D、铝可作导线是由于它具有良好的导电性(2)、向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉并充分反应,过滤得滤渣和滤液。①加入一定量的锌粉后,一定发生的反应的化学方程式为。
②往滤渣中加盐酸,发现有气泡产生,则反应后滤渣中一定有的是 , 滤液中一定含有的溶质是 , 一定不含有的溶质是。
(3)、如图2是工业炼铁示意图。其中,焦炭的作用是燃烧提供能量和;有铁生成的化学方程式为。三、综合题
-
17. 某学校化学学习小组设计出下图所示装置,并进行白磷燃烧实验。
 (1)、当烧杯内的水受热,温度计显示30℃时,打开活塞,盛有水的试管中有气泡均匀逸出,白磷未燃烧,关闭活塞。白磷未燃烧的原因是 , 锥形瓶内反应的化学方程式是。(2)、随着水温升高,温度计显示45℃时,再次打开活塞,白磷在水里燃烧。常言道,水火不相容,水能灭火的原因是 , 而本实验中白磷在水里还能够燃烧的原因是。(3)、本实验装置的A部分还可以用于制取的气体是 , 化学方程式是 。(4)、油类物质燃烧不能用水灭火,原因是油比水轻,油会浮在水面上,用水灭火还会增大油与的接触面积,使燃烧更旺。18. 某同学在实验室里用高锰酸钾和二氧化锰加热制取氧气,实验结束时发现大试管已破裂,请你帮他分析造成试管破裂的可能原因.(写出三条即可)19. 加热碳酸氢铵时闻到了刺激性气味,引起了同学们对氨气的兴趣,决定对其进行探究。(1)、(一)探究性质与变化
(1)、当烧杯内的水受热,温度计显示30℃时,打开活塞,盛有水的试管中有气泡均匀逸出,白磷未燃烧,关闭活塞。白磷未燃烧的原因是 , 锥形瓶内反应的化学方程式是。(2)、随着水温升高,温度计显示45℃时,再次打开活塞,白磷在水里燃烧。常言道,水火不相容,水能灭火的原因是 , 而本实验中白磷在水里还能够燃烧的原因是。(3)、本实验装置的A部分还可以用于制取的气体是 , 化学方程式是 。(4)、油类物质燃烧不能用水灭火,原因是油比水轻,油会浮在水面上,用水灭火还会增大油与的接触面积,使燃烧更旺。18. 某同学在实验室里用高锰酸钾和二氧化锰加热制取氧气,实验结束时发现大试管已破裂,请你帮他分析造成试管破裂的可能原因.(写出三条即可)19. 加热碳酸氢铵时闻到了刺激性气味,引起了同学们对氨气的兴趣,决定对其进行探究。(1)、(一)探究性质与变化(实验方案)如图所示
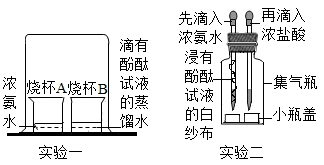
(实验现象)
实验一中的现象是。
(2)、实验二中先滴入浓氨水,一段时间后,再滴入浓盐酸。滴入浓盐酸后观察到的现象是:①集气瓶中从下至上出现白烟,②(写一点)。(3)、(实验结论)微观上,说明微粒具有的性质是。宏观上,从物质的性质或变化的角度分析,你得出的结论是(写一点)。
(4)、(反思与评价)实验二避免了实验一的不足,改进后的优点有(写一点)。
(5)、(二)验证氨气中氮、氢两种元素的质量比(查阅资料)
氨气在加热条件下能与氧化铜反应:2NH3+3CuO 3X+N2+3H2O,X的化学式是。
(6)、(设计方案)如图所示:(假定氮气被完全吸收)
(数据处理与误差分析)
充分反应后,测得A、B、C三个装置在反应前后的质量变化如下表所示
装置
A
B
C
数据
减少了4.8g
增加了6.0g
增加了2.8g
甲同学利用A、B、C三组装置所提供的数据,乙同学利用B、C两组装置所提供的数据,计算出的氮、氢元素的质量比都与理论值明显不符,分析产生误差的原因是。
(7)、若用A、C两组装置所提供的数据计算,与理论值是否相符?写出简单的计算过程证明你的结论。(8)、(三)探究用途与制法在一定条件下,可用氮气和氢气制得氨气。工业上常用氨气生产氮肥(NH4)2SO4 , 施肥时,要避免与之混用的是_____(填序号)。
A、硝酸钾 B、草木灰(主要成分是K2CO3) C、熟石灰 D、氯化钾(9)、工业上生产的(NH4)2SO4中常常混有少量KCl,检验其是否含有KCl的操作方法是。