高中化学人教版(2019)必修第一册第三章第一节铁及其化合物
试卷更新日期:2021-07-07 类型:同步测试
一、单选题
-
1. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
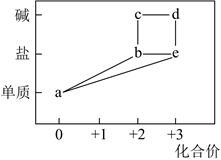
A、 可与 反应生成 B、 既可被氧化,也可被还原 C、可将 加入浓碱液中制得 的胶体 D、可存在 的循环转化关系2. 下列关于“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]的说法不.正.确.的是( )A、具有较强的还原性,可使高锰酸钾酸性溶液褪色 B、可用于治疗缺铁性贫血,还可用于制造红色颜料铁红(Fe2O3)、磁性氧化铁(Fe3O4)等 C、加水溶解,再滴加 KSCN 溶液,若溶液变红色,说明摩尔盐已氧化变质 D、加水溶解,与过量 NaOH 溶液反应的离子方程式:Fe2++2OH−=Fe(OH)2↓3. 金属铁在一定条件下与下列物质作用时只能变为+2 价铁的是( )A、FeCl3 B、HNO3 C、Cl2 D、O24. 在铁粉与水蒸气反应后的残留固体X中,加入足量的稀硫酸,充分反应后得到溶液Y。下列说法正确的是( )A、若X中含有铁,则反应时一定有气泡 B、若向Y中滴入KSCN溶液显红色,则X中无铁 C、Y一定能使高锰酸钾溶液褪色 D、Y中滴入NaOH溶液,一定有沉淀产生5. 某化学兴趣小组在学习铁及其化合物知识时,做了如下探究实验: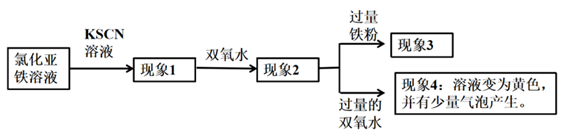
下列说法错误的是( )
A、若现象1有淡红色,说明有少量的Fe2+被氧化了 B、现象2有血红色沉淀 C、现象3为血红色褪去,说明发生了反应:2Fe3++Fe =3Fe2+ D、由现象4可推测加入过量的双氧水后硫氰根离子可能被氧化生成了气体6. 类推的思维方法在化学学习与研究中有时会产生不符合题意结论,因此类推的结论最终要经过实践的检验,才能决定其符合题意与否。下列几种类推结论中,错误的是( )①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③化合物KCl的焰色为紫色;K2CO3的焰色也为紫色
④CO2与Na2O2反应放出氧气,所以SO2与Na2O2反应也可以放出氧气
A、①② B、①④ C、①②③④ D、①②④7. 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3 , 向其中逐渐加入铁粉,溶液中的Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示。则原溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )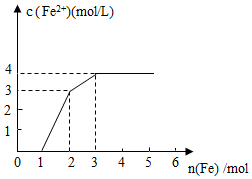 A、1∶1∶4 B、1∶4∶1 C、4∶1∶1 D、1∶1∶18. 化学社的同学查阅资料发现,工业上曾经通过反应“3Fe+4NaOH Fe3O4↑+2H2↑+4Na”生产金属钠。下列说法正确的是( )A、还原产物是钠Na和 B、用磁铁可以将Fe与 分离 C、将生成的气体在空气中冷却可获得钠 D、每生成1molH2 , 该反应转移的电子数约为9. 某同学用KSCN溶液和FeCl2溶液探究Fe2+的还原性时出现异常现象,实验如下:
A、1∶1∶4 B、1∶4∶1 C、4∶1∶1 D、1∶1∶18. 化学社的同学查阅资料发现,工业上曾经通过反应“3Fe+4NaOH Fe3O4↑+2H2↑+4Na”生产金属钠。下列说法正确的是( )A、还原产物是钠Na和 B、用磁铁可以将Fe与 分离 C、将生成的气体在空气中冷却可获得钠 D、每生成1molH2 , 该反应转移的电子数约为9. 某同学用KSCN溶液和FeCl2溶液探究Fe2+的还原性时出现异常现象,实验如下:①
②
③



溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀
溶液变红且不褪色,有气体生成(经检验为O2),经检验有丁达尔效应。
溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,经检验无丁达尔效应。
下列说法错误的是( )
A、②中红色溶液中含有Fe(OH)3胶体 B、实验②中发生的氧化还原反应只有两种 C、对比①②③,可以判定酸性条件下H2O2可以氧化SCN- D、③中发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O10. A为常见的金属单质,根据下图所示的关系:
下列叙述中错误的是( )
A、A为Fe,B为Fe3O4 B、C→D溶液的颜色变化:由浅绿色到黄色 C、④的离子方程式:Fe+Fe3+=2Fe2+ D、⑧的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)311. 某黑色粉末可能含有FeO、CuO、Fe、C中的三种或三种以上,根据下列实验事实得出的结论正确的是( )A、取少量固体加入浓硫酸并加热,固体完全溶解,说明原固体中一定没有C B、取5.0g固体在氧气流中充分灼烧,灼烧后固体仍为5.0g,说明原固体中一定含有C C、取少量固体加入足量稀硝酸后,滴入KSCN,溶液变红,说明原固体中一定含有FeO D、称取一定量固体加入足量稀硫酸,充分反应,收集到224mL(标准状况)气体,过滤,所得滤渣经干燥后称得质量为0.64g,原固体中一定含有Fe和CuO且n(Fe) ∶n(CuO) =2∶1二、多选题
-
12. 工业上用亚铬酸亚铁[Fe(CrO2)2 ]制备K2Cr2O7晶体的部分工艺流程如下所示:

已知:4Fe(CrO2)2+10Na2CO3 +7O2 8Na2CrO4+4NaFeO2+10CO2
2H++2 = +H2O
下列说法正确的是( )
A、“高温氧化”过程中只有Cr元素被氧化 B、“酸化”的主要目的是使Na2CrO4转变为Na2Cr2O7 C、“滤渣”的主要成分是Na2SO4和Na2CO3 D、生成K2Cr2O7的化学方程式是:Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl13. 往CuO和铁粉的混合物中,加入一定量的稀H2SO4 , 并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,片刻后,取出铁钉,发现铁钉并无任何变化.根据上述现象,确定下面说法中正确的是( )A、不溶物一定是铜 B、不溶物一定是铁 C、不溶物中一定含铜,但不一定含铁 D、滤液中一定含有FeSO4 , 一定没有CuSO4三、填空题
-
14. FeSO4·7H2O晶体在空气中易被氧化,为检验其是否已被氧化,可取少量样品溶于适量水后加入(填化学式)溶液检验;如已氧化,可向其中加入过量以除去其中的Fe3+ 。
四、实验探究题
-
15. 某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1 mol·L-1 FeCl3溶液,0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。(1)、用所给试剂写出体现Fe2+具有还原性的反应的化学方程式。(2)、设计实验方案,完成下列表格。
探究内容
实验方案
实验现象
探究Fe3+具有氧化性
取少量0.1 mol·L-1 FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液
加入铁粉后,溶液颜色变为浅绿色。加入KSCN溶液后,溶液
(3)、该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为。(4)、某反应中反应物与生成物有Fe3+、Mn2+、H+、MnO 、H2O和一种未知离子X,已知MnO 在反应中得到电子,则X离子是。16. 铁及其化合物用途非常广泛。回答下列问题:(1)、I.绿矾(FeSO4·7H2O)用于治疗缺铁性贫血。课外小组的同学欲测定某补血剂中铁元素的含量。实验步骤如下:
证明步骤①滤液中含有Fe2+的方法是。
(2)、步骤②加入过量H2O2的目的是 , 该步骤中H2O2还可替换为(填字母)。A.N2 B.O2 C.Cu D.H2
(3)、若实验中铁无损耗,则每片补血剂中含铁元素的质量为g。(4)、II.高铁酸钠(Na2FeO4)用作新型净水剂等。Na2FeO4主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5X,则X的化学式为 , 该反应中氧化剂为。
(5)、Na2FeO4在水中可以发生如下反应:4FeO +10H2O=4Fe(OH)3(胶体)+8OH-+3O2↑。鉴别有胶体产生的方法为。五、综合题
-
17. 电子工业中,常用FeCl3溶液腐蚀覆在绝缘板上的铜箔制造印刷电路板。化学实验小组从腐蚀废液(含FeCl3、FeCl2、CuCl2)中回收铜并重新获得FeCl3晶体的流程如下:

回答下列问题:
(1)、检验腐蚀废液中含有Fe3+常用的试剂是。(2)、滤渣的成分是(填化学式)。从滤渣中获得铜单质,可选用的试剂是(填标号)。A.稀盐酸
B.浓硫酸
C.稀硝酸
D.氯化铜溶液
(3)、向溶液a中通入Cl2发生反应的离子方程式为。有同学建议,使用H2O2代替Cl2以减少污染,则反应中氧化剂与还原剂的物质的量之比为。
(4)、甲同学用酸性KMnO4溶液检验溶液b中是否含有Fe2+。乙同学认为甲的方案不正确,理由是(用离子方程式表示)。18. 铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。(1)、铁元素有三种常见的氧化物,分别是 FeO、Fe2O3、Fe3O4.其中具有磁性的是 , 可作为红色颜料的是。(2)、某补铁口服液中含有 Fe2+ , 为检验其是否被氧化变质,可取少量该口服液,向其中滴加 KSCN 溶液,若溶液变为色,则说明其已变质。向该口服液中加入维生素 C 可防止其被氧化变质,此过程中利用了维生素 C 的性。(3)、FeCl3可作为铜电路板的腐蚀液,其反应原理为Cu与FeCl3溶液反应生成FeCl2和CuCl2 , 该反应的化学方程式为。19.(1)、向Fe(OH)3胶体中逐滴加入氢碘酸。现象:
离子方程式:
(2)、将Cl2通入NaOH溶液,充分反应后测得溶液中ClO-与ClO 个数比为3:1,则被氧化与被还原的氯元素质量比为;离子方程式为。(3)、H2与Cl2混合点燃,充分反应后,将气体通入含有40gNaOH的溶液中恰好完全反应,则混合气体中Cl2质量为。(4)、向FeBr2溶液中通入一定量的Cl2 , 充分反应后,测得游离态的溴元素和化合态的溴元素质量比为1:1,写出反应的离子方程式。六、推断题
-
20. 图中所涉及的物质均为中学化学中的常见物质,其中D为黄绿色气体,E为Fe,除D、E、C外其余为化合物。它们存在如图转化关系,反应中生成的水及次要产物均已略去。
 (1)、写出有关物质的化学式:B , F , H。(2)、指出MnO2在相关反应中的作用:反应①中是剂,反应②中是剂。(3)、若反应①是在加热条件下进行,则A的化学式是;若反应①是在常温条件下进行,则A的化学式是。(4)、写出B与MnO2共热获得D的化学方程式。(5)、写出F与B反应的化学方程式。(6)、检验H溶液中阳离子的试剂为。21. 已知A,B,C,D,E是化学中常见的物质。常温下,E是一种无色无味的液体,它们之间有如下反应关系。
(1)、写出有关物质的化学式:B , F , H。(2)、指出MnO2在相关反应中的作用:反应①中是剂,反应②中是剂。(3)、若反应①是在加热条件下进行,则A的化学式是;若反应①是在常温条件下进行,则A的化学式是。(4)、写出B与MnO2共热获得D的化学方程式。(5)、写出F与B反应的化学方程式。(6)、检验H溶液中阳离子的试剂为。21. 已知A,B,C,D,E是化学中常见的物质。常温下,E是一种无色无味的液体,它们之间有如下反应关系。 (1)、若A是一种具有磁性的黑色金属氧化物,B是一种常见的非氧化性酸,A和B反应的离子方程式为;若在生成物C中继续滴加氢氧化钠溶液,会观察到生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色,写出白色沉淀发生化学反应的方程式。A与CO高温下反应可得到金属单质,写出该金属单质与水蒸气反应的化学方程式。(2)、若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式。
(1)、若A是一种具有磁性的黑色金属氧化物,B是一种常见的非氧化性酸,A和B反应的离子方程式为;若在生成物C中继续滴加氢氧化钠溶液,会观察到生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色,写出白色沉淀发生化学反应的方程式。A与CO高温下反应可得到金属单质,写出该金属单质与水蒸气反应的化学方程式。(2)、若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式。
-