高中化学人教版(2019)必修第一册第二章第二节 氯及其化合物
试卷更新日期:2021-07-07 类型:同步测试
一、单选题
-
1. 新知识学习后及时梳理总结反思是一种有效的学习方法.下列梳理总结不合理的是( )A、汤姆生发现原子中存在电子,提出了被称为“葡萄干面包式”的原子结构模型 B、用一束光照射氢氧化铁胶体,可观察到丁达尔现象 C、 在 中剧烈燃烧,发出蓝绿色火焰,冒白烟 D、自然界中的镁主要以化合态存在于地壳和海水中2. 有关漂粉精,下列表达正确的是( )A、成分中只含有次氯酸钙 B、有效成分是次氯酸钙 C、暴露在空气中能长期保存 D、溶于水有强酸性3. 将Cl2通入自来水中杀菌消毒,主要是利用了Cl2和H2O反应生成的HClO的( )A、氧化性 B、酸性 C、还原性 D、稳定性4. 新制氯水的叙述错误的是( )A、含 ,呈黄绿色 B、逸出 ,有刺激性气味 C、光照时,放出氧气 D、含大量 ,有强氧化性5. 将新制氯水加入下列溶液中,得到无色溶液的是( )A、AgNO3溶液 B、FeCl2溶液 C、NaBr溶液 D、石蕊试液6. 为探究新制氯水的性质,某学生做了如下实验。其中涉及离子反应方程式书写正确的是( )
实验
装置
试剂X
现象
①

滴有酚酞的NaOH溶液
溶液红色褪色
②
NaHCO3溶液
产生气泡
③
HNO3酸化的AgNO3溶液
产生白色沉淀
④
FeCl2溶液、KSCN溶液
溶液变红
A、实验①:Cl2+2NaOH=Cl-+ClO-+2Na++H2O B、实验②: +HClO=ClO-+CO2↑+H2O C、实验③:ClO-+Ag++H2O=AgCl↓+2OH- D、实验④:Cl2+2Fe2+=2Fe3++2Cl-7. 如图装置用来检验氯气的部分性质,下列说法错误的是( ) A、装置A的作用是除去氯气中的水蒸汽 B、该实验必须在通风橱中进行 C、装置C中发生反应为Cl2+2NaOH=NaCl+NaClO+H2O D、装置B的现象是干燥处布条褪色,湿润处布条不褪色8. 某同学用以下装置制备并检验 Cl2的性质。下列说法正确的是( )
A、装置A的作用是除去氯气中的水蒸汽 B、该实验必须在通风橱中进行 C、装置C中发生反应为Cl2+2NaOH=NaCl+NaClO+H2O D、装置B的现象是干燥处布条褪色,湿润处布条不褪色8. 某同学用以下装置制备并检验 Cl2的性质。下列说法正确的是( ) A、Ⅰ图:若 MnO2 过量,则浓盐酸可全部消耗完 B、Ⅱ图:证明新制氯水具有酸性和漂白性 C、Ⅲ图:产生了棕黄色的雾 D、Ⅳ图:日光照射烧瓶中的饱和氯水会有气泡产生,这是由于氯气光照条件下溶解度下降而逸出9. 某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是( )
A、Ⅰ图:若 MnO2 过量,则浓盐酸可全部消耗完 B、Ⅱ图:证明新制氯水具有酸性和漂白性 C、Ⅲ图:产生了棕黄色的雾 D、Ⅳ图:日光照射烧瓶中的饱和氯水会有气泡产生,这是由于氯气光照条件下溶解度下降而逸出9. 某学习小组拟用手持技术对新制饱和氯水进行检测,下列图像变化最有可能是其检测结果的是( )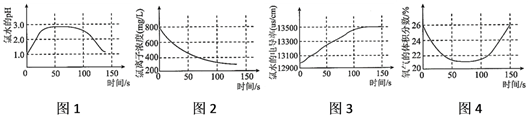 A、图1表示氯水pH随时间的变化 B、图2表示溶液中氯离子浓度随时间的变化 C、图3表示氯水的电导率随时间的变化 D、图4表示液面上方氧气体积分数随时间的变化10. 下列说法正确的是( )A、氯水具有杀菌、漂白作用是因为Cl2具有强氧化性 B、氯气能与碱反应,所以工业上用氯气和石灰水反应制备漂白粉 C、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- D、往饱和碳酸钠溶液中通入CO2气体,无明显现象11. 某化学教师为“氯气与金属钠反应”设计了如图装置的实验,实验操作,先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
A、图1表示氯水pH随时间的变化 B、图2表示溶液中氯离子浓度随时间的变化 C、图3表示氯水的电导率随时间的变化 D、图4表示液面上方氧气体积分数随时间的变化10. 下列说法正确的是( )A、氯水具有杀菌、漂白作用是因为Cl2具有强氧化性 B、氯气能与碱反应,所以工业上用氯气和石灰水反应制备漂白粉 C、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- D、往饱和碳酸钠溶液中通入CO2气体,无明显现象11. 某化学教师为“氯气与金属钠反应”设计了如图装置的实验,实验操作,先给钠预热,等钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( ) A、反应生成的大量白烟是氯化钠晶体 B、玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 C、钠熔点高,所以先预热再反应 D、若在棉球外沿滴一滴石蕊溶液,可据其颜色变化判断氯气是否被碱液完全吸收12. 如图所示:若关闭I阀,打开II阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭II阀,打开I阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( )
A、反应生成的大量白烟是氯化钠晶体 B、玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 C、钠熔点高,所以先预热再反应 D、若在棉球外沿滴一滴石蕊溶液,可据其颜色变化判断氯气是否被碱液完全吸收12. 如图所示:若关闭I阀,打开II阀,让一种含有氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭II阀,打开I阀,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( )①浓H2SO4②NaOH溶液③饱和NaCl溶液
 A、①② B、②③ C、①③ D、①②③13. 观察氯水或向下列溶液中分别滴加氯水,由此观察的现象与得出的结论不匹配的是( )
A、①② B、②③ C、①③ D、①②③13. 观察氯水或向下列溶液中分别滴加氯水,由此观察的现象与得出的结论不匹配的是( )选项
溶液
实验现象
结论
A
观察氯水
溶液呈浅黄绿色且有刺激性气味
氯水中有Cl2
B
NaHCO3溶液
产生能使澄清
石灰水变浑浊的气体
氯水中含有H+
C
HNO3酸化的AgNO3溶液
产生白色沉淀
氯水中含有Cl-
D
紫色石蕊溶液
先变红后褪色
Cl2具有酸性和漂白性
A、A B、B C、C D、D14. 类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )已知
类推
A
将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+
将Na加入CuSO4溶液中:2Na+Cu2+=Cu+2Na+
B
稀硫酸与Ba(OH)2溶液反应至溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
NaHSO4与Ba(OH)2溶液反应至溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C
铁和氯气反应:2Fe+3Cl2 2FeCl3
铁和碘单质反应2Fe+3I2 2FeI3
D
向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
A、A B、B C、C D、D二、多选题
-
15. 向盛有紫色石蕊溶液的试管中持续通入氯气至过量,溶液颜色可能出现无色、浅黄绿色、红色等变化。

下列叙述正确的是( )
A、过程Ⅰ溶液由紫色变成红色,起作用的微粒是H+ B、过程Ⅱ溶液由红色变成无色,证明试管②溶液不再呈酸性 C、过程Ⅲ溶液颜色由无色变成浅黄绿色,证明溶液中有Cl2 D、若向紫色石蕊试液中持续加入Na2O2粉末,也会出现相同的颜色变化16. 将10mL淀粉胶体和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中,如图所示,2min后,分别取袋内和烧杯内液体进行实验。下列说法正确的是( )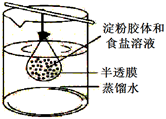 A、烧杯内液体加入硝酸银溶液后产生白色沉淀 B、袋内液体加入硝酸银溶液后产生白色沉淀 C、袋内液体加入碘水后不变蓝 D、烧杯内液体加入碘水后变蓝17. 下列叙述正确的是( )A、将氯气通入盛有湿润有色布条的集气瓶,有色布条褪色,说明氯气具有漂白性。 B、蘸取某溶液做焰色试验时,观察火焰颜色为黄色,说明溶液中不含钾元素。 C、新制氯水和久置氯水都是混合物,而液氯是纯净物。 D、钠可以从熔融状态下硫酸铜置换出铜,是因为钠具有较强的还原性18. 下列有关实验的现象描述正确的是( )A、氢气在氯气中燃烧,火焰呈淡蓝色,瓶口出现大量暈白雾 B、将新制的氯气通入AgNO3溶液中,白色沉淀生成. C、铜在氯气中燃烧,产生大量棕色的烟,加水溶解后可得蓝绿色溶液 D、用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰
A、烧杯内液体加入硝酸银溶液后产生白色沉淀 B、袋内液体加入硝酸银溶液后产生白色沉淀 C、袋内液体加入碘水后不变蓝 D、烧杯内液体加入碘水后变蓝17. 下列叙述正确的是( )A、将氯气通入盛有湿润有色布条的集气瓶,有色布条褪色,说明氯气具有漂白性。 B、蘸取某溶液做焰色试验时,观察火焰颜色为黄色,说明溶液中不含钾元素。 C、新制氯水和久置氯水都是混合物,而液氯是纯净物。 D、钠可以从熔融状态下硫酸铜置换出铜,是因为钠具有较强的还原性18. 下列有关实验的现象描述正确的是( )A、氢气在氯气中燃烧,火焰呈淡蓝色,瓶口出现大量暈白雾 B、将新制的氯气通入AgNO3溶液中,白色沉淀生成. C、铜在氯气中燃烧,产生大量棕色的烟,加水溶解后可得蓝绿色溶液 D、用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰三、填空题
-
19. 1774年瑞典化学家在研究软锰矿(主要成分是 MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色的气体,有强烈的刺鼻气味。这种方法至今还是实验室制取的主要方法之一,请写出该反应的化学方程式:。在实验室,这种黄绿色气体作为尾气通常用溶液(填化学式)来吸收, 发生反应的离子方程式是:。20. 某同学按如图进行实验,在A中放的是干燥的红色布条,在B中放的是湿润的红色布条,在C中盛放的是氢氧化钠溶液,回答下列问题
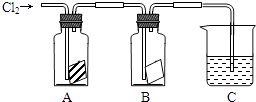
A中现象是 B中现象是
结论是
③若C中盛有的是混有酚酞溶液的氢氧化钠溶液,当通入一定量的氯气时溶液红色褪去,有同学说红色消失的原因有两种可能,请你帮他写出哪两种可能?
a:
b:
请设计实验证明哪种可能正确 .
四、实验探究题
-
21. 已知无水AlCl3遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备无水AlCl3。请回答:
 (1)、仪器a的名称是。(2)、装置A中发生反应的化学方程式。(3)、装置B盛放的试剂是 , 它的作用除降低氯气在水中的溶解量外还包括。(4)、装置 的作用是(用离子方程式表示)。(5)、已知无水AlCl3遇潮湿空气,能发生复分解反应,产生大量的白雾,请写出该反应的化学方程式。(6)、已知氯酸钾和浓盐酸在不加热的条件下可以制备Cl2 , 比较KClO3和MnO2氧化性的强弱:KClO3MnO2 (填“>”或“<”)。22. 某研究性学习小组欲探究氯气的化学性质,设计的实验装置如图所示。
(1)、仪器a的名称是。(2)、装置A中发生反应的化学方程式。(3)、装置B盛放的试剂是 , 它的作用除降低氯气在水中的溶解量外还包括。(4)、装置 的作用是(用离子方程式表示)。(5)、已知无水AlCl3遇潮湿空气,能发生复分解反应,产生大量的白雾,请写出该反应的化学方程式。(6)、已知氯酸钾和浓盐酸在不加热的条件下可以制备Cl2 , 比较KClO3和MnO2氧化性的强弱:KClO3MnO2 (填“>”或“<”)。22. 某研究性学习小组欲探究氯气的化学性质,设计的实验装置如图所示。
已知:该装置气密性良好,铁粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)、为防止铁粉被空气中的氧气氧化,在加热之前应该进行的操作为。(2)、实验中,观察到紫色石蕊溶液颜色的变化为。(3)、实验装置中空试管的作用是。(4)、烧杯中氢氧化钠溶液的作用是。(5)、盛水的试管中,溶液的颜色为 , 说明氯气(填“能”或“不能”)溶于水。23. “84消毒液”的有效成分为NaClO,因其能杀灭病毒,是新冠肺炎期间常用的环境消毒剂。某化学学习小组为制备“84消毒液”设计了如图装置。并查阅到下列资料,“在加热情况下卤素和碱液发生如下反应:3X2+6OH- 5X-+ +3H2O”。
回答下列问题:
(1)、仪器a的名称是。(2)、圆底烧瓶内发生的离子方程式为。(3)、装置中若省去盛装饱和NaCl溶液的洗气瓶,则会使产生的NaClO的量(填“不变”、“减少”或“增大”)。(4)、装置中若撤去盛冰水的烧杯,则可能会使产生的NaClO的量(填“不变”、“减少”或“增大”)。(5)、装置中的大试管内发生反应的离子方程式为。(6)、使用“84消毒液”时须注意不要与洁厕灵(主要成分为盐酸)混合,否则会产生Cl2 , 请写出该反应的离子方程式。(7)、对比(5)与(6)的反应可得,ClO-与Cl2的氧化性相对强弱与有关。五、综合题
-
24. 阅读短文,回答问题。
世界卫生组织(WHO)和中国卫健委公认二氧化氯(ClO2)为新时代绿色消毒剂,其特点是:无三致(致癌、致畸、致突变),有三效(广谱、高效、快速)。国家疾病控制中心建议,为了避免传染病的传播,餐饮用具可用200mg·L− 1的ClO2溶液浸泡,游泳池水可按5mg·L− 1用ClO2进行消毒。常温下,ClO2气体与Cl2具有相似的颜色与气味,在水中的溶解度是Cl2的5~8倍。ClO2是强氧化剂,其有效氯是Cl2的2.6倍。ClO2不与冷水反应,遇热水则分解成HClO、Cl2和O2。
下表列出了ClO2与传统消毒剂(氯制剂)的部分性能比较:
性能
ClO2
氯制剂(84消毒液、漂白粉等)
杀菌力
可杀灭所有的微生物
可杀灭所有细菌繁殖体高浓度能杀死细菌芽孢
残留
无
有
抗药性
无
有
经大量实验研究表明,ClO2对细胞壁有较强的吸附和穿透能力,反应释放出的原子氧将细胞内的酶氧化,从而起到杀菌作用。ClO2反应释放出的原子氧还可以氧化色素,所以ClO2也是优良的漂白剂。研究表明,ClO2在浓度低于100mg·L− 1时不会对人体产生任何的影响。我国卫健委提出,逐步用ClO2替代Cl2进行饮用水消毒。相信在不久的将来,ClO2将广泛应用到杀菌消毒领域。
(1)、请依据以上短文,判断下列说法是否正确(填“对”或“错”)。A.可以用等浓度的ClO2溶液对餐饮用具和游泳池进行消毒。
B.ClO2是有刺激性气味的气体。
C.ClO2杀菌力强、无抗药性。
D.未来ClO2在生产生活中更广泛的使用,是我国发展绿色消毒剂的方向。
(2)、某同学推测ClO2能与FeSO4溶液反应,你认为他的推测是否合理(填“合理”或“不合理”)?用简要的文字说明理由。六、推断题
-
25. 现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,B为日常生活中最常见无色无味液体, E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,G为黄绿色气体单质,H是漂白液的有效成分,它们之间的相互转化关系如图所示,其他与题无关的生成物均已略去。

请回答下列问题:
(1)、写出G、H的化学式:G , H。D的俗名是。(2)、写出反应②的离子方程式:。(3)、利用下图装置进行实验,证明氧化性强弱:KMnO4>Cl2>Br2。限选试剂:KBr溶液、KMnO4、浓盐酸。

已知:2KMnO4+16HCl(浓)=2KCl+ 2MnCl2+5Cl2↑+8H2O
请回答下列问题:
装置a 的名称是 , d中盛放的试剂是。
26. 如图,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体。请回答下列问题: (1)、A、G的化学式分别为、。(2)、写出A与Fe反应的化学方程式 。(3)、写出反应②的化学方程式。(4)、已知A是一种重要的化工原料,在工农业生产和生活中有着重要的应用。请根据所学知识回答下列问题。
(1)、A、G的化学式分别为、。(2)、写出A与Fe反应的化学方程式 。(3)、写出反应②的化学方程式。(4)、已知A是一种重要的化工原料,在工农业生产和生活中有着重要的应用。请根据所学知识回答下列问题。①将A通入紫色石蕊试液中,观察到的现象是;请写出A与水反应的化学方程式 。
②A与石灰乳反应制得的漂白粉的有效成分是(填化学式);该物质在空气中失效的原因(用化学方程式表示)。
-