浙教版科学八下专题复习之微粒的模型与符号(中等难度)
试卷更新日期:2021-07-07 类型:复习试卷
一、单选题
-
1. 有一种人造氢原子(可表示为4H)的原子核中有3个中子,它可以结合成4H2分子。一个4H2分子中,下列微粒的个数不等于2的是( )A、原子 B、质子 C、中子 D、电子2. 化合物A和B均由元素X、Y组成,X元素化合价均为正价,在A中X的质量分数为40%,在B中X的质量分数为50%,已知A中X、Y原子个数比为1:3,则B的化学式为( )A、Y2X B、Y3X C、XY2 D、XY33. 针对下列常见的科学用语:①2Cl ②2NH4+ ③CO2 ④ ⑤Fe2+ ⑥2OH-⑦H2O中数字“2”的说法正确的是( )A、表示离子个数的是②⑤⑥ B、表示离子所带电荷数的是④⑤ C、表示微粒中原子个数的是③⑦ D、表示分子个数的是①③4. 下列关于原子的叙述中正确的是( )A、原子的质量主要集中在核外电子上 B、核外电子对原子在化学反应中的表现有很大影响 C、所有元素的原子核都是由质子和中子构成的 D、构成原子核的质子和中子是不能再分的粒子5. 为了护航“亚运会”的环境质量,我市重点整治了工业废气、汽车尾气。下图是汽车尾气处理过程中使用催化剂发生的某个反应的微观示意图(图中一种小球代表一种元素的原子)。下列说法正确的是( )
 A、该反应前后分子种类不变 B、反应生成的两种物质分子个数之比为1:1 C、乙和丁有相同的化学性质 D、反应物和生成物中只有一种单质6. 微粒是构成化学物质的基础,下列对微粒的描述正确的是( )A、仅由碳原子构成的物质属于单质 B、原子中一定含有质子、中子、电子 C、金刚石是由原子构成的,所以C60也是由原子构成的 D、氯原子和氯离子的核电荷数一定相等7. 已知R元素的相对原子质量为64,在其氧化物中的质量分数为80%,则该氧化物中R元素的化合价为( )A、+1 B、+2 C、+3 D、+48. 连花清瘟胶囊具有清瘟解毒,宣肺泄热的功效。其成分中含有一种名为绿原酸的物质,下列有关绿原酸(C16H18O9)的说法正确的是( )A、绿原酸是由3种元素组成的化合物 B、绿原酸的相对分子质量是354g C、绿原酸中氢元素的质量分数最大 D、绿原酸由16个碳原子、18个氢原子和9个氧原子构成9. 已知某氧原子的实际质量为m,其相对原子质量为16。有一种铕原子的相对原子质量为152,铕(Eu)原子的质量为( )A、 B、 C、 D、10. 《我不是药神》是一部关于白血病和印度药的电影作品。药品“甲磺酸伊马替尼片”用于治疗慢性髓性白血病和恶性胃肠道间质肿瘤,原理是融合基因,使BCR-ABL蛋白得不到磷酸,不能活化,就发不出指令,细胞的增殖态势便会得到抑制。甲磺酸伊马替尼的化学式为C29H31N7O·CH4SO3 , 关于甲磺酸伊马替尼的说法正确的是( )A、甲磺酸伊马替尼是由八种元素组成的化合物 B、甲磺酸伊马替尼由77个原子构成 C、甲磺酸伊马替尼中碳、氢、氧元素的质量比为30∶35∶4 D、甲磺酸伊马替尼的相对分子质量是58911. 现有一种由FeSO4和Fe2(SO4)3组成的固体混合物,已知该混合物中硫元素的质量分数为23%,则该混合物中铁元素的质量分数为( )A、31% B、40% C、30% D、46%12. 瑞德西韦一度被认为是治疗新冠肺炎较为有效的药物,其主要成分的化学式是C27H35N6O8P,对此分析可得出的信息是( )A、相对分子质量为602g B、1个C27H35N6O8P分子中有35个氢原子 C、该分子由五种元素组成 D、该物质中氢元素的质量分数最大13. 2020年初出现了罕见的新型冠状病毒疫情,过氧乙酸(分子模型如图)能有效杀灭病毒。下列关于过氧乙酸的说法中正确的是( )
A、该反应前后分子种类不变 B、反应生成的两种物质分子个数之比为1:1 C、乙和丁有相同的化学性质 D、反应物和生成物中只有一种单质6. 微粒是构成化学物质的基础,下列对微粒的描述正确的是( )A、仅由碳原子构成的物质属于单质 B、原子中一定含有质子、中子、电子 C、金刚石是由原子构成的,所以C60也是由原子构成的 D、氯原子和氯离子的核电荷数一定相等7. 已知R元素的相对原子质量为64,在其氧化物中的质量分数为80%,则该氧化物中R元素的化合价为( )A、+1 B、+2 C、+3 D、+48. 连花清瘟胶囊具有清瘟解毒,宣肺泄热的功效。其成分中含有一种名为绿原酸的物质,下列有关绿原酸(C16H18O9)的说法正确的是( )A、绿原酸是由3种元素组成的化合物 B、绿原酸的相对分子质量是354g C、绿原酸中氢元素的质量分数最大 D、绿原酸由16个碳原子、18个氢原子和9个氧原子构成9. 已知某氧原子的实际质量为m,其相对原子质量为16。有一种铕原子的相对原子质量为152,铕(Eu)原子的质量为( )A、 B、 C、 D、10. 《我不是药神》是一部关于白血病和印度药的电影作品。药品“甲磺酸伊马替尼片”用于治疗慢性髓性白血病和恶性胃肠道间质肿瘤,原理是融合基因,使BCR-ABL蛋白得不到磷酸,不能活化,就发不出指令,细胞的增殖态势便会得到抑制。甲磺酸伊马替尼的化学式为C29H31N7O·CH4SO3 , 关于甲磺酸伊马替尼的说法正确的是( )A、甲磺酸伊马替尼是由八种元素组成的化合物 B、甲磺酸伊马替尼由77个原子构成 C、甲磺酸伊马替尼中碳、氢、氧元素的质量比为30∶35∶4 D、甲磺酸伊马替尼的相对分子质量是58911. 现有一种由FeSO4和Fe2(SO4)3组成的固体混合物,已知该混合物中硫元素的质量分数为23%,则该混合物中铁元素的质量分数为( )A、31% B、40% C、30% D、46%12. 瑞德西韦一度被认为是治疗新冠肺炎较为有效的药物,其主要成分的化学式是C27H35N6O8P,对此分析可得出的信息是( )A、相对分子质量为602g B、1个C27H35N6O8P分子中有35个氢原子 C、该分子由五种元素组成 D、该物质中氢元素的质量分数最大13. 2020年初出现了罕见的新型冠状病毒疫情,过氧乙酸(分子模型如图)能有效杀灭病毒。下列关于过氧乙酸的说法中正确的是( )
 A、 过氧乙酸的分子式为CH3COOH B、过氧乙酸是由碳、氢、氧三种原子构成 C、过氧乙酸的相对分子质量是76 D、过氧乙酸中碳元素的质量分数最大14. 在科学王国里,数字被赋予了丰富的内涵,对下列化学用语中数字“2”的说法正确的是( )
A、 过氧乙酸的分子式为CH3COOH B、过氧乙酸是由碳、氢、氧三种原子构成 C、过氧乙酸的相对分子质量是76 D、过氧乙酸中碳元素的质量分数最大14. 在科学王国里,数字被赋予了丰富的内涵,对下列化学用语中数字“2”的说法正确的是( )①2H②2NH3③SO2④O−2⑤Mg2+⑥2OH-⑦H2O
A、表示离子个数的是⑤⑥ B、表示离子所带电荷数的是④⑤ C、表示分子中原子个数的是③⑦ D、表示分子个数的是①②15. 科学家最近制得了一种新型的氧分子O4 , 下列叙述正确的是( )A、O2、O4一都是由氧元素组成的单质 B、O4分子由4个氧元素组成 C、1个O4分子由2个O2分子构成 D、O4是由O2组成的混合物16. 2013年5月,国内外各大媒体曝光;山东潍坊霞山区生姜种植户,在种植内销的生姜时使用了一种叫“神农丹”的剧毒农药.“神农丹”所含物质的化学式为C7H14N2O2S,下列关于该物质的说法,不正确的是( )A、该物质由五种元素组成 B、该物质的一个分子中含碳、氢原子的个数比为1:2 C、该物质燃烧时可能会产生形成酸雨的物质 D、该物质中硫元素质量分数最小17. 随着科技的飞速发展,出现了许多新型无机材料,如植入生物体内的生物陶瓷材料HAP(化学式为Cam(PO4)nOH),已被医疗上用于修补人的骨骼和牙组织.HAP的化学式中n等于( )A、(2m+1)/3 B、(3m﹣1)/2 C、(2m﹣1)/3 D、(m+1)18. 美国阿拉莫斯国家实验室5月13日宣布,首次从辐照后低浓铀溶液中生产出钼﹣99.其中Na2MoO4是Mo元素的重要化合物,其中Mo元素的化合价是( )A、+7价 B、+6价 C、+5价 D、+4价19. 在CO、HCOOH、OHC—COOH的混合物中,H%=y,则C%为( )A、 B、 C、 D、20. 如图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。下列说法正确的是( ) A、该原子核外有6个电子 B、该原子的核电荷数为4 C、该原子带电 D、该原子核由2个质子和2个中子构成
A、该原子核外有6个电子 B、该原子的核电荷数为4 C、该原子带电 D、该原子核由2个质子和2个中子构成二、填空题
-
21. 有些物质俗称比较相似,请写出下列两组物质的化学式:(1)、烧碱 , 纯碱。(2)、生石灰 , 熟石灰。22. 根据下面元素周期表,回答有关问题:
 (1)、编号①②③④代表元素周期表中的四种元素,其中属于金属元素的是(填序号)。(2)、①处元素和②处元素形成的化合物的化学式为。23. 图甲是钠在元素周期表中的部分信息,则钠原子的核电荷数为。图乙形象地表示了氯化钠的形成过程,钠原子一个电子形成阳离子,与分子、原子一样,离子也是构成物质的微粒。
(1)、编号①②③④代表元素周期表中的四种元素,其中属于金属元素的是(填序号)。(2)、①处元素和②处元素形成的化合物的化学式为。23. 图甲是钠在元素周期表中的部分信息,则钠原子的核电荷数为。图乙形象地表示了氯化钠的形成过程,钠原子一个电子形成阳离子,与分子、原子一样,离子也是构成物质的微粒。 24. 为预防龋齿,市面上推出含氟牙膏。如图为某含氟牙膏商标上的部分文字,试回答下列问题:
24. 为预防龋齿,市面上推出含氟牙膏。如图为某含氟牙膏商标上的部分文字,试回答下列问题: (1)、氢氧化钾的化学式是。(2)、氟化钠的化学式是NaF,其中F元素的化合价是。25. 结合所学知识回答有关下列问题:(1)、最近科学家成功制备了种含有铱元素(Ir)的带一个单位正电荷的离子(四氧化铱正离子)。结构模型如图所示,则该离子的符号为;
(1)、氢氧化钾的化学式是。(2)、氟化钠的化学式是NaF,其中F元素的化合价是。25. 结合所学知识回答有关下列问题:(1)、最近科学家成功制备了种含有铱元素(Ir)的带一个单位正电荷的离子(四氧化铱正离子)。结构模型如图所示,则该离子的符号为; (2)、考古学上常用碳-14原子测定文物年代,碳-14原子和碳-12原子在原子结构上的不同之处是 。26. 在新型冠状病毒流行的时候,可以用75%的酒精或者含氯的消毒剂进行消毒,可以有效的杀死新型冠状病毒。其中84消毒液是一种以次氯酸钠(NaClO)为主要成分的含氯消毒剂,次氯酸钠可由氯气溶于冷而且稀的氢氧化钠溶液产生次氯酸钠、氯化钠及水,请书写反应化学方程式。氧化还原反应前后,反应物中元素的化合价升高称为还原剂,反应物中元素的化合价降低的称为氧化剂,其中Cl属于(“氧化剂”、“还原剂”或“既是还原剂又是氧化剂”。27. 在分子、原子、质子、中子、电子、原子核这些微粒中:(1)、能保持物质化学性质的微粒有 。(2)、显示电中性的微粒有 。(3)、在同一原子里数目一定相等的是 。28. “神州”“嫦娥”系列飞船,圆了中华民族的千年飞天梦。请从科学的视角对我国宇宙飞船的相关信息进行思考,并回答下列问题:人类探索太空的其中一个目的是开发新的核聚变能源,已知某种核原料的原子核含有1个质子和2个中子,则(填字母)。
(2)、考古学上常用碳-14原子测定文物年代,碳-14原子和碳-12原子在原子结构上的不同之处是 。26. 在新型冠状病毒流行的时候,可以用75%的酒精或者含氯的消毒剂进行消毒,可以有效的杀死新型冠状病毒。其中84消毒液是一种以次氯酸钠(NaClO)为主要成分的含氯消毒剂,次氯酸钠可由氯气溶于冷而且稀的氢氧化钠溶液产生次氯酸钠、氯化钠及水,请书写反应化学方程式。氧化还原反应前后,反应物中元素的化合价升高称为还原剂,反应物中元素的化合价降低的称为氧化剂,其中Cl属于(“氧化剂”、“还原剂”或“既是还原剂又是氧化剂”。27. 在分子、原子、质子、中子、电子、原子核这些微粒中:(1)、能保持物质化学性质的微粒有 。(2)、显示电中性的微粒有 。(3)、在同一原子里数目一定相等的是 。28. “神州”“嫦娥”系列飞船,圆了中华民族的千年飞天梦。请从科学的视角对我国宇宙飞船的相关信息进行思考,并回答下列问题:人类探索太空的其中一个目的是开发新的核聚变能源,已知某种核原料的原子核含有1个质子和2个中子,则(填字母)。A.该原子是一种氢原子 B.该元素是金属元素
C.该原子核外有3个电子 D.该原子核带3个单位的正电荷
该核原料的相对原子质量为;若该原子形成的离子带一个单位的正电荷,请写出其离子符号:。
29. 已知氧原子的相对原子质量为16,银原子的相对原子质量为108,若银原子的实际质量为m,则氧原子的实际质量可以表示为。30. 含义丰富的化学符号是独特的化学语言。请用化学符号填空:①5个亚铁离子: ; ②氖气: ;
③硫酸铵: ; ④地壳中含量最高的非金属元素: ;
⑤ 中数字“2”的意义: ;⑥ 中数字“2”的意义: ;
三、解答题
-
31. 传统中药【连花清瘟】在新冠肺炎疫情的控制和治疗中发挥了一定的作用,它由连翘、金银花、甘草等多味药材组成。(1)、甘草素是甘草中的主要成分,其化学式为C5H12O4 , 该分子中碳、氢、氧的原子个数比是。(2)、从该中药中提取某有机化合物X,取一定量该化合物与足量氧气完全反应,生成44g二氧化碳和9g水。则中碳、氢元素的质量比为。32. 数字在化学式不同位置表示不同的意义:①表示微粒的数目②表示元素的化合价③ 表示离子的电荷数④表示每个分子中所含原子的个数。请你判断下列化学式中的“2”分别表示上述哪种含义?(填序号)
Ca2+:;2N:;SO2:; :。
33. 丁酸乙酯(C6H12O2)是一种具有菠萝香味的液体,可用于制作香料、香精和作溶剂。(1)、丁酸乙酯中氢和碳的原子个数比为。(2)、丁酸乙酯作为溶剂,可以溶解多种有机物,这体现了它的。(填“物理性质”或“化学性质”)(3)、若丁酸乙酯和葡萄糖(C6H12O6)中碳原子个数相等,则丁酸乙酯和葡萄糖的质量比为 。34. 蛋白质的机体生长及修补受损组织的主要原料,人体通过食物获得的蛋白质在胃肠中与水反应,生成氨基酸。蛋氨酸(化学式为C5H11O2NS)就是其中的一种。请分析计算下列问题:(1)、蛋氨酸的相对分子质量是;(2)、蛋氨酸中碳氧元素的质量比C∶O =;(3)、蛋氨酸中氮元素的质量分数?(精确到0.1%)(要求写出计算过程)(4)、合格奶粉每100克含蛋白质约18克,蛋白质中氮元素的平均质量分数为16%,则每100克合格奶粉中氮元素的质量为多少克?现测定某奶粉每100克中含有氮元素1.5克,通过计算判断这种奶粉是否合格.35. 赤铁矿(Fe2O3)的主要成分是氧化铁.某赤铁矿含氧化铁为80%,现有该赤铁矿石200t,试计算:(1)、这些赤铁矿石中含氧化铁的质量.(2)、这些赤铁矿石中含铁元素的质量.(3)、这些赤铁矿石中含铁元素的质量,相当于多少吨含四氧化三铁为90%的磁铁矿石中含铁元素的质量.(计算结果精确到0.1t)36. 钙是维持人体正常功能所必需的元素,有时需要服用补钙剂来满足人体需求。如图分别为两种补钙剂说明书的一部分。葡萄糖酸钙片
【主要成分】每片含葡萄糖酸钙
(C12H22O14Ca)0.5 g
【用法】口服
【用量】每日3次,一次___片
金钙尔奇
【主要原料】碳酸钙(CaCO3)、氧化镁、硫酸锌、硫酸铜、维生素等
【含量】每片含钙280 mg、镁99.7 mg、锌3.08 mg、铜0.51 mg等
【用量】每日2次,一次1片
请根据图示中的信息回答下列问题:
(1)、钙是人体必需的常量元素,每日要摄取足量的钙,才能避免 (填字母序号);A、佝偻病或骨质疏松 B、贫血症 C、甲状腺肿大(2)、葡萄糖酸钙(C12H22O14Ca)的相对分子质量是;(3)、每片金钙尔奇中含碳酸钙的质量为mg;(4)、按照金钙尔奇说明书每日的补钙量,若改服用葡萄糖酸钙片,一日3次,一次应服用片。四、实验探究题
-
37. 为进一步探究原子的结构,1911年英国科学家卢瑟福进行了著名的α粒子(带正电)轰击金箔实验。
【收集证据】①绝大多数α粒子穿过金箔后仍沿原来的方向前进;②只有少数α粒子发生了的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°。
【解释与结论】
(1)、要发生大角度的散射,说明原子的大部分质量集中到了一个很小的结构且该结构带有与α粒子电性相同的电荷,这个很小的结构指的是;(2)、能说明原子内部绝大部分是空的证据是;(选填序号)(3)、根据卢瑟福的实验所产生的现象,能够获得的结论是 ;A、原子核体积很小 B、原子核质量较大 C、原子核带正电 D、核外电子带负电38. 化学上常用燃烧法确定有机物的组成。这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下图所列的是用燃烧法确定有机物分子式组成的装置,D装置用来产生氧气,反应方程式为: 2H2O22H2O+O2↑ 。把上面所列的装置正确连接成实验装置后进行实验,回答下列问题:
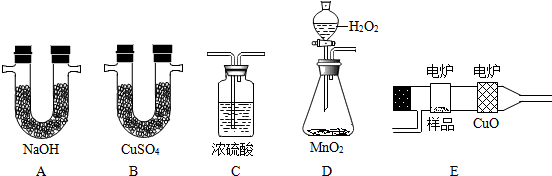 (1)、图E中CuO的作用是。(2)、若正确称取0.9克样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32克,B管质量增加0.54克,则有机物的化学式(最简式)为 。39. 电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?1910 年英国科学家卢瑟福进行了著名的 α 粒子轰击金箔实验。实验做法如图:
(1)、图E中CuO的作用是。(2)、若正确称取0.9克样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32克,B管质量增加0.54克,则有机物的化学式(最简式)为 。39. 电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?1910 年英国科学家卢瑟福进行了著名的 α 粒子轰击金箔实验。实验做法如图:
绝大多数 α 粒子穿过金箔后仍沿原来的方向前进,但是有少数 α 粒子却发生了较大的偏转,并且有极少数 α 粒子的偏转超过 90°,有的甚至几乎达到 180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)、大多数α粒子不改变原来的运动方向,原因是;(2)、若原子质量、正电荷在原子内均匀分布,则极少数 α 粒子就填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是;(3)、科学家对原子结构的探究经历了三个过程,通过α 粒子散射实验,你认为原子结构为以下的 。A、 B、
B、 C、
C、 40. 碘是一种由碘分子构成的非金属单质,某同学利用碘进行了如下的实验:
40. 碘是一种由碘分子构成的非金属单质,某同学利用碘进行了如下的实验:①把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色(提示:碘分子能使馒头中的淀粉变蓝色);
②再取少量的碘溶解在水中,用馒头去蘸取碘液,发现馒头也会变蓝色。则:
(1)、取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头(填会或不会)变蓝色。(2)、由上述三个实验可知,分子是。(3)、现在市场上买来的食盐都是加碘盐(含有KIO3),用馒头沾取少量的食盐水,馒头(填会或不会)变蓝色。