浙教版科学八上第一章第6节 物质的分离同步练习(优生加练)
试卷更新日期:2021-07-06 类型:同步测试
一、单选题
-
1. 自来水厂净化水的主要步骤如图所示,下列有关说法中,不正确的是( )
 A、步骤①②可除去难溶性杂质 B、X试剂可以是明矾 C、步骤④中常加入氯气等物质进行杀菌 D、图中净化后的水是纯净物,即可饮用2.
A、步骤①②可除去难溶性杂质 B、X试剂可以是明矾 C、步骤④中常加入氯气等物质进行杀菌 D、图中净化后的水是纯净物,即可饮用2.20℃时100g某硝酸钾溶液,经过以下变化,恢复到20℃,最终析出晶体的质量是( )
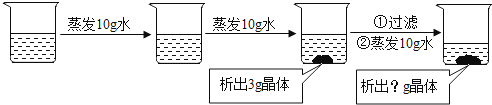 A、小于3克 B、等于3克 C、大于3克 D、大于等于3克3.
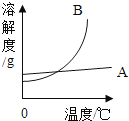
A、小于3克 B、等于3克 C、大于3克 D、大于等于3克3.如图是甲和乙的溶解度曲线.下列说法中正确的( )
 A、甲的溶解度大于乙的溶解度 B、乙的溶解度不受温度的影响 C、t1℃时,甲的饱和溶液升温到t2℃时(不考虑水分的蒸发)会有晶体析出 D、t2℃时,甲与乙的溶解度相等4.
A、甲的溶解度大于乙的溶解度 B、乙的溶解度不受温度的影响 C、t1℃时,甲的饱和溶液升温到t2℃时(不考虑水分的蒸发)会有晶体析出 D、t2℃时,甲与乙的溶解度相等4.如图是A、B、C三种固体(都不含结晶水)物质的溶解度曲线.下列说法或判断中正确的是( )
 A、t1℃时,A、B、C三种物质的溶解度由大到小的顺序为B>A>C B、t1℃时将10g A物质放入50g水中,充分搅拌所得溶液的质量为60g C、若B物质是氯化钠,可用冷却热饱和溶液结晶的方法获得大量的氯化钠晶体 D、将t2℃时的三种物质的饱和溶液分别降温到t1℃时,三种溶液中溶质的质量分数由大到小的顺序是B>A>C5. 将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列相关量随时间变化趋势的图象不.正.确.的是( )A、
A、t1℃时,A、B、C三种物质的溶解度由大到小的顺序为B>A>C B、t1℃时将10g A物质放入50g水中,充分搅拌所得溶液的质量为60g C、若B物质是氯化钠,可用冷却热饱和溶液结晶的方法获得大量的氯化钠晶体 D、将t2℃时的三种物质的饱和溶液分别降温到t1℃时,三种溶液中溶质的质量分数由大到小的顺序是B>A>C5. 将某温度下热的硝酸钾饱和溶液逐渐冷却至室温,下列相关量随时间变化趋势的图象不.正.确.的是( )A、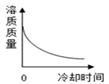 B、
B、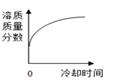 C、
C、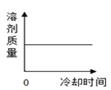 D、
D、 6.
6.如图是甲、乙、丙三种物质的溶解度曲线.下列说法错误的是( )
 A、t1℃时,三种物质的溶解度是丙>乙>甲 B、t2℃时,甲和丙的饱和溶液溶质质量分数相等 C、三种物质的溶解度均随温度的升高而增大 D、当甲中混有少量的乙时可用冷却其热饱和溶液的方法提纯7.
A、t1℃时,三种物质的溶解度是丙>乙>甲 B、t2℃时,甲和丙的饱和溶液溶质质量分数相等 C、三种物质的溶解度均随温度的升高而增大 D、当甲中混有少量的乙时可用冷却其热饱和溶液的方法提纯7.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
 A、t1℃时,甲、乙两种物质的饱和溶液中溶质的质量相等 B、将甲、乙的饱和溶液从t2℃降到t1℃,两者均有晶体析出 C、将甲的溶液从t1℃升到t2℃,其溶质的质量分数一定增大 D、当温度高于t1℃而低于t2℃时,乙的溶解度比甲的溶解度小8. 化学科学的发展离不开定量研究.下列有关定量实验的误差分析中,不正确的是( )A、配制10%的氯化钠溶液时,若烧杯内有水会导致所配溶液溶质的质量分数偏小 B、粗盐提纯实验中,若蒸发过程中晶体飞溅会导致测得的氯化钠纯度偏低 C、测定空气中氧气含量的实验中,铜粉质量的多少不影响实验结果 D、用白磷燃烧探究质量守恒的实验中,白磷质量的多少不影响实验结果9.
A、t1℃时,甲、乙两种物质的饱和溶液中溶质的质量相等 B、将甲、乙的饱和溶液从t2℃降到t1℃,两者均有晶体析出 C、将甲的溶液从t1℃升到t2℃,其溶质的质量分数一定增大 D、当温度高于t1℃而低于t2℃时,乙的溶解度比甲的溶解度小8. 化学科学的发展离不开定量研究.下列有关定量实验的误差分析中,不正确的是( )A、配制10%的氯化钠溶液时,若烧杯内有水会导致所配溶液溶质的质量分数偏小 B、粗盐提纯实验中,若蒸发过程中晶体飞溅会导致测得的氯化钠纯度偏低 C、测定空气中氧气含量的实验中,铜粉质量的多少不影响实验结果 D、用白磷燃烧探究质量守恒的实验中,白磷质量的多少不影响实验结果9.图1是甲、乙、丙三种固体物质(不含结晶水)的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )
 A、甲物质的溶解度比乙物质的溶解度大 B、加入试管1的固体是丙 C、向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出 D、将30℃时甲、乙、丙三种物质的饱和溶液降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙10. t℃时,将一定量的某物质的溶液分成三等份,分别加热,再降温到t℃。已知从三份溶液中蒸发掉的溶剂分别为10克、20克、30克,析出的晶体分别为a克、b克、c克,则“a、b、c三者关系为 ( )A、c=a+b B、c=a+2b C、c=2a+b D、c=2b-a11. 下列有关溶液的说法正确的是( )
A、甲物质的溶解度比乙物质的溶解度大 B、加入试管1的固体是丙 C、向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出 D、将30℃时甲、乙、丙三种物质的饱和溶液降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙10. t℃时,将一定量的某物质的溶液分成三等份,分别加热,再降温到t℃。已知从三份溶液中蒸发掉的溶剂分别为10克、20克、30克,析出的晶体分别为a克、b克、c克,则“a、b、c三者关系为 ( )A、c=a+b B、c=a+2b C、c=2a+b D、c=2b-a11. 下列有关溶液的说法正确的是( )
A、配制好6%的NaCl溶液,装瓶时不小心洒漏一部分,瓶中NaCl溶液浓度仍为6% B、长期放置后不会分层的液体一定是溶液 C、KNO3饱和溶液一定比不饱和溶液溶质质量分数大 D、降低饱和溶液的温度,一定有晶体析出12. 盛夏,在烈日下工作、出汗过多的人,所穿的深色衣服上会出现一些细小白色粉末,其主要成分为( )A、纯碱 B、烧碱 C、氯化钠 D、油脂13. 下列做法不能达到目的是( )
A、用加入洗涤剂的热水清洗餐具上的油污 B、用过滤法除去粗盐中少量的可溶性钙、镁化合物 C、用肥皂水区分硬水和软水 D、用紫色石蕊溶液鉴别pH为3和pH为12的两瓶无标签溶液14. 实验中除杂的思路有两种:一是将杂质除去,二是将有用物质提取出来,以下除杂方法与后者的思路一致的是( )A、实验室用蒸馏的方法制取蒸馏水 B、用灼热的铜网除去N2中混有的少量O2 C、加热蒸发法除去氯化钠溶液中混有的少量盐酸 D、用适量石灰石除去氯化钙溶液中混有的少量盐酸15. 下列实验操作不能达到实验目的是( )选项
实验目的
主要操作
A
用自来水制取蒸馏水
加热沸腾,水蒸气冷凝
B
区别化纤与羊毛面料
分别取样点燃,闻气味
C
除去氨气中混有的水蒸气
气体通入盛有浓硫酸的洗气瓶中
D
探究酒精中是否含有碳元素
将燃烧产物通入澄清石灰水中
A、A B、B C、C D、D二、填空题
-
16. 如图是A,B,C三种固体物质的溶解度曲线,请回答下列问题:
(1)P点的含义是 ;
(2)若B点混有少量A时,可采用的方法提纯B;
(3)t1℃时,能不能配制溶质的质量分数为40%的C溶液? (填“能”或“不能”);
(4)t2℃时,将A,B,C三种固体物质各30g加入到100g水中,充分溶解,形成不饱和溶液的是 ;
(5)将t1℃时A,B,C三种固体物质的饱和溶液升温到t2℃,其溶质的质量分数由大到小的顺序是 .
 17. 海洋中蕴含丰富的资源.
17. 海洋中蕴含丰富的资源.(1)海水淡化是解决淡水资源不足的重要方法.下列方法中,可以使海水变为淡水的是 (填字母序号).
A.滤纸过滤 B.吸附 C.沉降 D.蒸馏
(2)从海水中提炼出来的重水(D2O)可作原子能反应堆的中子减速剂和热传热介质.重水中重氢原子(D)的相对原子质量是2,则重水中氢元素的质量分数为 .
(3)从海水中制备纯碱和金属镁的流程如图所示:

回答下列问题:
①步骤Ⅴ中所加试剂是 .
②粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可加入下了物质,利用过滤等操作进行除杂,则加入下列三种物质的先后顺序为 (填字序号).
a.适量的盐酸 b.稍过量的Na2CO3溶液 c.稍过量的Ba(OH)2溶液
③第Ⅲ步反应的化学方程式是 .
④在海边用贝壳作原料制生石灰,比用石灰石作原料的优点是(写一条).
18. 通过学习,我们对于水及水资源有了全新的认识.(1)自然界中的水几乎都属于 (混合物/纯净物).
(2)有时我们在野外可以看见清澈的山泉水,泉水虽清澈,它也不能直接饮用,因为有可能是硬水,我们可用进行鉴别,在生活中,可用的方法来降低水的硬度.
(3)对于“既浑浊又恶臭”的脏水,我们也可将其变成纯净物.其步骤主要有:
①静置沉淀,②加明矾,③ ,④吸附,⑤蒸馏,这一系列净化处理后,将其变为较纯净的水.
在步骤②中,加入明矾的作用是: .
在步骤③中,会用到的仪器有、烧杯、 、玻璃棒,这其中,玻璃棒的作用是 ;若经过操作③后,所得液体中仍有浑浊,其原因可能是 ;(填写字母)
a.滤纸没有紧贴漏斗内壁
b.漏斗下端未靠在烧杯内壁
c.漏斗内液面高于滤纸边缘.
19.运用溶解度表与溶解度曲线回答下列问题:
温度/℃
10
30
50
60
溶解度/g
氯化钠
35.8
36.3
37
37.3
硝酸钾
20.9
45.8
85.5
110
(1)氯化钠的溶解度曲线是 (填“A”或“B”).
(2)60℃时,100g水中加入90g硝酸钾,充分溶解,所得溶液是 (填“饱和”或“不饱和”)溶液.当60℃的该溶液降温到10℃时,析出晶体的质量为 g.
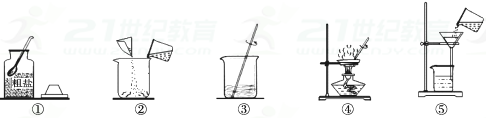
 20. 提纯下列物质主要采用了哪种操作.
20. 提纯下列物质主要采用了哪种操作.A.溶解、过滤 B.过滤 C.蒸发、结晶 D.结晶
1)从食盐水中分离出食盐;选 .
2)从碳酸钠和碳酸钙的混合物中提取碳酸钙;选 .
3)从KCl和MnO2 混合物中分离出KCl;选 .
4)从硝酸钾和氯化钠的混合物中分离出硝酸钾;选 .
21. 要分离氯化钠和硝酸钾的混合物,分别得到纯净物,供选择的操作有:A:蒸发结晶B:降温结晶C:趁热过滤D:加水溶解E:加热浓缩;供选择的仪器有:①蒸发皿②量筒③烧杯④表面皿⑤试管⑥漏斗⑦酒精灯⑧玻璃棒⑨滴管⑩烧瓶.试回答:1)正确的操作顺序是(填序号,下同); 2)需选用的仪器是.
22. 请根据下图a、b、c三种固体物质的溶解度曲线,回答下列问题: (1)、在℃时,a、c两种物质的溶解度相等。(2)、在t2℃时向盛有50ga物质的烧杯中加入50g水,充分溶解后,所得溶液的质量为g。(3)、若a物质中混有少量b物质,最好采用的方法提纯。(填“降温结晶”或“蒸发结晶”)。(4)、t2℃时,a、b、c三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是。(5)、下列说法正确的是_______。A、将a物质的饱和溶液变为不饱和溶液,其溶质的质量分数一定减小 B、将t1℃时c物质的饱和溶液升温到t2℃,其溶液的质量一定减小 C、t2℃时,a、b、c三种物质的饱和溶液恒温蒸发溶液浓度都不变,温度升高a、b物质的饱和溶液浓度不变,C物质的饱和溶液浓度减小23. 如表是氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度,回答问题。
(1)、在℃时,a、c两种物质的溶解度相等。(2)、在t2℃时向盛有50ga物质的烧杯中加入50g水,充分溶解后,所得溶液的质量为g。(3)、若a物质中混有少量b物质,最好采用的方法提纯。(填“降温结晶”或“蒸发结晶”)。(4)、t2℃时,a、b、c三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是。(5)、下列说法正确的是_______。A、将a物质的饱和溶液变为不饱和溶液,其溶质的质量分数一定减小 B、将t1℃时c物质的饱和溶液升温到t2℃,其溶液的质量一定减小 C、t2℃时,a、b、c三种物质的饱和溶液恒温蒸发溶液浓度都不变,温度升高a、b物质的饱和溶液浓度不变,C物质的饱和溶液浓度减小23. 如表是氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度,回答问题。温度/℃
10
20
30
40
50
60
溶解度/g
NaCl
35.8
36.0
36.3
36.6
37.0
37.3
KNO3
20.9
31.6
45.8
63.9
85.5
110.0
(1)、两种物质中,溶解度受温度影响变化较大的是。(2)、60 ℃时,按图示操作:
A中溶液是(填“饱和”或“不饱和”)溶液,C中溶液的总质量是克。
(3)、50 ℃时,将两种物质的饱和溶液各100克,分别加热蒸发10克水后,再恢复到50 ℃,剩余溶液的质量:NaCl溶液(填“大于”“等于”或“小于”)KNO3溶液。
24. 溶解是生活中常见的现象,不同物质在水中的溶解能力不同.①下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水).
温度(℃)
0
20
40
60
80
100
KNO3
13.3
31.6
63.9
110
169
246
NaCl
35.7
36.0
36.6
37.3
38.4
39.8
Ⅰ.上表中的两种物质在40℃时,的溶解度较大;请用相应的数据列式表示该温度时KNO3饱和溶液的质量分数 (不要求计算).
Ⅱ.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法 .
Ⅲ.20℃时,将20g NaCl放入50g水中,所得溶液的质量是 g.
Ⅳ.从NaCl溶液中得到NaCl晶体的方法是 .
②用硫酸铜进行如图所示的实验,完成下列填空(用编号表示).

所得三个溶液中:一定属于饱和溶液的是 ,溶液中溶剂质量的大小关系是 .
三、解答题
-
25. 宁波地处东南沿海,有着丰富的海洋资源,请思考下列问题:(1)、已知宁波某盐场测得:①海水中含氯化钠约为3.5%;②在海边打深井,井水中含氯化钠约为8%。晒盐最好用(填序号)作原料。(2)、关于晒盐原理的说法正确的是____。A、利用阳光和风力,使水分蒸发,析出盐 B、日光照晒后,氯化钠的溶解度变小(3)、海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的氯化钾(KCl)、氯化镁(MgCl2)、硫酸镁(MgSO4)等物质可作为重要的化工原料,它们的溶解度曲线如图所示。

①40℃时,将50g硫酸镁加入100g水中,充分搅拌,所得溶液的溶质质量分数为(结果精确到0.1%)。若使其形成饱和溶液,可采取的措施有。
A.增加溶质 B.蒸发溶剂
C.升高温度 D.降低温度
②关于卤水中含有的氯化钾(KCl)、氯化镁(MgCl2)、硫酸镁(MgSO4)三种物质,下列说法正确的是。
A.三种物质均为易溶物质
B.10℃时,向40g氯化钾(KCl)固体和40g氯化镁(MgCl2)固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
C.60℃时,三种物质溶于水形成的溶液浓度可能相等
26. 100 g40%的氯化铵不饱和溶液,从50℃降温至10℃时,溶质的质量分数变为25%.问:从50℃降至10℃的过程中有无氯化铵晶体析出?若能析出晶体,则析出晶体质量为多少?
四、实验探究题
-
27. 某科学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50克20%的氯化钠溶液。请回答下列有关问题:(1)、实验一:下图是同学们做粗盐提纯实验的操作示意图。
a.实验操作有错误的步骤是;
b.步骤③中玻璃棒的作用是;
(2)、实验二:用粗盐提纯后得到的精盐配制了氯化钠溶液,经检测,溶质质量分数偏小。其原因可能有 (填字母序号)。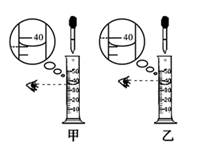 A、氯化钠固体仍然不纯 B、称量时只在天平左盘垫上滤纸 C、配制好的氯化钠溶液装瓶时,有少量溶液洒出 D、称量时使用了生锈的砝码 E、用量筒量取水时,仰视读数(3)、实验三:在溶液配制过程中,若要用量筒量取40毫升的水,当液面接近刻度线时,要改用胶头滴管,在用滴管滴加水的过程中,眼睛视线应同时按图进行观察。
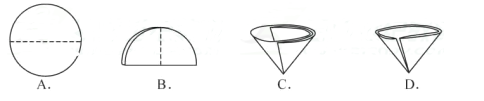
A、氯化钠固体仍然不纯 B、称量时只在天平左盘垫上滤纸 C、配制好的氯化钠溶液装瓶时,有少量溶液洒出 D、称量时使用了生锈的砝码 E、用量筒量取水时,仰视读数(3)、实验三:在溶液配制过程中,若要用量筒量取40毫升的水,当液面接近刻度线时,要改用胶头滴管,在用滴管滴加水的过程中,眼睛视线应同时按图进行观察。实验四:操作⑤中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是(填序号)。
 28. 海水可以“晒盐”,得到的粗盐中含有少量的泥沙等不溶性杂质,兴趣小组同学按甲图中的步骤将粗盐进行提纯。
28. 海水可以“晒盐”,得到的粗盐中含有少量的泥沙等不溶性杂质,兴趣小组同学按甲图中的步骤将粗盐进行提纯。 图甲
图甲 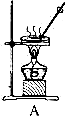
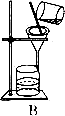
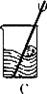 图乙(1)、 甲图中的操作①、②、③依次为乙图中的 (填序号)。如果两次过滤后滤液仍浑浊,原因可能是(写出一种即可)。(2)、 若要利用提纯出的精盐配制 100 克 12.5%的食盐溶液,则下仪器中,必须用到的玻.璃.仪.器.是
图乙(1)、 甲图中的操作①、②、③依次为乙图中的 (填序号)。如果两次过滤后滤液仍浑浊,原因可能是(写出一种即可)。(2)、 若要利用提纯出的精盐配制 100 克 12.5%的食盐溶液,则下仪器中,必须用到的玻.璃.仪.器.是(填字母)。
a.烧杯 b.10mL 量筒 c.100mL 量筒 d.滴管 e.玻璃棒 f.药匙
(3)、 若(2)中配的食盐溶液的溶质质量分数小于 12.5%,则可能的原因是(填数字)①称量食盐时,砝码放左盘食盐放右盘 ②将称好的食盐倒入烧杯时,有食盐洒落烧杯外
③用量筒量取水时仰视读数 ④将量好的水倒入烧杯时,有少量水溅出
29. 氯化钠是生活必需品,也是重要的化工原料。兴趣小组提纯含少量泥沙等杂质的粗盐,操作流程如下: (1)、操作④的名称是。(2)、操作⑤中除用到铁架台、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器有。(3)、实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是。
(1)、操作④的名称是。(2)、操作⑤中除用到铁架台、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器有。(3)、实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是。A.食盐没有全部溶解即过滤 B.过滤后滤液仍然浑浊就蒸发结晶
C.蒸发后,所得精盐很潮湿 D.称量最终的产品时,器皿上沾有的精盐没全部转移到天平上
(4)、通过操作④得到澄清透明的液体,并蒸发得到精盐(晶体表面无水分)。小组同学兴奋地宣布:我终于制得了纯净的氯化钠!对此.你同意这个看法吗?请说明理由。30.通过晾晒海水或煮井盐水、盐湖水等,可以蒸发除去水分,得到粗盐,粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等).通过如图所示过程,使粗盐得到初步提纯:
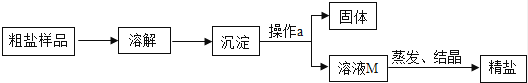 (1)、操作a的名称是 , 该操作中要用到的玻璃仪器有烧杯、玻璃棒、 .(2)、通过蒸发M溶液中的水分使之浓缩结晶,想一想,能否采用降低溶液温度的方法来达到同一目的? (填“能”或“否”).理由是 .(3)、在蒸发操作时,当蒸发皿中出现较多量固体时,应 ,利用蒸发皿的余热使滤液蒸干.(4)、某同学欲通过实验探究所得精盐是否是纯净物,进行了如下实验.
(1)、操作a的名称是 , 该操作中要用到的玻璃仪器有烧杯、玻璃棒、 .(2)、通过蒸发M溶液中的水分使之浓缩结晶,想一想,能否采用降低溶液温度的方法来达到同一目的? (填“能”或“否”).理由是 .(3)、在蒸发操作时,当蒸发皿中出现较多量固体时,应 ,利用蒸发皿的余热使滤液蒸干.(4)、某同学欲通过实验探究所得精盐是否是纯净物,进行了如下实验.实验步骤
实验现象
实验结论
取一定量精盐样品于试管中,加水使之完全溶解,并向其中加入
①
②
写出一个相应的化学方程式:③
结论:该精盐样品为混合物
31. 某科学兴趣小组的同学做粗盐(含有不溶性杂质)提纯实验,并用所得精盐配置50克5%的氧化钠溶液。 (1)、实验一:如图是同学们做粗盐提纯实验的操作示意图。回答下列问题:
(1)、实验一:如图是同学们做粗盐提纯实验的操作示意图。回答下列问题:a.粗盐提纯实验的操作顺序为(填上述操作序号次序);
b.经操作⑥后滤液仍浑浊,原因可能是(答出一点即可);
c.④步骤中的玻璃棒有作用。
(2)、实验二:用提纯得到的精盐配制50克5%的氯化钠溶液。步骤如下:a、计算:可计算出需精盐克,需水毫升。
b.称量和量取:称量氯化钠时,若发现天平指针向左偏,则应怎么处理?。
C.溶解:经检测,所配制的氯化钠溶液的溶质质量分数偏小,其可能原因是。
A.所用的氯化钠固体中含有杂质
B.量取水时,仰视读数
C.将水倒入烧杯时,有少量水溅出
D.将氯化钠固体倒入烧杯时,还有部分氯化钠固体粘在纸上
E.将配制好的溶液转移进试剂瓶时,有溶液洒落
32. 下表是硝酸钾、氯化钠在不同温度下的溶解度。温度/℃
0
10
20
30
40
50
硝酸钾
13.3
20.9
32
45.8
64
85.5
氯化钠
35.7
35.8
36
36.3
36.6
37
温度/℃
60
70
80
90
100
硝酸钾
110
138
169
202
246
氯化钠
37.3
37.8
38.4
39
39.8
(1)、以上两种物质溶解度的变化受温度影响较小的是。(2)、30 ℃时,硝酸钾的溶解度是克。
(3)、硝酸钾溶液中含有少量氯化钠时,可通过的方法提纯。
(4)、对(3)中析出的晶体和剩余溶液描述正确的是(填编号)。Ⅰ.剩余溶液一定是硝酸钾饱和溶液
Ⅱ.剩余溶液一定是氯化钠不饱和溶液
Ⅲ.上述方法可以将两者完全分离
Ⅳ.析出的晶体中只含有硝酸钾
(5)、在一定温度下,将含69克硝酸钾、18克氯化钠的混合物完全溶解在50克水中。改变温度使硝酸钾析出,氯化钠不析出,则温度T( ℃)的范围是(硝酸钾和氯化钠溶解度互不影响)。
33. 利用海水提取粗盐的过程如图所示,回答有关问题.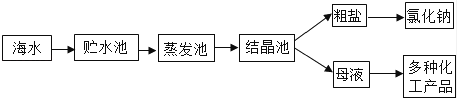 (1)、一定质量的海水,通过贮水池引入到蒸发池,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化钠的质量会 (填“增大”、“不变”或“减小”).(2)、粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是 (填“引流”或“加快溶解”).(3)、用氯化钠固体配制100g质量分数为6%的氯化钠溶液.
(1)、一定质量的海水,通过贮水池引入到蒸发池,在没有引入结晶池之前的蒸发过程中,蒸发池中氯化钠的质量会 (填“增大”、“不变”或“减小”).(2)、粗盐中含有的难溶性杂质,在实验室里可以通过溶解、过滤、蒸发等操作将其去除,这些操作中都会用到玻璃棒,其中在过滤操作中玻璃棒的作用是 (填“引流”或“加快溶解”).(3)、用氯化钠固体配制100g质量分数为6%的氯化钠溶液.①配制时,涉及以下实验步骤:A.称量及量取 B.计算 C.溶解 D.装瓶贴标签.其正确的实验步骤顺序是 (填字母).
②将已配好的100g质量分数的6%的氯化钠溶液变成质量分数为16%的氯化钠溶液,需要再加NaCl的质量是 g(计算结果精确到0.1).