上海市虹口区2021年中考化学二模试卷
试卷更新日期:2021-07-05 类型:中考模拟
一、单选题
-
1. 空气中含量最多的气体是( )A、氮气 B、氧气 C、水蒸气 D、氩气2. 盐汽水中含有氯化钠、二氧化碳、白砂糖、柠檬酸等物质,盐汽水属于( )A、纯净物 B、混合物 C、单质 D、化合物3. 实验测得一些液体室温时的pH,其中碱性最强的是( )A、雪碧:5 B、牛奶:6 C、某洗衣液:8 D、84消毒液:104. 在水中能形成溶液的是( )A、木炭粉 B、泥土 C、酒精 D、橄榄油5. 某反应的化学方程式是2X+3O2 2CO2+4H2O,其中X是( )A、CH4 B、C2H4O C、CH4O D、CH4O26. 以下含氮元素的物质中,氮元素化合价最低的是( )A、NH3 B、N2 C、NO D、NO27. 化学反应:3NaOH+FeCl3=Fe(OH)3↓+3NaCl,属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应8. 属于钾肥的是( )A、K2CO3 B、NH4HCO3 C、CO(NH2)2 D、P2O59. 对硫酸钠进行焰色反应,火焰呈( )A、紫色 B、黄色 C、绿色 D、红色10. 以下物质中金属活动性最强的是( )A、Ag B、Al C、Fe D、Mg11. 属于化学变化的是( )A、电灯发光 B、热水袋散热 C、燃料燃烧 D、冰块融化12. 具有启普发生器功能的简易装置是( )A、
 B、
B、 C、
C、 D、
D、 13. 水通电分解一段时间后如图所示,相关分析正确的是( )
13. 水通电分解一段时间后如图所示,相关分析正确的是( ) A、体积较大的气体是氧气 B、a中的电极与电源正极相连 C、该实验证明水是一种化合物 D、该实验证明水由氢分子和氧分子构成14. 实验方案正确的是( )
A、体积较大的气体是氧气 B、a中的电极与电源正极相连 C、该实验证明水是一种化合物 D、该实验证明水由氢分子和氧分子构成14. 实验方案正确的是( )实验目的
实验方案
A
测定空气中氧气的体积分数
密闭容器中,点燃铁丝,记录容器内气压变化
B
去除铁钉表面的铁锈
放入稍过量的稀硫酸中,铁锈全部除去后立即取出
C
检验固体中是否含有碳酸盐
将待测样品放入稀盐酸中,观察是否有气泡产生
D
分离碳粉和氧化铜
加热至固体质量不再变化
A、A B、B C、C D、D15. 关于构成物质的微粒,叙述正确的是( )A、分子和原子都是构成物质的微粒 B、分子的质量大于原子的质量 C、由同种原子构成的物质是纯净物 D、化学变化中分子、原子的种类都改变二、多选题
-
16. 向盛有一定量大理石粉末的烧杯中滴加稀盐酸,生成二氧化碳的物质的量与加入稀盐酸体积的变化关系如下图所示。(假设二氧化碳全部逸出,杂质不溶于水也不参加反应)相关分析正确的是( )
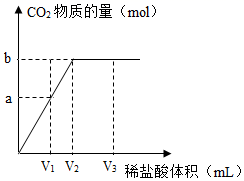 A、稀盐酸的体积为V1时,烧杯中溶液的溶质为amol B、实验过程中,烧杯内物质的质量,先变小再变大 C、稀盐酸的体积为V3时,烧杯中的溶液只含有一种溶质 D、大理石中碳酸钙为bmol17. 甲、乙两种固体(不含结晶水)的溶解度曲线如下图所示。相关分析正确的是( )
A、稀盐酸的体积为V1时,烧杯中溶液的溶质为amol B、实验过程中,烧杯内物质的质量,先变小再变大 C、稀盐酸的体积为V3时,烧杯中的溶液只含有一种溶质 D、大理石中碳酸钙为bmol17. 甲、乙两种固体(不含结晶水)的溶解度曲线如下图所示。相关分析正确的是( ) A、t1℃,配制等质量的甲、乙饱和溶液,甲需要的水较少 B、t2℃,等质量的甲、乙分别放入等质量水中,所得溶液质量相等 C、t3℃,等质量的甲、乙可以配制溶质质量分数相等的溶液 D、等质量、等溶质质量分数的甲、乙溶液,由t3℃降温至t2℃,析出晶体的质量:甲>乙
A、t1℃,配制等质量的甲、乙饱和溶液,甲需要的水较少 B、t2℃,等质量的甲、乙分别放入等质量水中,所得溶液质量相等 C、t3℃,等质量的甲、乙可以配制溶质质量分数相等的溶液 D、等质量、等溶质质量分数的甲、乙溶液,由t3℃降温至t2℃,析出晶体的质量:甲>乙三、填空题
-
18. 碳元素是组成物质的重要元素。
①石墨、和碳60都是由碳元素组成的同素异形体。
②天然气(主要成分:CH4)是清洁的气态矿物燃料。CH4属于(选填“有机物”或“无机物”),由种元素组成,1molCH4中约含有个碳原子。
③固态二氧化碳称为干冰,可用于。
④一氧化碳可冶炼金属,其还原氧化铜的实验装置如图所示(夹持仪器省略)。A处玻璃管中反应的化学方程式是 , B处观察到的现象是;C处尾气处理的目的是。

⑤盐碱湖地区有“冬天捞碱、夏天晒盐”的生产经验,其中“碱”指碳酸钠,“盐”指氯化钠。
I.碳酸钠的物质类别是(选填“酸”、“碱”或“盐”)。
II.碳酸钠、氯化钠的部分溶解度数据见下表。
温度(℃)
0
10
20
30
40
溶解度
(g/100g水)
碳酸钠
7.0
12.5
21.5
39.7
49.0
氯化钠
35.7
35.8
35.9
36.1
36.4
由上表可知,溶解度受温度影响较大的物质是;“冬天捞碱”是获取湖水中析出的碳酸钠晶体,碳酸钠晶体的形成过程是(选填“降温结晶”或“蒸发结晶”)。
19. 用稀硫酸与锌粒反应制取氢气,并进行氢气还原氧化铜的实验。(夹持仪器省略)
①A中反应的化学方程式是。
②B装置中生石灰作剂。
③D处可观察到的现象是。
④实验结束后,取少量锥形瓶中的溶液,滴加氯化钡溶液,可观察到的现象是 , 该现象是否能说明溶液中含有硫酸,理由是。
20. 某氢氧化钠样品中可能含有少量碳酸钠、氯化钠。为测定该氢氧化钠样品的纯度,进行如下实验。①检验样品成分
实验步骤
实验现象
结论
取样,溶于水中,滴加2滴酚酞试剂;
溶液变为色
氢氧化钠样品中含有氯化钠,不含碳酸钠。
向上述溶液中滴加过量稀硝酸,再滴加溶液。
②测定样品纯度。
取1g样品配制成溶液后,滴加稀盐酸,测定相关数据,如下图所示。

I.发生反应的化学方程式是。
II.实验开始前应获知的数据是稀盐酸的密度和;实验后应选用的数据是(选填“a”“b”或“c”)。
III.经计算,最终参加反应的盐酸中溶质为0.02mol,则1g样品中氢氧化钠的质量是g。
21. 某小组称取4.90g氯酸钾和1.50g二氧化锰混合后进行制取氧气、验证氧气性质的实验,并在实验结束后回收得到纯净的二氧化锰。 (1)、(氧气的制取及性质实验)
(1)、(氧气的制取及性质实验)①生成氧气的化学方程式是;采用图中的收集方法,是因为氧气。
②将红热的木炭放入集满氧气的集气瓶中,观察到的现象是。
(2)、(回收二氧化锰)
收集一定量氧气后结束实验,为回收剩余固体中的二氧化锰,进行如下实验。
③20℃时氯酸钾、氯化钾的溶解度数据见下表(假设溶液中两种物质的溶解度相互无影响)
20℃的溶解度
氯酸钾
7g/100g水
氯化钾
34g/100g水
请分析5.44g剩余固体的成分,并说明步骤III中水量约为40mL而不是30mL的原因。