江苏省苏州市苏州新区2021年中考化学二模试卷
试卷更新日期:2021-07-05 类型:中考模拟
一、单选题
-
1. 《天工开物》是我国古代科技发展的智慧结晶,书中描述的下列制瓷工序涉及化学变化的是( )A、烧裂矿石
 B、粉碎矿石
B、粉碎矿石  C、淘洗矿粉
C、淘洗矿粉  D、取泥制坯
D、取泥制坯  2. 走绿色发展道路,既要金山银山又要绿水青山。下列关于环境方面的知识正确的是( )A、空气污染指数的项目主要有二氧化硫、二氧化碳、氮的氧化物、可吸入颗粒等污染物 B、臭氧层在距地面10--50km的高空,吸收大部分紫外线保护地球生物 C、倡导绿色出行,节能减排。减排是指减少大气污染气的排放 D、水体污染的来源主要有酸碱污染、重金属污染和毒气污染3. 下列位置或场所的标识,错误的是( )
2. 走绿色发展道路,既要金山银山又要绿水青山。下列关于环境方面的知识正确的是( )A、空气污染指数的项目主要有二氧化硫、二氧化碳、氮的氧化物、可吸入颗粒等污染物 B、臭氧层在距地面10--50km的高空,吸收大部分紫外线保护地球生物 C、倡导绿色出行,节能减排。减排是指减少大气污染气的排放 D、水体污染的来源主要有酸碱污染、重金属污染和毒气污染3. 下列位置或场所的标识,错误的是( )



A.存放浓硫酸的试剂柜
B.运输酒精的槽罐车
C.面粉加工厂
D.居民住宅区
A、A B、B C、C D、D4. 下列实验操作正确的是( )A、 倾倒液体
B、
倾倒液体
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 点燃酒精灯
D、
点燃酒精灯
D、 称量NaOH固体
5. 分类是一种重要的研究方法。以下对常见物质的分类正确的是( )A、氧化物:水、生石灰、五氧化二磷 B、碱:火碱、熟石灰、纯碱 C、混合物:煤、食盐水、冰水混合物 D、有机物:甲烷、淀粉、碳酸钙6. 下列物质的用途及其依据的性质均正确的是( )A、金刚石用于制造钻石——金刚石硬度大 B、石墨用作电池的电极——石墨是一种能导电的金属 C、氮气作粮食瓜果的保护气——氮气化学性质稳定 D、液氧用作火箭的燃料——液氧具有可燃性7. 下列“家族小实验”不能达到预期目的的是( )A、向洗净的碎鸡蛋壳中加入食盐水制二氧化碳 B、用柠檬酸、果汁、白糖、水、小苏打等制汽水 C、用酒精浸泡捣烂的某些植物的花瓣制酸碱指示剂 D、用塑料瓶、小卵石、石英砂、活性炭、膨松棉等制作简易净水器8. 下列物质由离子构成的是( )A、铜 B、水 C、氯化钠 D、氖气9. 纳米铁粉在空气中能自燃并生成一种红色氧化物。对比铁丝在空气中不能燃烧,而在氧气中能剧烈燃烧的事实,某同学得出的下列结论错误的是( )A、纳米铁粉在空气中自燃的产物不是四氧化三铁 B、相同的反应物在不同条件下生成物可能不同 C、有些物质燃烧时温度不需要达到着火点 D、反应物间的接触面积大小是反应能否发生的因素之一10. 下列相关比较中,关系正确的是( )A、金属活动性:Fe<Cu B、沸点:氮气>氧气 C、pH:ω=1%NaOH液<ω=2%NaOH溶液 D、着火点:纸片>煤炭11. 下列离子在水中能大量共存,并形成无色溶液的是( )A、Fe2+、Na+、NO3-、Cl- B、H+、K+、SO42-、OH- C、H+、Na+、NO3-、Cl- D、Ba2+、NO3-、CO32- 、Cl-12. 下列推理正确的是( )A、离子是带电荷的粒子,所以带电荷的粒子一定是离子 B、氧化物是含氧元素的化合物,所以含氧元素的化合物一定是氧化物 C、H2和He质子数都是2,所以具有相同质子数的粒子不一定是同种元素 D、单质是由一种元素组成的物质,所以由一种元素组成的物质一定是单质13. 镧(La)是一种活动性比锌更强的金属,其元素在化合物中通常显+3 价,La(OH)3 是不溶于水的碱,LaCl3、La(NO3)3 都可溶于水。由此推断下列几组物质组合,不能直接反应制取 LaCl3 的是( )A、La 和稀盐酸 B、La2O3 和稀盐酸 C、La(OH)3 和氯化钾溶液 D、La(OH)3 和稀盐酸14. 烹制鱼时,同时加料酒和食醋能使鱼肉味香可口,这是因为两者发生了反应(未标明条件):C2H5OH+CH3COOH=H2O+CH3COOC2H5(乙酸乙酯)。下列四种说法正确的有( )
称量NaOH固体
5. 分类是一种重要的研究方法。以下对常见物质的分类正确的是( )A、氧化物:水、生石灰、五氧化二磷 B、碱:火碱、熟石灰、纯碱 C、混合物:煤、食盐水、冰水混合物 D、有机物:甲烷、淀粉、碳酸钙6. 下列物质的用途及其依据的性质均正确的是( )A、金刚石用于制造钻石——金刚石硬度大 B、石墨用作电池的电极——石墨是一种能导电的金属 C、氮气作粮食瓜果的保护气——氮气化学性质稳定 D、液氧用作火箭的燃料——液氧具有可燃性7. 下列“家族小实验”不能达到预期目的的是( )A、向洗净的碎鸡蛋壳中加入食盐水制二氧化碳 B、用柠檬酸、果汁、白糖、水、小苏打等制汽水 C、用酒精浸泡捣烂的某些植物的花瓣制酸碱指示剂 D、用塑料瓶、小卵石、石英砂、活性炭、膨松棉等制作简易净水器8. 下列物质由离子构成的是( )A、铜 B、水 C、氯化钠 D、氖气9. 纳米铁粉在空气中能自燃并生成一种红色氧化物。对比铁丝在空气中不能燃烧,而在氧气中能剧烈燃烧的事实,某同学得出的下列结论错误的是( )A、纳米铁粉在空气中自燃的产物不是四氧化三铁 B、相同的反应物在不同条件下生成物可能不同 C、有些物质燃烧时温度不需要达到着火点 D、反应物间的接触面积大小是反应能否发生的因素之一10. 下列相关比较中,关系正确的是( )A、金属活动性:Fe<Cu B、沸点:氮气>氧气 C、pH:ω=1%NaOH液<ω=2%NaOH溶液 D、着火点:纸片>煤炭11. 下列离子在水中能大量共存,并形成无色溶液的是( )A、Fe2+、Na+、NO3-、Cl- B、H+、K+、SO42-、OH- C、H+、Na+、NO3-、Cl- D、Ba2+、NO3-、CO32- 、Cl-12. 下列推理正确的是( )A、离子是带电荷的粒子,所以带电荷的粒子一定是离子 B、氧化物是含氧元素的化合物,所以含氧元素的化合物一定是氧化物 C、H2和He质子数都是2,所以具有相同质子数的粒子不一定是同种元素 D、单质是由一种元素组成的物质,所以由一种元素组成的物质一定是单质13. 镧(La)是一种活动性比锌更强的金属,其元素在化合物中通常显+3 价,La(OH)3 是不溶于水的碱,LaCl3、La(NO3)3 都可溶于水。由此推断下列几组物质组合,不能直接反应制取 LaCl3 的是( )A、La 和稀盐酸 B、La2O3 和稀盐酸 C、La(OH)3 和氯化钾溶液 D、La(OH)3 和稀盐酸14. 烹制鱼时,同时加料酒和食醋能使鱼肉味香可口,这是因为两者发生了反应(未标明条件):C2H5OH+CH3COOH=H2O+CH3COOC2H5(乙酸乙酯)。下列四种说法正确的有( )①乙醇具有良好的导电性
②加水稀释食醋,溶液pH值变大
③能闻到香味,是分子受热体积膨胀的缘故
④乙酸乙酯由4个碳原子、8个氢原子和2个氧原子构成
A、1种 B、2种 C、3种 D、4种15. 下列物质的转化在给定条件下均能实现的是( )A、 B、 C、 D、16. T1℃时,将等质量的KNO3、KCl分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到T1℃,现象如图1、2所示。下列说法正确的是( ) A、甲中加入的固体是KNO3 B、甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液 C、将甲、乙中的物质混合,充分搅拌,一定有固体剩余 D、若将甲、乙的温度从T1℃升高到T2℃,两溶液中的溶质质量分数不一定相等17. 化学中有多种“守恒”。下面描述中对各种守恒的“解释”错误的是( )A、质量守恒——参加反应的各物质的质量总和等于反应后生成的各物质的质量总和 B、溶质守恒——溶液在稀释前后溶质的体积不变 C、元素守恒——化学反应前后元素的种类和质量不变 D、原子守恒——化学反应前后原子的种类及数目不变18. “宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如图所示,下列说法错误的是( )
A、甲中加入的固体是KNO3 B、甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液 C、将甲、乙中的物质混合,充分搅拌,一定有固体剩余 D、若将甲、乙的温度从T1℃升高到T2℃,两溶液中的溶质质量分数不一定相等17. 化学中有多种“守恒”。下面描述中对各种守恒的“解释”错误的是( )A、质量守恒——参加反应的各物质的质量总和等于反应后生成的各物质的质量总和 B、溶质守恒——溶液在稀释前后溶质的体积不变 C、元素守恒——化学反应前后元素的种类和质量不变 D、原子守恒——化学反应前后原子的种类及数目不变18. “宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如图所示,下列说法错误的是( ) A、从反应价值看:该反应能获取清洁能源,延缓温室效应 B、从物质分类看:该反应涉及到2种氧化物 C、从微观构成看:四种物质均由分子构成 D、从表示方法看:该反应的化学方程式为2CO2+4H2O 2CH4+4O219. 将草酸(H2C2O4),沸点约150℃,分解温度约190℃)隔绝空气加热,得到的混合物经充分冷却后,残余气体M(CO、CO2中的一种或两种)。为探究M的成分,设计如图所示实验。下列说法错误的是()
A、从反应价值看:该反应能获取清洁能源,延缓温室效应 B、从物质分类看:该反应涉及到2种氧化物 C、从微观构成看:四种物质均由分子构成 D、从表示方法看:该反应的化学方程式为2CO2+4H2O 2CH4+4O219. 将草酸(H2C2O4),沸点约150℃,分解温度约190℃)隔绝空气加热,得到的混合物经充分冷却后,残余气体M(CO、CO2中的一种或两种)。为探究M的成分,设计如图所示实验。下列说法错误的是()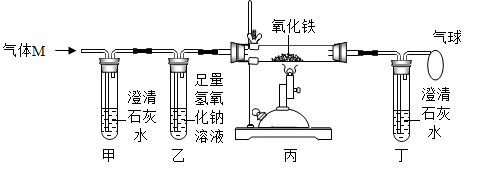 A、若甲试管内溶液变浑浊,则M中一定含有CO2 B、若丙中固体变黑、丁试管内溶液变浑浊,则M中一定含CO C、若装置甲、乙位置互换,则无法判断M中是否含有CO D、若加热所得混合物不经充分冷却,则M中可能混有草酸蒸气20. 有Cu2(OH)2CO3[Mr=222]与Cu的混合物25.4g,在空气中加热一段时间,得剩余固体23.1g,向该固体中加入300.0g9.8%的稀硫酸,固体完全溶解,测得反应过程中实际消耗9.8%的稀硫酸250.0g。下列说法正确的是( )A、剩余固体为纯净物 B、上述加热过程中共生成H2O和CO2的质量为2.3g C、原混合物中Cu2(OH)2CO3与Cu的质量比为111:16 D、最终所得溶液质量为318.7g
A、若甲试管内溶液变浑浊,则M中一定含有CO2 B、若丙中固体变黑、丁试管内溶液变浑浊,则M中一定含CO C、若装置甲、乙位置互换,则无法判断M中是否含有CO D、若加热所得混合物不经充分冷却,则M中可能混有草酸蒸气20. 有Cu2(OH)2CO3[Mr=222]与Cu的混合物25.4g,在空气中加热一段时间,得剩余固体23.1g,向该固体中加入300.0g9.8%的稀硫酸,固体完全溶解,测得反应过程中实际消耗9.8%的稀硫酸250.0g。下列说法正确的是( )A、剩余固体为纯净物 B、上述加热过程中共生成H2O和CO2的质量为2.3g C、原混合物中Cu2(OH)2CO3与Cu的质量比为111:16 D、最终所得溶液质量为318.7g二、填空题
-
21. 为减缓温室效应,我国计划在2060年实现“碳中和”的目标。碳排放无处不在,以手机为例。回答以下问题:(1)、手机中塑料、金属等材料的生产过程会排放CO2。
①塑料属于。
A 金属材料
B 天然有机高分子材料
C 合成有机高分子材料
D 无机非金属材料
②工业上用CO与赤铁矿(主要成分为Fe2O3)炼铁时会产生CO2 , 该反应的化学方程式为。
(2)、手机运输过程中使用的交通工具要消耗化石燃料。①化石燃料包括天然气、和煤。
②“CNG”汽车以天然气为燃料,其产生CO2的化学方程式为。
(3)、实现“碳中和”,一方面要减少CO2排放,另一方面要尽量吸收不可避免的碳排放。写出一种自然界中吸收CO2的化学方程式:。22. 在生活和化学实验中,人们经常用到各种除湿剂(干燥剂)(1)、硅胶:无色或白色颗粒,吸水量为30%~35%,可反复使用。其主要成分可看作是SiO2 , 其中Si元素的化合价为。(2)、生石灰:白色块状固体,吸水后生成熟石灰,该反应的化学方程式为。(3)、无水氯化钙:白色固体,有苦咸味,每千克吸水量为1kg~1.2kg。若1kg无水氯化钙吸收1.2kg水后得到氯化钙溶液,该溶液中溶质的质量分数为%(计算结果保留到0.1%)。(4)、浓硫酸:无色黏稠液体,有吸水性,在化学实验中常用它作干燥剂,浓硫酸吸水后溶液的质量(填“变大”“变小”或“不变”),溶质质量分数(填“变大”“变小”或“不变”)。(5)、还原铁粉:灰色或黑色粉末,又称“双吸剂”,它能够吸收空气中的 , 常用于食品保鲜。检验使用一段时间后的“双吸剂”是否仍有效的化学方法为。23. 元素周期表是学习和研究化学的重要工具。(1)、原子序数为1~18的元素在元素周期表中的位置如下表所示。第1周期
H
He
第2周期
Li
Be
B
C
N
O
F
Ne
第3周期
Na
Mg
Al
Si
P
S
Cl
Ar
①Al属于(填“金属”或“非金属”)元素,其原子的核电荷数为。
②画出Na原子的结构示意图。
(2)、根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价—物质类别”关系图。
①写出物质X的化学式:。
②写出由物质Y转化为CuSO4的化学反应方程式:。
三、综合题
-
24. 阅读下面的科普短文。
水是地球上最常见的物质之一,生命的孕育和维系都需要水,关于它的传闻有很多。
传闻1:自来水中有余氯,不能饮用
自来水从自来水厂到用户家可能需要经过几十公里的管道,为了保证水质,必须在水里加入一些消毒剂以防止细菌滋生。最常用的消毒剂就是氯气(Cl2),此外还有氯胺和二氧化氯(ClO2)等。根据世界卫生组织的余氯标准推算,如果氯全部来自于饮用水,则自来水中氯的允许含量为5mg/L.而根据我国《生活饮用水卫生标准》,水厂出厂水中余氯不得高于4mg/L.由于传输损失,管网末端用户处的自来水中余氯含量远低于允许上限。为维持消毒效果,国家规定管网末端自来水中余氯下限为0.05mg/L。
传闻2:煮过很多次的水有毒
有研究对多次煮沸水中亚硝酸盐情况进行实验分析,实验的数据如表所示。
表1 不同煮沸次数的水中亚硝酸盐含量(mg/L)
水样类型
亚硝酸盐含量
一次沸水
0.0008
二次沸水
0.0020
三次沸水
0.0028
人体长时间摄入超标的亚硝酸盐,会增加患癌症的可能性。但是在这个实验中可以看到,即使三次煮沸的水中,亚硝酸盐含量比我国天然矿泉水中亚硝酸盐标准(0.1mg/L)还低不少。从饮用水健康的角度来看,相比对开水中亚硝酸盐的忧虑,我们更应该注意如果不将水煮开,或者密封、储存方法不当,饮用水中可能存在细菌污染的隐患。
传闻3:常喝“富氧水”能够抗衰老
富氧水原是医学界为了研究生物细胞厌氧性和好氧性的研究用水,是通过人为地往纯净水里充入更多的氧气制成的。
对于富氧水对健康的影响,学术界存在争议。有研究认为若水中氧含量过高或常喝富氧水会加速氧化,使人体衰老。无论是吸氧还是喝氧,对健康人都是弊多利少。人们在“喝氧”的问题上应采取慎重态度,勿作非明智的选择。
依据文章内容回答下列问题。
(1)、为保证水质,可用的自来水消毒剂包括 。(2)、判断传闻1真假,并说明理由: 。(3)、依据文中数据,煮沸的水中亚硝酸盐含量的变化规律是 。(4)、传闻3的资料中,反映出的氧气性质有 。(5)、下列关于水的说法错误的是 (填字母序号)。A 如果自来水中含氯量过低,水中细菌就可能超标
B 因为多次煮沸的水含有亚硝酸盐,所以有毒而不能饮用
C “富氧水”中富含氧气,适合多喝。
25. 根据下列实验装置图,回答有关问题。 (1)、装置图中仪器①的名称为。(2)、用氯酸钾和二氧化锰混合共热制取氧气的化学方程式为。(3)、实验室利用B装置制取二氧化碳的化学方程式为 , 如果利用G装置收集二氧化碳,气体应从端通入(填“a”或“b”),用C装置代替B装置,收集满气体后,C装置的操作是。(4)、如图所示,向集满CO2的试管内倒入约占试管容积三分之一的澄清石灰水,旋紧胶塞,上、下持续振荡一定时间。
(1)、装置图中仪器①的名称为。(2)、用氯酸钾和二氧化锰混合共热制取氧气的化学方程式为。(3)、实验室利用B装置制取二氧化碳的化学方程式为 , 如果利用G装置收集二氧化碳,气体应从端通入(填“a”或“b”),用C装置代替B装置,收集满气体后,C装置的操作是。(4)、如图所示,向集满CO2的试管内倒入约占试管容积三分之一的澄清石灰水,旋紧胶塞,上、下持续振荡一定时间。
①充分振荡后,试管内压强试管外大气压强(选填“>”或“=”或“<”);
②振荡试管前,旋紧胶塞的目的是:、。
(5)、为研究二氧化碳能否与氢氧化钠发生反应,进行以下探究。①采用下图装置进行实验通入二氧化碳后,看到现象,说明二氧化碳与氢氧化钠发生反应;若对原装置改动继续实验,看到氢氧化钡溶液变浑浊,也能达到目的,改进的方法是。

②若将二氧化碳通入氢氧化钠的酒精溶液,观察到溶液由澄清变浑浊,解释原因。
26. 实验室以软锰矿(主要成分为MnO2 , 还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图: (1)、“酸浸”目的是除去MnO2中的杂质,需要加热的目的是 (任写一条);此过程中发生的化学反应方程式是。(2)、“熔融”过程中,MnO2被氧化成K2MnO4 , 同时得到KCl,①该反应的化学方程式为。
(1)、“酸浸”目的是除去MnO2中的杂质,需要加热的目的是 (任写一条);此过程中发生的化学反应方程式是。(2)、“熔融”过程中,MnO2被氧化成K2MnO4 , 同时得到KCl,①该反应的化学方程式为。②加入KClO3应过量的原因除了提高MnO2利用率,还有。
(3)、浸取后为了得到较纯净的KMnO4晶体,通过蒸发浓缩、冷却结晶、过滤出KCl溶液,将晶体洗涤、低温烘干等一系列操作,其中采用低温烘干的原因是 , 写出“浸取”过程中,Cl2和K2MnO4的反应方程式。(4)、在氧化、还原反应中,氧化剂的元素化合价降低,还原剂的元素化合价升高,以上流程中起到氧化作用的物质是。27. 绿矾(FeSO4·7H2O),在医药、净水、化肥、农药等方面有广泛的应用。化学小组的同学在用绿矾配制FeSO4溶液时发现,溶液颜色会由绿变黄,于是开展了以下探究活动。(查阅资料)
i.FeSO4溶液如果长时间显露在空气中,会与氧气发生反应转换成Fe2(SO4)3 , 色泽由最初的浅绿色或淡绿色转变成黄色。反应生成的Fe2(SO4)3遇KSCN溶液会变红。
ii.保存FeSO4溶液时要加入稀硫酸和铁钉,置于阴凉处。
(提出猜想)
影响FeSO4溶液与氧气反应速率的因素可能有温度、浓度、溶液酸碱性、是否有铁钉等。
(进行实验)
编号
实验
0min
30min
2h
①

溶液为浅绿色
溶液略显黄色
溶液黄色略有加深
②

溶液为浅绿色
溶液明显变黄
溶液黄色明显加深
③

溶液立即变黄
④

溶液为浅绿色
溶液明显变黄,振荡后无变化
溶液黄色明显加深,振荡无变化
⑤

溶液为浅绿色
溶液为浅绿色
溶液为浅绿色;滴加KSCN溶液后,略显红色
⑥

溶液为浅绿色
溶液为浅绿色
溶液为浅绿色;滴加KSCN溶液后,略显红色,振荡后溶液变为浅绿色
(解释与结论)
(1)、FeSO4溶液为浅绿色或淡绿色,Fe2(SO4)3溶液为黄色,可见这两种盐溶液的颜色差异与元素有关。(2)、实验①中实验温度T=℃。(3)、通过对比实验②和③,得出的结论是。(4)、欲得出“稀硫酸和铁钉共同存在下才能有效防止FeSO4溶液变质”的结论,需要对比(填写实验编号)。(5)、写出实验⑤中,FeSO4溶液变质的化学方程式。(6)、下列说法正确的是。A 其他条件相同,溶液酸性增强,FeSO4溶液变质加快
B 其他条件相同,FeSO4溶液浓度越大,变质越快
C 实验⑥中,滴加KSCN溶液后,略显红色,振荡后溶液变为浅绿色,可能是发生了反应
四、计算题
-
28. 取某酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如下图所示。(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)
 (1)、P点对应溶液中一定存在的阳离子有(填离子符号)。(2)、酸性废水中硫酸的质量分数为(用百分数表示,保留到0.1%)(3)、计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示保留到0.1%)。
(1)、P点对应溶液中一定存在的阳离子有(填离子符号)。(2)、酸性废水中硫酸的质量分数为(用百分数表示,保留到0.1%)(3)、计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示保留到0.1%)。