江苏省常州市2021年中考化学二模试卷
试卷更新日期:2021-07-05 类型:中考模拟
一、单选题
-
1. 下列事例中属于物理变化的是( )A、石蜡熔化 B、纸张燃烧 C、粮食酿酒 D、金属生锈2. 下列气体含量过多会引起温室效应的是( )A、氧气 B、氮气 C、稀有气体 D、二氧化碳3. 膳食中营养搭配有利于人体健康。下列食品含维生素相对较多的是( )A、奶油蛋糕 B、碱面馒头 C、凉拌黄瓜 D、清蒸鲈鱼4. 人体缺乏下列哪种元素会引起骨质疏松( )A、钙 B、铁 C、锌 D、碘5. 下列物质溶于水,能使溶液温度降低的是( )A、硝酸铵 B、氧化钙 C、氢氧化钠 D、浓硫酸6. 从物质分类角度看,阻燃剂氢氧化镁(Mg(OH)2)属于( )A、氧化物 B、盐 C、碱 D、酸7. 2019年8月《Science》杂志报道,科学家合成了一种环状碳分子C18 , 这种分子具有广泛的应用前景。1个环状碳分子C18中共含有18个( )A、原子 B、质子 C、中子 D、电子8. 物质的性质决定物质的用途。下列物质的性质和用途一一对应的是( )A、石墨有滑腻感一一作电极 B、金刚石硬度大一一作装饰品 C、氧气能支持燃烧一一用于潜水 D、一氧化碳有可燃性一一作燃料9. 花青素(化学式C15H11O6)具有缓解眼睛疲劳,保护视力的作用,该物质主要来源于各种蔬菜和水果,下列关于花青素的说法正确的是( )A、花青素是一种无机物 B、花青素的相对分子质量是287g C、花青素中的C、H、O元素质量比是15:11:6 D、花青素在氧气中充分燃烧后生成二氧化碳和水10. 下列有关元素、原子、分子和离子的说法正确的是( )A、决定元素种类的是原子的核电荷数 B、原子可以构成分子,不能直接构成物质 C、分子是化学变化中最小的微粒 D、由同一种元素组成的物质一定是单质11. 下列说法正确的是( )A、煤属于化石能源,取之不尽,用之不竭 B、为减少“白色污染”,提倡自带布袋购物 C、铁制品生锈后,应及时用水将铁锈洗去 D、推广使用新能源汽车,根本目的是使用新材料12. 下列实验操作正确的是( )A、加热液体
 B、氧气验满
B、氧气验满  C、稀释浓硫酸
C、稀释浓硫酸  D、检查气密性
D、检查气密性  13. 下列事件的处理方法正确的是( )A、厨房煤气漏气,点燃打火机检查 B、家用电器着火,用水浇灭 C、扑灭森林火灾,设置隔离带 D、图书起火,立即用泡沫灭火器扑灭14. 甲烷与二氧化碳在一定条件下发生如图所示的反应,下列说法中错误的是( )
13. 下列事件的处理方法正确的是( )A、厨房煤气漏气,点燃打火机检查 B、家用电器着火,用水浇灭 C、扑灭森林火灾,设置隔离带 D、图书起火,立即用泡沫灭火器扑灭14. 甲烷与二氧化碳在一定条件下发生如图所示的反应,下列说法中错误的是( ) A、使用催化剂可加快该反应的速率 B、该反应的生成物是C2H4O2 C、反应前后原子和分子的数目均未改变 D、
A、使用催化剂可加快该反应的速率 B、该反应的生成物是C2H4O2 C、反应前后原子和分子的数目均未改变 D、 的水溶液呈酸性
15. 下列四种离子在水中能大量共存,且形成无色溶液的是()A、Cu2+ SO42- Ag+ Cl- B、H+ Na+ K+ NO3- C、H+ Ba2+ NO3- CO32- D、Mg2+ Cl- OH- Na+16. 某同学在探究X、Y、Z三种金属的活动性顺序时,做了如下实验,①把X和Y分别放入稀硫酸中。X表面产生大量气泡,Y表面无明显现象:②将Y放入Z的硝酸盐溶液中,Y表面有Z析出。下列金属活动性由强到弱的顺序正确的是( )A、Z>Y>X B、X>Z>Y C、X>Y>Z D、Y>Z>X17. 制作叶脉书签需配制100g溶质质量分数为12%的NaOH溶液,下列操作正确的是( )A、在左右托盘上垫滤纸称取12.0 g NaOH固体 B、将准确称取的NaOH固体直接倒入装有水的量筒中搅拌、溶解 C、选用100mL的量筒量取88.0mL的水 D、配好的溶液及时装入广口瓶,塞上玻璃塞18. t℃时,某物质在不同质量的水中恰好达到饱和状态时所溶解的质量关系如图。说法正确的是()
的水溶液呈酸性
15. 下列四种离子在水中能大量共存,且形成无色溶液的是()A、Cu2+ SO42- Ag+ Cl- B、H+ Na+ K+ NO3- C、H+ Ba2+ NO3- CO32- D、Mg2+ Cl- OH- Na+16. 某同学在探究X、Y、Z三种金属的活动性顺序时,做了如下实验,①把X和Y分别放入稀硫酸中。X表面产生大量气泡,Y表面无明显现象:②将Y放入Z的硝酸盐溶液中,Y表面有Z析出。下列金属活动性由强到弱的顺序正确的是( )A、Z>Y>X B、X>Z>Y C、X>Y>Z D、Y>Z>X17. 制作叶脉书签需配制100g溶质质量分数为12%的NaOH溶液,下列操作正确的是( )A、在左右托盘上垫滤纸称取12.0 g NaOH固体 B、将准确称取的NaOH固体直接倒入装有水的量筒中搅拌、溶解 C、选用100mL的量筒量取88.0mL的水 D、配好的溶液及时装入广口瓶,塞上玻璃塞18. t℃时,某物质在不同质量的水中恰好达到饱和状态时所溶解的质量关系如图。说法正确的是()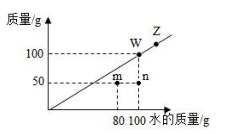 A、该物质的溶解度随温度的升高而增大 B、点Z→W移动的一种方法是恒温蒸发一定量的水并过滤 C、将m点的溶液变为饱和溶液的一种方法是加入20g溶质 D、图中4个点的溶液中溶质质量分数关系是:n<m<w<z19. FeCl3溶液常用于蚀刻印刷电路,反应原理为 。向含溶质32.5g的FeCl3溶液中慢慢加入一定量的Cu粉,反应过程中FeCl3、CuCl2的质量随Cu粉质量变化如图.下列说法正确的是( )
A、该物质的溶解度随温度的升高而增大 B、点Z→W移动的一种方法是恒温蒸发一定量的水并过滤 C、将m点的溶液变为饱和溶液的一种方法是加入20g溶质 D、图中4个点的溶液中溶质质量分数关系是:n<m<w<z19. FeCl3溶液常用于蚀刻印刷电路,反应原理为 。向含溶质32.5g的FeCl3溶液中慢慢加入一定量的Cu粉,反应过程中FeCl3、CuCl2的质量随Cu粉质量变化如图.下列说法正确的是( ) A、X的化学式为FeCl3 B、化学方程式中化学计量数a:b=2:3 C、完全反应后,生成CuCl2的质量为27g D、随着反应的进行,溶液颜色逐渐由黄色变为蓝绿色20. 将一定量的CaCO3和Cu粉置于一敞口容器中,加热煅烧,使其充分反应,反应前后容器内固体质量未变,则容器中Cu和CaCO3的质量比是( )A、44:25 B、20:4 C、11 :4 D、16 :25
A、X的化学式为FeCl3 B、化学方程式中化学计量数a:b=2:3 C、完全反应后,生成CuCl2的质量为27g D、随着反应的进行,溶液颜色逐渐由黄色变为蓝绿色20. 将一定量的CaCO3和Cu粉置于一敞口容器中,加热煅烧,使其充分反应,反应前后容器内固体质量未变,则容器中Cu和CaCO3的质量比是( )A、44:25 B、20:4 C、11 :4 D、16 :25二、填空题
-
21. 化学与我们的生活密切相关,请从下列物质中选择合适的字母序号填空。
A盐酸 B氯化钠 C聚氯乙烯 D聚乙烯 E干冰
(1)、人体胃液中含有的酸是;(2)、可用作灭火的是;(3)、可用作包装食品的是;(4)、可作厨房调味品的是;22. 厨房里的“锅碗瓢盆”和“柴米油盐”包含着许多的化学知识。(1)、水的硬度影响着人们的生活,用可以鉴别硬水和软水。(2)、炒菜时油锅中的油不慎着火,可用锅盖盖灭,原理是。(3)、锅碗里有油脂时,用水洗不干净,这说明油脂具有的物理性质。(4)、家用燃料天然气(CH4)在燃烧过程中,如果锅底出现黑灰,此时应将燃气进口的阀门(填“调大”“调小”),以免造成一氧化碳中毒。23. 波尔多液是由硫酸铜溶液和石灰乳按一定比例混合而成的一种保护性杀菌剂,广泛应用于蔬菜、果树等的病害防治。(1)、配制波尔多液时不能用铁质容器,原因是(用化学方程式表示);(2)、喷洒波尔多液后,未到采摘期的蔬果表面常有一些用水很难溶解的蓝色斑点。该蓝色斑点的主要成分是(填化学式),可用厨房中的浸泡除去。(3)、波尔多液具有杀菌作用,主要是因为波尔多液中含有元素。24. 如图是KNO3和NaCl的溶解度曲线,试回答下列问题。 (1)、曲线B表示(填“KNO3”或“NaCl”)。(2)、70℃时溶解度A(填“<”“>”“=”)B。(3)、除去KNO3中混入的少量NaCl,可采用方法。(4)、40℃时30gA放入100g水中,充分溶解,所得溶液的溶质质量分数=(计算结果精确到0.1%,下同)。(5)、10℃时在四个烧杯中分别放入等质量的固体A,分别倒入不同质量的水,充分搅拌,倒入水的质量以及固体A剩余的情况如下表所示。
(1)、曲线B表示(填“KNO3”或“NaCl”)。(2)、70℃时溶解度A(填“<”“>”“=”)B。(3)、除去KNO3中混入的少量NaCl,可采用方法。(4)、40℃时30gA放入100g水中,充分溶解,所得溶液的溶质质量分数=(计算结果精确到0.1%,下同)。(5)、10℃时在四个烧杯中分别放入等质量的固体A,分别倒入不同质量的水,充分搅拌,倒入水的质量以及固体A剩余的情况如下表所示。烧杯编号
1
2
3
4
倒入水的质量/g
25
50
100
200
剩余固体情况
有
有
无
无
则4号烧杯所得溶液中溶质质量分数(ω)的取值范围是。
三、综合题
-
25. 利用图所示实验装置对酸的化学性质进行探究。
 (1)、标号为①的仪器名称是。(2)、实验Ⅰ中,在点滴板的a、b穴中滴入稀盐酸后,溶液变红的是(填“a”“b”)。(3)、实验Ⅱ中,在仪器①、②中均可观察到的现象是。仪器②中发生反应的化学方程式是。(4)、用100g溶质质量分数为10.95%的废盐酸,最多可以除去多少铁锈(以Fe2O3计)。
(1)、标号为①的仪器名称是。(2)、实验Ⅰ中,在点滴板的a、b穴中滴入稀盐酸后,溶液变红的是(填“a”“b”)。(3)、实验Ⅱ中,在仪器①、②中均可观察到的现象是。仪器②中发生反应的化学方程式是。(4)、用100g溶质质量分数为10.95%的废盐酸,最多可以除去多少铁锈(以Fe2O3计)。四、科学探究题
-
26. 化学兴趣小组利用图所示装置进行“可燃物燃烧条件”的探究实验。

(实验步骤)①将所需仪器按照装置图连接起来并检查气密性良好;②将实验所需药品(足量)加入对应的仪器中;③将装有适量白磷的具支试管放入冰水中;④打开K1 , 关闭K2 , 观察现象;⑤关闭K1 , 打开K2 , 观察现象;⑥将左侧烧杯中的冷水换成80℃的热水,观察现象;⑦打开K1 , 关闭K2 , 观察现象。
(1)、(问题解答)
本实验用甲乙装置制取气体,具有的明显优势是。(2)、装置甲中发生反应的化学方程式是。(3)、步骤⑤中,观察到澄清石灰水变浑浊时才可以进行步骤⑥,这样做的目的是。(4)、步骤⑦观察到的实验现象是。(5)、(实验分析)对比分析步骤可知:可燃物温度达到着火点时才有可能燃烧;
(6)、对比分析步骤⑥⑦可知:。27. 某混合气体可能有CO2、CO、H2中的一种或几种,某学习小组的同学为了研究气体的组成,设计了如图装置进行实验(夹持装置已省略)。实验后发现A装置中溶液变浑浊,C中的固体由黑色变红色,D中的固体由白色变蓝色,F装置中有水流入烧杯。(已知:白色无水硫酸铜固体遇水变成蓝色)。
在反应前后对C、D装置进行了质量的测量(各步反应均完全),测量结果如表:
反应前后
反应前后的质量差
C装置中试管与固体的总质量(克)
△C
D装置中U形管与固体的总质量(克)
△D
(1)、A装置中发生反应的化学方程式是 , 其作用是。(2)、能证明混合气体中有氢气存在的实验现象是。(3)、F装置的作用:①“抽气”;②。(4)、证明原混合气体中有CO存在的定量关系是(用△C和△D的代数式表示。)28. 实验课上,同学们利用澄清石灰水检验空气中的二氧化碳,实验中发现各组石灰水浑浊程度存在较大差异,于是设计实验探究影响石灰水浑浊程度的因素。(查阅资料)本实验条件下CO2气体的密度是2g/L。
(进行实验)装置图如图所示。

实验1:取饱和澄清石灰水进行实验。
实验序号
1-1
1-2
1-3
1-4
饱和澄清石灰水体积/mL
2.0
1.5
1.0
0.5
缓慢通入2L空气后的浑浊程度
不明显
明显
非常明显
明显
实验2:利用向饱和石灰水中添加蒸馏水来调节石灰水的浓度进行实验(溶液浓度变化引起的溶液密度变化忽略不计)。
实验序号
2-1
2-2
2-3
2-4
饱和澄清石灰水体积/mL
2.0
1.5
1.0
0.5
加入蒸馏水体积/mL
0
a
b
c
缓慢通入3L空气后的浑浊程度
非常明显
明显
不明显
无现象
(1)、(解释与结论)小试管中发生反应的化学方程式为。
(2)、实验1的目的为。(3)、实验2中a、b、c三处数据,设计合理的是。A .0.5 0.5 0.5 B. 0.5 1.0 1.5
C .1.0 1.5 2.0 D. 1.0 2.0 3.0
(4)、实验2的结论是。(5)、(反思与评价)通过对比实验1-1和2-1,可得出影响石灰水浑浊程度的另一因素是 , 理由是。
(6)、(拓展延伸)同学们查阅资料得知: 。于是他们又补充做了下列一组实验。实验3:室温下,向含0.074gCa(OH)2的澄清石灰水中缓慢、匀速通入CO2气体,记录不同时间点的实验现象。
实验序号
3-1
3-2
3-3
3-4
3-5
缓慢通入CO2的时间
第10s
第20s
第25s
第30s
t
缓慢通入CO2后的浑浊程度
稍浑浊
浑浊
最浑浊
稍浑浊
恰好完全澄清
由此可以推知Ca(HCO3)2的一条物理性质是。
(7)、实验中通入CO2气体的速度是mL/s。(8)、上表中t=s。29. 碳酸锰(MnCO3)是一种高性能磁性材料。以软锰矿粉(主要含MnO2 , 还含有少量的Fe2O3、Al2O3等杂质)为原料制取MnCO3的流程如图。 (1)、“酸浸”时发生的主要反应为 ,X的化学式为;“酸浸”时Al2O3发生反应的化学方程式为。(2)、流程中虚线内工序的主要目的是。(3)、“沉锰”发生的反应是 。如上图为MnCO3的产率与溶液酸碱度pH、反应时间t的关系,由图可知将溶液酸碱度控制在pH=7进行反应,既有利于 , 又有利于。(4)、“过滤Ⅱ”后续的操作为洗涤、干燥,证明MnCO3固体是否洗涤干净的一种操作方法是:取少量洗涤液于试管中,滴加适量NaOH溶液并加热,在试管口放 , 如果没有明显现象,说明。
(1)、“酸浸”时发生的主要反应为 ,X的化学式为;“酸浸”时Al2O3发生反应的化学方程式为。(2)、流程中虚线内工序的主要目的是。(3)、“沉锰”发生的反应是 。如上图为MnCO3的产率与溶液酸碱度pH、反应时间t的关系,由图可知将溶液酸碱度控制在pH=7进行反应,既有利于 , 又有利于。(4)、“过滤Ⅱ”后续的操作为洗涤、干燥,证明MnCO3固体是否洗涤干净的一种操作方法是:取少量洗涤液于试管中,滴加适量NaOH溶液并加热,在试管口放 , 如果没有明显现象,说明。
-