浙教版科学八上第一章第5节 物质的溶解同步练习(优生加练)
试卷更新日期:2021-07-04 类型:同步测试
一、单选题
-
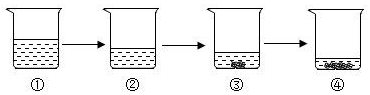
1. 20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分到溶解,实验过程如图所示。下列分析正确的是( )
 A、甲烧杯中,硝酸钾溶液是不饱和溶液 B、丁烧杯中,硝酸钾溶液是不饱和溶液 C、乙→丙过程中,硝酸钾溶液的溶质质量分数变大 D、丙→丁过程中,硝酸钾溶液的溶质质量分数变大2. 20℃时,KCl 和 KNO3 的溶解度分别为 34g 和 31.6g。小金在 20℃时进行了如图所示的操作,得到溶液①②③④。下列有关溶液①~④的分析错误的是( )
A、甲烧杯中,硝酸钾溶液是不饱和溶液 B、丁烧杯中,硝酸钾溶液是不饱和溶液 C、乙→丙过程中,硝酸钾溶液的溶质质量分数变大 D、丙→丁过程中,硝酸钾溶液的溶质质量分数变大2. 20℃时,KCl 和 KNO3 的溶解度分别为 34g 和 31.6g。小金在 20℃时进行了如图所示的操作,得到溶液①②③④。下列有关溶液①~④的分析错误的是( )
 A、属于 20℃时的饱和溶液的是②和④ B、溶质的质量相等的是②和④ C、溶液的溶质质量分数相等的是①和③ D、溶液的质量②﹥④﹥③=①3. 如图是A、B两物质的溶解度曲线,下列信息中正确的是( )
A、属于 20℃时的饱和溶液的是②和④ B、溶质的质量相等的是②和④ C、溶液的溶质质量分数相等的是①和③ D、溶液的质量②﹥④﹥③=①3. 如图是A、B两物质的溶解度曲线,下列信息中正确的是( ) A、图中阴影部分表明A,B两溶液都是饱和溶液 B、t1℃时,A,B两饱和溶液的溶质质量分数相等 C、t2℃时,B物质的溶解度大于A物质的溶解度 D、t2℃时,等质量的A,B两饱和溶液降温到t1℃时析出溶质的质量相等4. 如图是甲、乙两种固体物质的溶解度曲线。下列说法中错误的是( )
A、图中阴影部分表明A,B两溶液都是饱和溶液 B、t1℃时,A,B两饱和溶液的溶质质量分数相等 C、t2℃时,B物质的溶解度大于A物质的溶解度 D、t2℃时,等质量的A,B两饱和溶液降温到t1℃时析出溶质的质量相等4. 如图是甲、乙两种固体物质的溶解度曲线。下列说法中错误的是( ) A、20℃时,甲、乙饱和溶液中溶质质量分数相等 B、40℃时,甲的溶解度大于乙的溶解度 C、40℃时,乙的饱和溶液中溶质的质量分数为40% D、将40℃甲的饱和溶液降温到20℃,会有晶体析出5. 20℃时,有质量分数为5%的食盐溶液A和质量分数为26.47%的食盐溶液B,下列有关A、B两种食盐溶液的判断正确的是( )A、向m g溶液B中加入x g食盐,振荡后,溶液的质量不变,则食盐在20℃时的溶解度为36 B、等质量的A,B中,溶剂质量:B>A C、m g溶液B中的溶质质量为 g D、向m g溶液A中加入x g食盐,振荡后,溶液的质量大于m g6. 分别取20℃时氢氧化钙的饱和溶液和硝酸钾饱和溶液x g,各加热蒸发掉y g水,再恢复至20℃,对于所得两溶液说法错误的是( )A、氢氧化钙溶液质量分数比蒸发前小 B、硝酸钾溶液溶质质量分数与蒸发前相等 C、氢氧化钙溶液的质量比硝酸钾大 D、硝酸钾溶液的质量分数比氢氧化钙大7. 如图所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )
A、20℃时,甲、乙饱和溶液中溶质质量分数相等 B、40℃时,甲的溶解度大于乙的溶解度 C、40℃时,乙的饱和溶液中溶质的质量分数为40% D、将40℃甲的饱和溶液降温到20℃,会有晶体析出5. 20℃时,有质量分数为5%的食盐溶液A和质量分数为26.47%的食盐溶液B,下列有关A、B两种食盐溶液的判断正确的是( )A、向m g溶液B中加入x g食盐,振荡后,溶液的质量不变,则食盐在20℃时的溶解度为36 B、等质量的A,B中,溶剂质量:B>A C、m g溶液B中的溶质质量为 g D、向m g溶液A中加入x g食盐,振荡后,溶液的质量大于m g6. 分别取20℃时氢氧化钙的饱和溶液和硝酸钾饱和溶液x g,各加热蒸发掉y g水,再恢复至20℃,对于所得两溶液说法错误的是( )A、氢氧化钙溶液质量分数比蒸发前小 B、硝酸钾溶液溶质质量分数与蒸发前相等 C、氢氧化钙溶液的质量比硝酸钾大 D、硝酸钾溶液的质量分数比氢氧化钙大7. 如图所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )
 A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,氯化钠的质量分数不断减小 D、在②→④过程中,氯化钠的质量分数先不变后增大8. 甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是( )
A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,氯化钠的质量分数不断减小 D、在②→④过程中,氯化钠的质量分数先不变后增大8. 甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法正确的是( )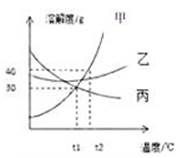 A、t1℃时,相同质量的甲、丙溶液中溶质质量一定相同 B、若甲物质中含有少量乙,可用降温结晶的方法提纯甲 C、将100g甲的饱和溶液从t2℃降温到t1℃,可析岀10g甲物质 D、将甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,所得溶液的溶质质量分数由大到小的顺序为乙>甲=丙9. 20℃时,取甲、乙、丙、丁四种纯净物(不与水反应)各20g,分别加入到四个各盛有50g水的烧杯中,充分溶解,其溶解情况如右表,则下列说法正确的是( )
A、t1℃时,相同质量的甲、丙溶液中溶质质量一定相同 B、若甲物质中含有少量乙,可用降温结晶的方法提纯甲 C、将100g甲的饱和溶液从t2℃降温到t1℃,可析岀10g甲物质 D、将甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,所得溶液的溶质质量分数由大到小的顺序为乙>甲=丙9. 20℃时,取甲、乙、丙、丁四种纯净物(不与水反应)各20g,分别加入到四个各盛有50g水的烧杯中,充分溶解,其溶解情况如右表,则下列说法正确的是( )物质
甲
乙
丙
丁
未溶解固体的质量/g
4.2
2
0
9.2
A、所得四杯溶液都是饱和溶液 B、20℃时四种物质溶解度的关系为:丙>丁>甲>乙 C、丙溶液的溶质质量分数最大 D、四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液10. 已知甲、乙两种物质的溶解度(S甲、S乙)均随着温度的升高而增大.10℃时,20克水中最多能溶解5克甲;30℃时,乙物质的饱和溶液中溶质的质量分数为20%,那么,在20℃时进行比较,正确的是( )A、S甲=S乙 B、S甲>S乙 C、S甲<S乙 D、无法确定11. 如图是甲、乙、丙三种物质的溶解度曲线.下列说法错误的是( ) A、要配制相同质量分数的甲、丙两种物质的饱和溶液,应该将温度控制在t1℃ B、要从甲物质的饱和溶液中获得晶体甲,可以采用降温结晶的方法 C、t2℃时,30g甲物质加入到50g水中不断搅拌,形成的溶液中溶质的质量分数是37.5% D、t1℃时,将三种物质的饱和溶液升温至t2℃,所得溶液中溶质质量分数乙>甲>丙12. 有一固体物质(不含结晶水)的溶液甲,在一定温度下经历如下变化( )
A、要配制相同质量分数的甲、丙两种物质的饱和溶液,应该将温度控制在t1℃ B、要从甲物质的饱和溶液中获得晶体甲,可以采用降温结晶的方法 C、t2℃时,30g甲物质加入到50g水中不断搅拌,形成的溶液中溶质的质量分数是37.5% D、t1℃时,将三种物质的饱和溶液升温至t2℃,所得溶液中溶质质量分数乙>甲>丙12. 有一固体物质(不含结晶水)的溶液甲,在一定温度下经历如下变化( ) A、该温度下,固体物质的溶解度是30g B、溶液丙再蒸发10g水,析出晶体质量一定大于3g C、溶液乙一定是不饱和溶液 D、溶液乙和溶液丙中的溶质质量分数可能相等13. 20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100克水的烧杯中。图①为充分搅拌后的现象,图②为加热到50℃时的现象(不考虑水分蒸发),图③是甲、乙两种物质的溶解度。下列说法正确的是( )
A、该温度下,固体物质的溶解度是30g B、溶液丙再蒸发10g水,析出晶体质量一定大于3g C、溶液乙一定是不饱和溶液 D、溶液乙和溶液丙中的溶质质量分数可能相等13. 20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100克水的烧杯中。图①为充分搅拌后的现象,图②为加热到50℃时的现象(不考虑水分蒸发),图③是甲、乙两种物质的溶解度。下列说法正确的是( ) A、 图③中N表示的是甲物质的溶解度 B、20℃时,图①中乙的溶液一定是不饱和溶液 C、50℃时,图②中两溶液溶质质量分数一定相等 D、图②中两溶液从50℃降温至30℃都会析出晶体14. 甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A、 图③中N表示的是甲物质的溶解度 B、20℃时,图①中乙的溶液一定是不饱和溶液 C、50℃时,图②中两溶液溶质质量分数一定相等 D、图②中两溶液从50℃降温至30℃都会析出晶体14. 甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )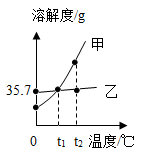
①常温下,乙易溶于水
②甲溶液中溶质的质量分数比乙大
③从t2℃降至t1℃,甲溶液中有晶体析出
④甲的溶解度受温度的影响程度比乙大
A、①② B、③④ C、②③ D、①④15. 常温下,对100mL氯化钠的饱和溶液进行图示实验。下列分析错误的是( ) A、实验2后,甲中溶液为氯化钠的不饱和溶液 B、实验2后,乙中比甲中氯化钠的溶解度大 C、实验2后,甲、乙中溶液的溶质质量分数不相等 D、实验1后的甲和实验2后的乙中溶液所含溶质质量相等16. 某物质A的溶解度曲线如图所示,现有20℃的100克物质A的饱和溶液样品若干份,下列说法或措施正确的有( )
A、实验2后,甲中溶液为氯化钠的不饱和溶液 B、实验2后,乙中比甲中氯化钠的溶解度大 C、实验2后,甲、乙中溶液的溶质质量分数不相等 D、实验1后的甲和实验2后的乙中溶液所含溶质质量相等16. 某物质A的溶解度曲线如图所示,现有20℃的100克物质A的饱和溶液样品若干份,下列说法或措施正确的有( )
①取样品升高温度至60℃将变为不饱和溶液
②取样品降温度至10℃仍是饱和溶液
③取样品升温至60℃,加入80克物质A,固体恰好全部溶解
④加入20克水降温度至0℃仍是饱和溶液
⑤蒸发掉20克水,再恢复到20℃仍是饱和溶液
⑥配置图中C状态下的此溶液100g,需要的水比100g样品中含有的水要少
A、三种 B、四种 C、五种 D、六种17. M是硝酸钾或氯化铵其中的一种,硝酸钾和氯化铵在不同温度(t0<t1<t2)时的溶解度如下图所示: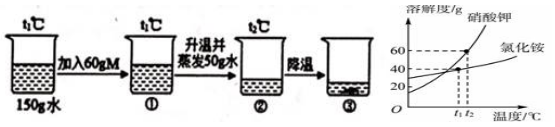
某科学兴趣小组用物质M进行了如图所示实验。下列说法不正确的是( )
A、物质M是硝酸钾 B、溶液①为不饱和溶液,溶液②和③为饱和溶液 C、溶液②中溶质质量分数为37.5% D、溶液①②③中,溶质质量分数的关系是②>③>①18. 如图所示为蒸发氯化钠溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( ) A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,水的质量分数不断增大 D、在②→④过程中,氯化钠的质量分数先不变后增大19. 70℃时的mg硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃并保持温度不变.能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是( )A、
A、在①→②过程中,氯化钠的质量分数保持不变 B、在②→③过程中,氯化钠的溶解度不断增大 C、在③→④过程中,水的质量分数不断增大 D、在②→④过程中,氯化钠的质量分数先不变后增大19. 70℃时的mg硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃并保持温度不变.能正确表示此过程中溶质质量分数(x%)与时间(t)的关系的示意图是( )A、
B、
B、
C、
C、
D、
D、
20. 小孟在配置食盐水时,记录实验数据如下表:则下列叙述正确的是( )
20. 小孟在配置食盐水时,记录实验数据如下表:则下列叙述正确的是( )实验序号
水的质量(g)
加入食盐的质量(g)
溶液的质量(g)
①
10
2
12
②
10
3
13
③
10
4
13.6
④
10
5
13.6
A、①所得溶液的溶质质量分数为20% B、②中所得溶液是不饱和溶液 C、实验中10g水最多能溶解4g食盐 D、溶质质量分数大小关系为④>③>②>①二、填空题
-
21. 20℃时,取相同质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图1所示。图2为a、b、c三种物质的溶解度曲线。请仔细阅读图1和图2回答下列问题:
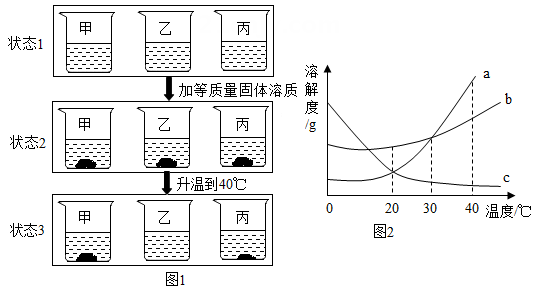 (1)、三种物质的溶解度关系为b>a>c时的温度为t℃,则t的取值范围是。(2)、烧杯甲里是物质的溶液。(3)、各种状态下,各烧杯(甲、乙、丙)里的溶液中溶质质量分数的比较一定正确的是__________。A、甲(状态2)>甲(状态1) B、乙(状态1)>甲(状态3) C、甲(状态1)<乙(状态2) D、乙(状态1)>丙(状态3)22. 分析处理图表中的信息是学习化学的一种重要方法。如表是氯化钠,碳酸钠和硝酸钠在不同温度时的溶解度,根据此表回答:
(1)、三种物质的溶解度关系为b>a>c时的温度为t℃,则t的取值范围是。(2)、烧杯甲里是物质的溶液。(3)、各种状态下,各烧杯(甲、乙、丙)里的溶液中溶质质量分数的比较一定正确的是__________。A、甲(状态2)>甲(状态1) B、乙(状态1)>甲(状态3) C、甲(状态1)<乙(状态2) D、乙(状态1)>丙(状态3)22. 分析处理图表中的信息是学习化学的一种重要方法。如表是氯化钠,碳酸钠和硝酸钠在不同温度时的溶解度,根据此表回答:温度/℃
10
20
30
40
50
60
70
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
37
37.3
37.8
碳酸钠
12.2
21.8
39.7
53.2
硝酸钾
20.9
31.6
45.8
63.9
85.5
110
138
(1)、20℃时,氯化钠的溶解度为g,此时若将20克的氯化钠倒入50克水中,充分溶解,配得的 溶液溶质质量分数为。(计算结果精确到0.1%,下同)(2)、碳酸钠的溶解度在10℃至40℃随温度的升高而(填“增大”或“减小”),在20℃时, 将100g的水加入有30g碳酸钠的烧杯中,充分搅拌后得到的是(填“饱和溶液”或“不饱和 溶液”),将上述烧杯加热到30℃,该烧杯中溶液的溶质质量分数为。(3)、硝酸钾溶液中含有少量氯化钠时,可通过的方法提纯,对上述提纯后析出的晶体和剩余溶液描述正确的是(填序号)。A.剩余溶液一定是硝酸钾饱和溶液 B.剩余溶液中溶质只有氯化钠
C.上述方法可以将两者完全分离 D.析出的晶体硝酸钾没有一定的熔点
23. 如图是甲、乙、丙三种固体物质的溶解度曲线,据图回答下列问题: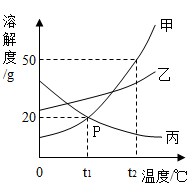 (1)、P点的含义是 。(2)、t2℃时,把50g甲加入到200g水中充分搅拌,静置,形成的是溶液(填“饱和”或“不饱和")。(3)、稍微加热丙的饱和溶液即出现浑浊现象,其原因是。(4)、除去甲中混有的少量乙,步骤是:加水溶解、加热浓缩、、过滤、洗涤、干燥。(5)、将t2℃时等质量的甲、乙两物质的饱和溶液分别降温至t1℃,对所得溶液的叙述正确的是 (填字母序号)。A、溶剂质量,甲>乙 B、析出晶体质量:甲 C、溶质质量分数:甲<乙 D、溶液质量:甲>乙24. 下表是硝酸钾、 氯化钠在不同温度下的溶解度。
(1)、P点的含义是 。(2)、t2℃时,把50g甲加入到200g水中充分搅拌,静置,形成的是溶液(填“饱和”或“不饱和")。(3)、稍微加热丙的饱和溶液即出现浑浊现象,其原因是。(4)、除去甲中混有的少量乙,步骤是:加水溶解、加热浓缩、、过滤、洗涤、干燥。(5)、将t2℃时等质量的甲、乙两物质的饱和溶液分别降温至t1℃,对所得溶液的叙述正确的是 (填字母序号)。A、溶剂质量,甲>乙 B、析出晶体质量:甲 C、溶质质量分数:甲<乙 D、溶液质量:甲>乙24. 下表是硝酸钾、 氯化钠在不同温度下的溶解度。温度/℃
0
10
20
30
40
50
硝酸钾
13.3
20.9
32
45.8
64
85.5
氯化钠 35.7
35.8
36
36.3
36.6
37
温度/℃
60
70
80
90
100
硝酸钾
110
138
169
202
246
氯化钠
37.7
37.8
38.4
39
39.8
(1)、以上两种物质溶解度的变化受温度影响较小的是。(2)、30 ℃时,硝酸钾的溶解度是克。(3)、硝酸钾溶液中含有少量氧化钠时,可通过的方法提纯。(4)、对(3)中析出的晶体和剩余溶液描述正确的是(填编号)。I.剩余溶液一定是硝酸钾饱和溶液
II.剩余溶液一定是氯化钠不饱和溶液
Ⅲ.上述方法可以将两者完全分离
IV.析出的晶体中只含有硝酸钾
(5)、在一定温度下,将含69克硝酸钾、18克氯化钠的混合物完全溶解在50克水中。改变温度使硝酸钾析出,氯化钠不析出,则温度T(℃)的范围是(硝酸钾和氯化钠溶解度互不影响)。25. 为研究A物质溶液的性质,可进行以下步骤的实验:①称量容器为ag,②将一定量A的溶液倒入容器,称量为bg,③将容器放入恒温箱内,在温度为t℃时进行恒温蒸发,④当观察到溶液刚开始微量结晶时,迅速取出容器,冷却后称量为cg,⑤继续加热蒸发并用余热蒸干,称量为dg。
试求:
(1)、容器内溶质A的质量为 g ,(2)、原溶液中溶质A的质量分数 ,(3)、溶液刚开始微量结晶时,剩余溶液的质量约为g,(4)、温度为t℃时,溶质A的溶解度约为 。26. 如图是对某固体物质的溶液在一定温度下进行恒温蒸发操作的实验记录,请回答:
 (1)、乙中的溶液为(填“饱和"”或“不饱和")溶液。(2)、该固体物质在当时温度下的溶解度为。(3)、甲、乙、丙、丁中溶液溶质质量分数的大小关系是上 。(4)、给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而(填“增大”或“减小”)。27. 秀秀为了比较碘在水和汽油中的溶解性,设计了如图实验进行探究。已知汽油、碘、水之间均不发生化学反应。第一步操作后秀秀发现碘粒几乎没有变化。
(1)、乙中的溶液为(填“饱和"”或“不饱和")溶液。(2)、该固体物质在当时温度下的溶解度为。(3)、甲、乙、丙、丁中溶液溶质质量分数的大小关系是上 。(4)、给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而(填“增大”或“减小”)。27. 秀秀为了比较碘在水和汽油中的溶解性,设计了如图实验进行探究。已知汽油、碘、水之间均不发生化学反应。第一步操作后秀秀发现碘粒几乎没有变化。 (1)、请判断图乙中淡黄色的液体是否是饱和溶液,并说明理由。(2)、图丁中上层紫红色溶液的溶剂是。(3)、分析整个实验过程,山山认为本实验没有控制溶剂的质量相等,无法得到结论,秀秀认为仍可得出“碘在汽油中的溶解性比在水中大”的结论,秀秀的判断理由是 。28. 在室温情况下,甲、乙、丙三种固体分别溶于两个试管和烧杯的水中,现象如下图所示,甲、丙还有剩余固体,乙固体全部溶解。升温到80℃时,发现甲固体全部溶解,乙有固体析出,丙没有明显变化。
(1)、请判断图乙中淡黄色的液体是否是饱和溶液,并说明理由。(2)、图丁中上层紫红色溶液的溶剂是。(3)、分析整个实验过程,山山认为本实验没有控制溶剂的质量相等,无法得到结论,秀秀认为仍可得出“碘在汽油中的溶解性比在水中大”的结论,秀秀的判断理由是 。28. 在室温情况下,甲、乙、丙三种固体分别溶于两个试管和烧杯的水中,现象如下图所示,甲、丙还有剩余固体,乙固体全部溶解。升温到80℃时,发现甲固体全部溶解,乙有固体析出,丙没有明显变化。 (1)、室温时,(选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液。(2)、右图中能表示甲物质的溶解度曲线的是(选填“a”、“b”或“c”,下同),能表示乙物质的溶解度曲线的是。(3)、在t2℃时,曲线a、b、c所代表的三种物质的饱和溶液,溶质质量分数由大到小的顺序是。(用“a b c”填)(4)、在温度时,丙物质的饱和溶液一定比甲物质的饱和溶液溶质质量分数更大。29. 已知:氯化钠和硝酸钾在不同温度下的溶解度如下表。
(1)、室温时,(选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液。(2)、右图中能表示甲物质的溶解度曲线的是(选填“a”、“b”或“c”,下同),能表示乙物质的溶解度曲线的是。(3)、在t2℃时,曲线a、b、c所代表的三种物质的饱和溶液,溶质质量分数由大到小的顺序是。(用“a b c”填)(4)、在温度时,丙物质的饱和溶液一定比甲物质的饱和溶液溶质质量分数更大。29. 已知:氯化钠和硝酸钾在不同温度下的溶解度如下表。温度
10℃
20℃
30℃
40℃
50℃
60℃
70℃
80℃
氯化钠溶解度/g
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
硝酸钾溶解度/g
20.9
31.6
45.8
63.9
85.5
110
138
169
(1)、20℃时,将100克氯化钠加入到200克水中,所得溶液的溶质与溶剂的质量最简整数比为。(2)、氯化钠中含有少量硝酸钾,要得到比较纯净的氯化钠,可以采用的方法是;(3)、将含有不溶性杂质的硝酸钾加入到一定量20℃的水中,充分搅拌后仍有100g固体没有溶解。继续升高温度至60℃,充分搅拌后仍有60.8g固体没有溶解。然后将混合物升温到80℃,再充分搅拌,恒温过滤,得到滤渣34.74g则这一定量水的质量是 g,原固体混合物中硝酸钾的质量分数为 。30. 现有 60℃的饱和食盐溶液,与该溶液有关的量有①水的质量;②溶液中溶质氯化钠的质量;③氯化钠的质量分数;④60℃时氯化钠的溶解度;⑤溶液的质量。用序号填空:(1)、将该饱和溶液稀释,不变的量有;(2)、将该饱和溶液降温至 20℃,一定变化的量有。三、解答题
-
31. 如表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。
温度(℃)
0
10
20
30
40
溶解度(g)
13.3
20.9
31.6
45.8
63.9
(1)、10℃时,100g水中最多可溶解硝酸钾的质量为g。(2)、20℃时,将10g硝酸钾加入40g水中,所得溶液溶质质量分数为。(3)、如图是硝酸钾溶液的变化情况,请写出一种可采用的操作方法。(写出计算过程) 32. 某同学将甲、乙固体各30g分别加入100g水中后,进行了如图一所示的实验。甲、乙两种固体的溶解度曲线如图二所示。请回答:
32. 某同学将甲、乙固体各30g分别加入100g水中后,进行了如图一所示的实验。甲、乙两种固体的溶解度曲线如图二所示。请回答:
 (1)、10℃时,甲、乙两种物质的溶解度大小关系:甲乙(选填“<”“>”或“=”)。(2)、m的取值范围:。(3)、40℃时,取等质量的甲、乙两种物质的饱和溶液分别蒸发等量的水后,恢复到40℃。下列说法正确的是____(可多选)。A、恢复到原温度后,溶液中溶剂的质量:甲=乙 B、恢复到原温度后,析出晶体的质量:乙>甲 C、若再降温到20℃时,溶液的质量:甲>乙 D、若再降温到20℃时,溶液的溶质质量分数:甲=乙(4)、40℃时,甲物质饱和溶液的溶质质量分数为(精确到小数点后一位)。33. 氯化钠俗名食盐是工业生产和生活的一种重要原料,也是实验室里常见的一种药品。下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题:
(1)、10℃时,甲、乙两种物质的溶解度大小关系:甲乙(选填“<”“>”或“=”)。(2)、m的取值范围:。(3)、40℃时,取等质量的甲、乙两种物质的饱和溶液分别蒸发等量的水后,恢复到40℃。下列说法正确的是____(可多选)。A、恢复到原温度后,溶液中溶剂的质量:甲=乙 B、恢复到原温度后,析出晶体的质量:乙>甲 C、若再降温到20℃时,溶液的质量:甲>乙 D、若再降温到20℃时,溶液的溶质质量分数:甲=乙(4)、40℃时,甲物质饱和溶液的溶质质量分数为(精确到小数点后一位)。33. 氯化钠俗名食盐是工业生产和生活的一种重要原料,也是实验室里常见的一种药品。下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题:实验序号
水的质量(g)
加入氯化钠的质量(g)
溶液的质量(g)
①
12
3
15
②
12
4
16
③
12
5
16
④
12
6
m
(1)、表中m=;(2)、计算第3次实验得到的氯化钠溶液的溶质质量分数。(写出过程)(3)、20℃时,实验室把100克溶质质量分数为20%的氯化钠溶液释成5%的氯化钠溶液,需加水多少克?(写出过程)34. 溶液的密度与溶质的质量分数之间常存在一定的关系。下表是硫酸溶液的密度及其溶质的质量分数的对照表:(因为温度变化而引起的体积变化忽略不计)。请回答下列问题:溶液中溶质的质量分数
4%
12%
16%
24%
28%
硫酸溶液的密度/(克/厘米3)
1.02
1.08
1.11
1.17
1.20
(1)、随着溶质的质量分数的逐渐增大,硫酸溶液的密度也逐渐 (填“增大”“减小”或“不变”)。(2)、配制4900克28%的稀硫酸用以除锈,需98%的浓硫酸和水各多少毫升?(98%的浓硫酸密度为:1.84克/毫升)(3)、将500毫升4%的硫酸溶液通过真空浓缩的方法浓缩成12%的硫酸溶液,在此过程中需要蒸发多少克水?35. 如表是氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度,回答问题。温度/℃
10
20
30
40
50
60
溶解度/g
NaCl
35.8
36.0
36.3
36.6
37.0
37.3
KNO3
20.9
31.6
45.8
63.9
85.5
110.0
(1)、两种物质中,溶解度受温度影响变化较大的是。(2)、60℃时,按图示操作:
A中溶液是(填“饱和”或“不饱和”)溶液,C中溶液的总质量是克。
(3)、50 ℃时,将两种物质的饱和溶液各100克,分别加热蒸发10克水后,再恢复到50 ℃,剩余溶液的质量:NaCl溶液(填“大于”“等于”或“小于”)KNO3溶液。(4)、10 ℃时,分别将两种物质各40克加入100克水后,求此时NaCl溶液的质量是多少?加热升高20℃后KNO3的溶液的质量溶质分数是多少?36. 预防流感现在最有效的预防方法之一就是用消毒液对空气消毒.深圳市科瑞德消毒用品公司生产二氧化氯消毒液,是国际上公认的新一代强力,广谱,安全,高效的消毒剂,已被世界卫生组织(WHO)列为A1级安全消毒剂.二氧化氯消毒液能够迅速,彻底杀灭各种细菌(大肠杆菌,白色念珠菌等)和病毒(肝炎病毒,流感病毒等).我校决定今天放学后对全校教室、寝室全面消毒.小陈观察到瓶上的标签如下表所示。二氧化氯(ClO2)1000毫升
溶质的质量分数
80%
密度
1.2克/厘米3
相对分子质量
67.5
强腐蚀性,阴冷,密封储藏
(1)、这500毫升二氧化氯消毒液含溶质二氧化氯克。(2)、若将这500毫升二氧化氯消毒液与1000克水均匀混合,所得稀二氧化氯消毒液中二氧化氯的质量分数是多少?(3)、我校欲配制30kg质量分数为20%的稀二氧化氯消毒液用来消毒,需要多少升这种二氧化氯消毒液和多少升水?37. 下表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。温度/℃
0
10
20
30
40
溶解度/克
13.3
20.9
31.6
45.8
63.9
(1)、10℃时,100 克水中最多可溶解硝酸钾的质量为克。(2)、20℃时,将10克硝酸钾加入40克水中,所得溶液溶质质量分数为 。(3)、如图是硝酸钾溶液的变化情况,若操作Ⅰ采用蒸发溶剂的方法,则请计算出需要蒸发的水量。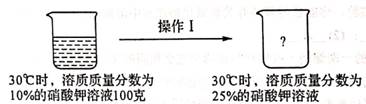
四、实验探究题
-
38. 小华实验操作考试的题目是:配制一定溶质质量分数的碳酸钠溶液.考试时,小华进行了如图1所示的操作:
 (1)、称量时C出现了右盘低的现象,则接下来小华的操作是。(2)、以上实验的正确操作顺序为(用字母表示)。(3)、小华量取蒸馏水的体积如图2所示,则小华配制的碳酸钠溶液中溶质的质量分数为。(4)、下列原因能导致溶质质量分数偏低的是(填序号)。
(1)、称量时C出现了右盘低的现象,则接下来小华的操作是。(2)、以上实验的正确操作顺序为(用字母表示)。(3)、小华量取蒸馏水的体积如图2所示,则小华配制的碳酸钠溶液中溶质的质量分数为。(4)、下列原因能导致溶质质量分数偏低的是(填序号)。①碳酸钠不纯 ②称量时,砝码和药品放错
③向烧杯中倒水时,有水洒出 ④量取水仰视凹液面最低处读数
39. 下表是KCl在不同温度时的溶解度.温度/℃
10
20
30
40
50
60
溶解度/g
27.6
31.0
34.0
37.0
x
42.6
45.5
小明为测定x的值,取4份40℃的水各50g,分别进行实验,并记录数据如下表.
实验编号
实验1
实验2
实验3
实验4
KCl质量/g
5
15
25
35
溶液质量/g
55
65
70
70
请回答下列问题.
(1)、要使实验2的溶液达到饱和,可采取的方法是 .(2)、小明现要配制质量分数为30%的KCl溶液100g,为达实验目的其主要操作是 .五、综合说理题
-
40. 生活中经常看到这样一种现象:夏季的湖面上,许多鱼会在水面上“吹气泡”甚至跃出水面,而冬季几乎没有。在夏季出现雷阵雨前,会有更多鱼会在水面处“吹气泡”,而在夏季的晴朗天,则很少出现这样的情况。请你用学过的科学知识解释以上现象。